寒冷刺激诱导大鼠棕色脂肪组织中的心脏干细胞增多
2011-07-31杨俊杰刘志强王海滨刘剑锋陈韵岱
杨俊杰,刘志强,王海滨,刘剑锋,陈韵岱
干细胞治疗缺血性心脏病正引起基础研究者和临床工作者的极大兴趣。脂肪来源干细胞因其取材方便、易于扩增、多能性好、免疫原性弱等优势,逐渐成为研究热点[1,2]。作为脂肪组织的一种重要类型,棕色脂肪在人体内的活性和作用正受到极大关注。棕色脂肪组织有别于常见的白色脂肪组织,可特异性表达解偶联蛋白(UCP-1)通过解除氧化呼吸链中氢离子梯度而抑制能量物质三磷酸腺苷的产生,并最终将生物反应以热能的形式释放出来[3]。以往认为棕色脂肪只存在于小型哺乳动物和婴幼儿体内,但进一步研究发现成人体内仍存在一定数量但活性较低的棕色脂肪[4]。新近的研究还发现乳鼠的棕色脂肪组织内含有一定数量(0.2% ~4%)的心脏前体细胞(又称心脏干细胞)[5],具有体外自发分化和诱导分化能力[6],较其他干细胞更具运用前景[7]。本研究利用寒冷低温条件饲养大鼠,检测其肩胛部棕色脂肪组织活性变化;采用已经报道过细胞提取的方法[8],研究寒冷刺激对于肩胛部棕色脂肪中心脏干细胞含量的影响。
1 材料与方法
实验分组:2011-03-01从军事医学科学院实验动物中心购买SD大鼠12只(80~120g)。随机分为2组,每组6只。实验组在寒冷环境下(4℃)饲养,对照组在常温条件(24℃)饲养,均饲养28天。两组饮水量和喂食等处理均相同。
棕色脂肪来源细胞的提取与培养:断颈处死各组大鼠,随后取尽肩胛间区的棕色脂肪组织称重,一部分进行棕色脂肪组织的验证,另一部分运用酶消化法分离培养获得棕色脂肪来源细胞。从SD大鼠肩胛部分离脂肪组织1 g进行细胞提取。分离的脂肪组织以无菌液大量冲洗。随后,用含0.1% Ⅰ型胶原酶、0.1%中性金属蛋白水解酶和0.05%胰酶的无血清培养基在37℃下消化45分钟,后使用含10%的无血清培养基终止消化,并通过75 μm的滤网过滤、红细胞裂解液去除红细胞。最终将细胞进行离心和重悬,并接种至含10%胎牛血清的培养基中培养,1天后换液弃除未贴壁细胞,每隔两天观察并换液。
棕色脂肪组织形态及活性:经冰冻切片包埋剂固定的大鼠肩胛间区的棕色脂肪组织标本经切片后,使用苏木素伊红染色法染色并观察棕色脂肪组织形态。组织蛋白经处理后使用western blot方法检测UCP-1表达情况。
细胞表面标记物的检测:提取得到的棕色脂肪来源细胞经过红细胞裂解液处理后,使用表面标记物CD29、CD34、CD45、CD90 和 CD133 抗体,按照厂家说明加入以上抗体,使用流式细胞仪鉴定。
自发分化心肌样细胞的检测:以1×105/cm2、5×104/cm2、1×104/cm2、5×103/cm2、1×103/cm2的细胞密度接种。培养4周后进行免疫荧光检测。免疫荧光检测:取出预先置入的细胞爬片固定。经0.1%TrionX-100打孔,分别在肌钙蛋白-T(cTnT)抗体(1∶200)和α-横纹肌辅肌动蛋白(α-SCA)抗体(1∶200)中4℃孵育过夜。随后以二抗标记,并染核,在荧光倒置显微镜下观察物镜40×视野下绿色荧光范围中的细胞核数量与总核数量的百分比。
核糖核酸(RNA)提取和逆转录多聚酶链反应分析:分化后的细胞培养皿中,在倒置位差显微镜下选取狭长成簇的细胞进行消化和提取。Trizol法提取各自总RNA,以大鼠心肌组织作为阳性对照。按逆转录试剂盒(TIANGEN)方法步骤逆转录并进行多聚酶链反应扩增,最后进行凝胶成像。在多聚酶链反应扩增中使用的引物包括:cTnI(5’-CTCGGAGTATCAGGAAGAGCACA;3’-TAAACTTGCCACGCAGGTCATAG,216 bp),GATA-4(5’-CTGTCATCTCACTATGGGCA;3’-CCAAGTCCGAGCAGGAATT,257bp),Nkx2.5(5’-CAGTGGAGCTGGACAAAGCC;3’-TAGCGACGGTTCTGGAACCA,216 bp),MEF-2C(5’-AGCAAGAATACGATGCCATC;3’-GAAGGGGTGGTGGTACGGTC,347 bp),β-Actin(5’-AGAGGGAAATCGTGCGTGAC;3’-AGGAGCCAGGCAGTAATC,353 bp)。
反应条件为:各反应体系先94℃预变性3 min,接着35个循环扩增(94℃变性30 s,55℃退火30 s,72℃延伸1 min),最后延伸5 min至22℃。
统计学方法:数据以均数±标准差(x±s)表示,应用SPSS 13统计软件进行统计分析,组间比较采用t检验或方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 寒冷刺激后的棕色脂肪形态与活性表达
寒冷刺激后,肩胛部棕色脂肪组织的形态特征较对照组发生相应变化,具体表现为脂肪细胞线粒体弥漫增多,脂肪滴变小,脂肪组织毛细血管基质增生。进一步检测发现实验组棕色脂肪组织中特异性功能蛋白UCP-1的表达量明显增加。(图1)
2.2 提取的棕色脂肪来源细胞中的表面标志物表达
细胞流式检测发现,实验组表面标记物CD29、CD133和CD29/CD133表达分别为(22.93±1.88)%、(15.12±1.47)% 和(9.13±1.23)%,均明显高于对照组(16.31±1.52)%、(7.83±0.90)%和(4.22±0.62)%,差异均有统计学意义(P<0.01)。而间充质细胞特异性表面抗原以及造血干细胞表面特异性抗原的表达,在两组中差异均未见统计学意义(P>0.05)。

图1 棕色脂肪形态与活性表达。1A:常温饲养后提取的棕色脂肪组织形态(HE染色)。1B:低温饲养后提取的棕色脂肪组织形态(HE染色)。1C:特异性蛋白UCP-1在两组棕色脂肪组织中的表达 HE:苏木素伊红 UCP-1:解偶联蛋白-1 β-actin:β-肌动蛋白
2.3 自发分化后的心肌样标志物表达
定期显微镜下观察,棕色脂肪来源细胞经体外培养逐渐出现心肌细胞的形态学和功能变化:细胞在1周时多数细胞贴壁铺展生长,细胞分化数量较少,但有一定数量圆状成簇样细胞存在;2~4周后,狭长的细胞明显增多,并表现为自发搏动的状态。进一步免疫荧光检测发现,该狭长型、具有自发搏动能力的细胞簇,可表达心肌样特异性标志物cTnT和α-SCA。(图2)
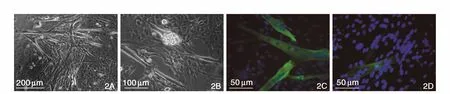
图2 自发分化后的心肌样标志物表达。2A:光镜下细胞形态(×10)。2B:光镜下细胞形态(×20)。2C:表达肌钙蛋白-T。2D:表达α-横纹肌辅肌动蛋白
不同接种密度下棕色脂肪来源细胞自发分化cTnT阳性细胞的比例:实验组的自发分化cTnT阳性细胞比例显著高于对照组,差异均有显著统计学意义(P<0.01)。实验组棕色脂肪来源细胞自发分化cTnT阳性细胞比例最高为(27.3±2.8)%,而对照组最高只有(4.1±0.7)%。(表1)

表1 不同接种密度下两组棕色脂肪来源细胞自发分化肌钙蛋白-T阳性细胞的比例(x±s)
2.4 心脏特异因子的表达
逆转录多聚酶链反应结果显示,心肌细胞特异因子(肌钙蛋白I、肌细胞增强因子-2C)和转录因子(转录因子GATA结合蛋白-4、同源框蛋白Nkx2.5转录因子)能够在棕色脂肪来源细胞自发分化后的类心肌细胞中检测出,但是较正常心肌组织表达量相比仍较为微弱。图3

图3 棕色脂肪来源细胞自发分化后的心脏特异因子和转录因子逆转录多聚酶链反应分析。1:棕色脂肪来源的类心肌细胞;2:大鼠心肌细胞(阳性对照);3:阴性对照。n=6。cTnI:肌钙蛋白-I;MEF-2C:肌细胞增强因子-2C;GATA-4:转录因子GATA结合蛋白-4;Nkx2.5:同源框蛋白Nkx2.5转录因子;β-actin:β-肌动蛋白
3 讨论
发现寒冷刺激后大鼠肩胛部棕色脂肪来源细胞的体外心肌自发分化现象显著增加。同时,其肩胛部棕色脂肪组织形态结构发生相应的显著变化,特异性蛋白明显过表达,提示寒冷刺激下棕色脂肪组织活性显著增强可能与上述现象有关。
相关文献指出,棕色脂肪来源细胞中的CD29阳性和CD133阳性的细胞,具有高度自发分化为心肌分化的能力[9]。本实验发现,寒冷刺激下棕色脂肪组织来源细胞表面标志物中CD29和CD133所占比例明显升高,而且CD133表达阳性的细胞中有更多的表达CD29。虽然我们没有做其它心脏干细胞特异抗原的检测,但是在后续的体外培养中发现,经过4周无分化诱导培养基培养,寒冷刺激组中的心肌分化效率明显增高。运用逆转录多聚酶链反应也鉴定了狭长细胞中的心肌特异性基因表达情况。同时细胞接种密度也影响着心肌自发分化的效率:通过设立不同接种细胞数目的分组,发现寒冷刺激组比常温饲养组中的心肌特异性标记肌钙蛋白表达效率明显增高,这些都说明寒冷刺激组的棕色脂肪来源细胞体外心肌自发分化现象更为明显,因而可以推测该组中的棕色脂肪中含有更多的心脏干细胞。尽管如此,完整的心肌细胞还需要成熟的膜电位和缝隙连接证实,这也是本实验的不足之处。
从组织起源角度,脂肪组织和肌纤维组织都来源于胚胎中胚层。研究发现,白色脂肪和棕色脂肪的起源不尽相同,相比之下,棕色脂肪细胞与肌细胞更倾向于具有相同的前体干细胞来源。因此在棕色脂肪组织中发现肌细胞的前体细胞,甚至心脏干细胞及其自发分化的现象,确实具有一定的理论和前期研究基础。虽然也有报道指出,白色脂肪组织中提取的细胞也具有体外分化心肌的能力,但效率非常低[10]。
在其他混杂因素被严格控制的前提下,以上的实验结果说明寒冷刺激下,棕色脂肪活性与其中心脏干细胞含量有一定联系。近年来,多项人体影像学研究显示,成人体内仍然存在棕色脂肪,只是在寒冷、饥饿等状态下,棕色脂肪组织的功能进一步活化以至可以被PET等技术检测[11]。人体心脏内甚至也含有存在活性的棕色脂肪组织,在寒冷诱导下同样可以被检测到[12],更说明心脏修复与棕色脂肪组织之间存在一定关联。我们有理由推测,棕色脂肪组织中的心脏干细胞,极有可能参与心脏的修复,并在寒冷等因素影响下,心脏干细胞的动员或增殖能力加强,使得体内心脏干细胞活性或绝对数量相应增加,可以更有效的修复受损心肌,改善心脏功能,降低心脏病预后。本研究对于拓展心脏干细胞的理念以及深入研究心脏干细胞治疗都具有重大意义。
另一方面,棕色脂肪在成人体内确实较少,但是当棕色脂肪的转化和扩增技术不再成为难题的时候,棕色脂肪组织或许可以在心脏病干细胞治疗领域发挥巨大作用。如何进一步纯化并分选棕色脂肪组织中的心脏干细胞,是下一步研究需要弄清的问题。同时,棕色脂肪在寒冷中的活性变化由诸多因素参与介导[13,14],心脏干细胞含量增多的具体机制与哪些因素有关还不得而知[15,16],也将成为进一步的研究方向。
[1]张卫泽,陈跃武,陈永清,等.5-氮胞苷体外诱导成人脂肪间充质干细胞分化为心肌样细胞的初步研究.中国循环杂志,2006,3:228-231.
[2]Palpant NJ,Metzger JM.Aesthetic cardiology:adipose-derived stem cells for myocardial repair.Curr Stem Cell Res Ther,2010,5:145-152.
[3]Richard D,Picard F.Brown fat biology and thermogenesis.Front Biosci,2011,16:1233-1260.
[4]Biljana B,Aleksandra K,Vesna P,et al.Adaptive changes in interscapular brown adipose tissue during reacclimation after cold:The role of redox regulation.J Therm Biol,2007,32:261-269.
[5]Yamada Y,Wang XD,Yokoyama S,et al.Cardiac progenitor cells in brown adipose tissue repaired damaged myocardium.Biochem Biophys Res Commun,2006,342:662-670.
[6]Yamada Y,Yokoyama S,Fukuda N,et al.A novel approach for myocardial regeneration with educated cord blood cells cocultured with cells from brown adipose tissue.Biochem Biophys Res Commun,2007,353:182-188.
[7]Cypess AM,Lehman S,Williams G,et al.Identification and importance of brown adipose tissue in adult humans.N Engl J Med,2009,360:1509-1517.
[8]Liu Z,Wang H,Zhang Y,et al.Efficient isolation of cardiac stem cells from brown adipose.J Biomed Biotechnol,2010,2010:104-296.
[9]Yamada Y,Yokoyama S,Wang XD,et al.Cardiac stem cells in brown adipose tissue express CD133 and induce bone marrow nonhematopoietic cells to differentiate into cardiomyocytes.Stem Cells,2007,25:1326-1333.
[10]Jumabay M,Zhang R,Yao Y,et al.Spontaneously beating cardiomyocytes derived from white mature adipocytes.Cardiovasc Res,2010,85:17-27.
[11]Nedergaard J,Bengtsson T,Cannon B.Unexpected evidence for active brown adipose tissue in adult humans.Am J Physiol Endocrinol Metab,2007,293:E444-452.
[12]Virtanen KA,Lidell ME,Orava J,et al.Functional brown adipose tissue in healthy adults.N Engl J Med,2009,360:1518-1525.
[13]Petrovic V,Buzadzic B,Korac A,et al.NO modulates the molecular basis of rat interscapular brown adipose tissue thermogenesis.Comp Biochem Physiol C Toxicol Pharmacol,2010,152:147-159.
[14]Seebacher F,Glanville EJ.Low levels of physical activity increase metabolic responsiveness to cold in a rat(Rattus fuscipes).PLoS One,2010,5:e13022.
[15]王蕾,张世杰,王海鹏,等.阿托伐他汀对兔舒张性心力衰竭模型心室重构的影响.中国循环杂志,2010,25:223-226.
[16]张爱东,郭军,李自成,等.胰岛素样生长因子-1预处理对大鼠骨髓间充质干细胞移植效率及心肌修复的影响.中国循环杂志,2011,26:57-60.
