天然产物的金属铜配合物研究进展
2011-07-25江仁望
蔡 放,江仁望,2
(1.暨南大学 中药及天然药物研究所,广东 广州 510632;2.暨南大学 中药药效物质基础及创新药物研究广东省高校重点实验室,广东 广州 510632)
自1967年美国科学家Rosenberg发现顺铂的抗癌活性以来[1],基于金属配合物的药物研究得到了迅速发展[2-5]。近年的研究发现,微量金属元素在中药的药效方面也起着重要作用,因为在传统的中药制剂过程中,金属离子常常经煎煮进入汤剂中,可与中药中的成分如生物碱、黄酮、香豆素、蒽醌、有机酸等形成配合物[6]。一些金属离子与天然产物形成配合物后往往改变或增强天然产物的活性,例如抗肿瘤、抗氧化等[7]。因此,将活性天然产物与金属离子进行配合,发挥两者的协同作用,是提高天然产物活性的有效途径[8-9]。
铜离子是中药中的一种常见微量元素,在多种中药中均可检测到铜离子,例如黄芪[10]、丹参[11]、复方中药天保宁片[12]等。铜也是一种人体必需的微量元素,主要以铜蛋白的形式[13](如细胞色素C氧化酶、超氧化物歧化酶等)存在于人体器官内。铜离子具有强氧化性,常与内源性DNA的氧化损伤有关[14-16]。铜离子能与多种天然产物配体进行配位,并显示了多变的结构特征及较强生物活性,如抗癌活性、抗菌、抗氧化等[17-21]。本文对各类天然产物的铜离子配合物的结构及生物活性进行综述。
1 各类天然产物的铜配合物
1.1 内酯类配合物
1.1.1 香豆素类衍生物
4-甲基-6,7-二羟基香豆素可与溴乙酸甲酯反应生成二氧乙酸-4-甲基-香豆素-6,7-二氧乙酸(4-methylcoumarin-6,7-dioxyacetic acid)。后者再与dicopper(II)tetraacetate dihydrate反应生成香豆素的铜配合物(1)[22],其合成过程如图1所示。铜离子分别与邻菲罗啉配体中的4个氮原子和香豆素配体中的1个羧基氧原子相连,形成以铜离子为中心的三角锥型结构,该配合物的结构用单晶X-射线衍射法进行了表征。化合物(1)可抑制肾癌细胞A498及肝癌细胞HepG2的增殖,IC50分别达到(2.0±1.2)μM 及(1.3±0.8)μM[23]。
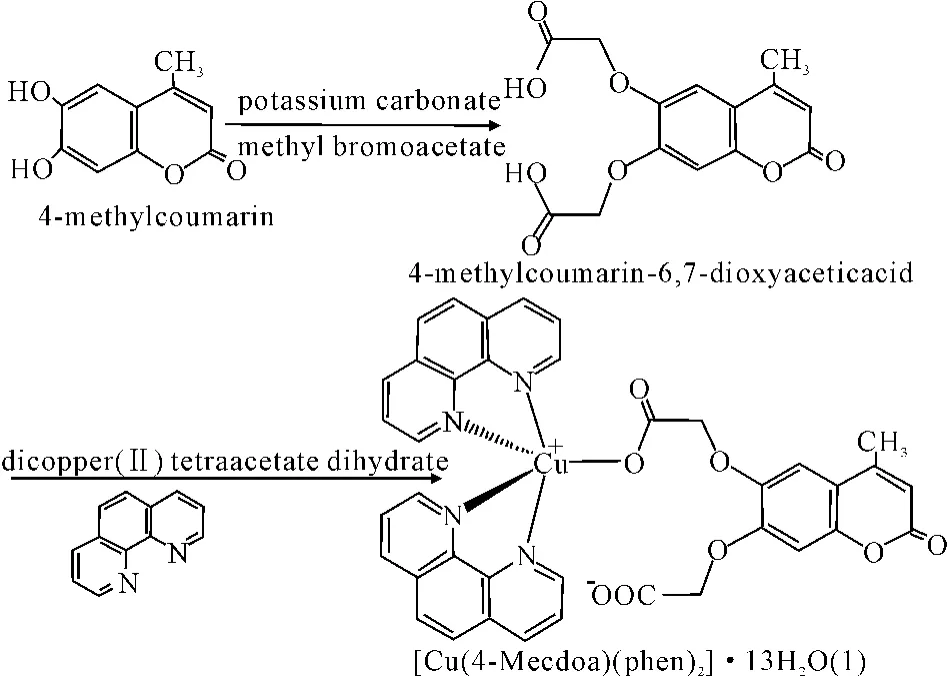
图1 铜配合物(1)合成过过程
1.1.2 去甲斑蝥素
斑蝥是芫菁科鞘翅类昆虫,是一种常用抗肿瘤中药。现代研究表明斑蝥素为斑蝥的抗癌有效成分,可用于治疗原发性肝癌。去甲基斑蝥素为斑蝥素的衍生物,与斑蝥素相比,去甲基斑蝥素对泌尿道和消化道的刺激较低[24]。利用联吡啶的DNA靶向作用以及去甲基斑蝥酸根所具有的抗癌作用,研究人员合成了2,2′-联吡啶去甲基斑蝥酸根合铜(Ⅱ)的桥联三元配合物(2),并研究了它的结构特征。在此配合物中,两个铜原子呈六配位的拉长畸变八面体构型。通过红外光谱分析可知[25],配合物分子中存在两种不同配位形式,一种是以单氧形式与铜原子配合,另一种是以双氧形式与铜原子配合。
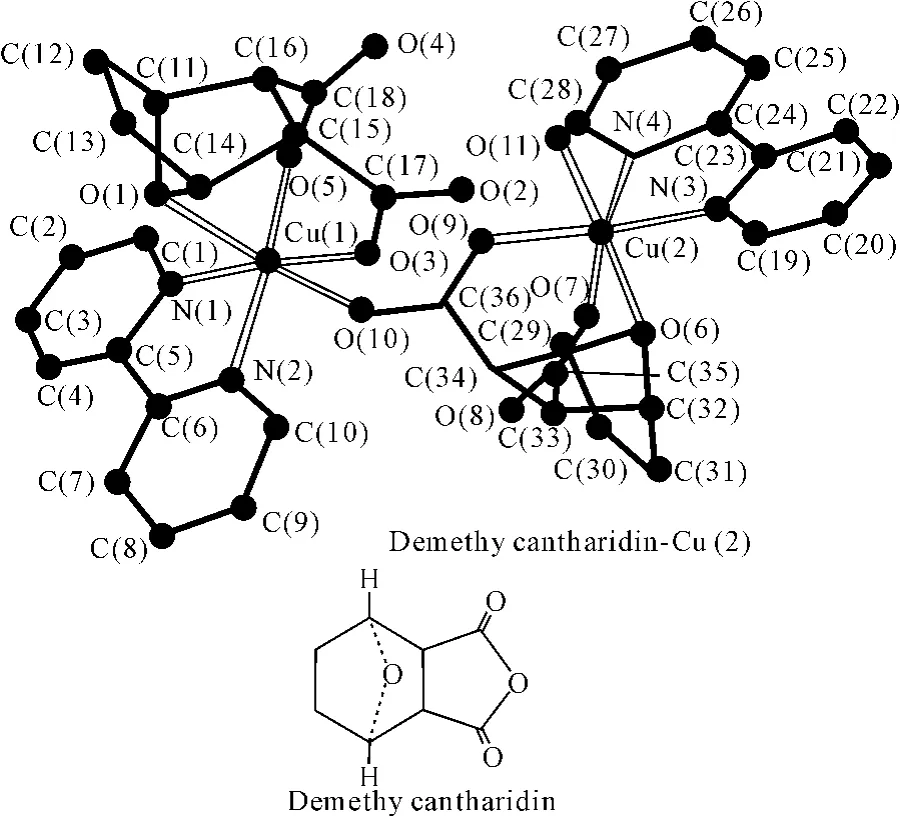
图2 铜配合物(2)结构
1.2 醌类配合物
当醌类化合物的结构中有α-酚羟基或邻二酚羟基结构时,能与金属离子发生配位作用,生成金属配合物。研究发现这些配合物的抗菌及抗癌活性比原配体有所提高[8]。
白花丹素(plumbagin)(5-羟基-2-甲基-1,4-萘醌,简称PLN)是中药白花丹中的主要成分,具有抗肿瘤活性[26-27]。白花丹素可与氯化铜形成稳定的二齿配合物(3)[Cu(PLN)2]·2H2O,铜离子通过四键与PLN的氧原子反式连接[28]。此外,白花丹素亦可与硝酸铜及联吡啶的混合物形成稳定的配合物[Cu(PLN)(bipy)(H2O)]NO3·2H2O(4),铜离子通过两键与联吡啶连接,另四键与PLN的氧原子连接,化合物(3)、(4)的结构均得到单晶衍射分析的证实[28],如图3、4所示。
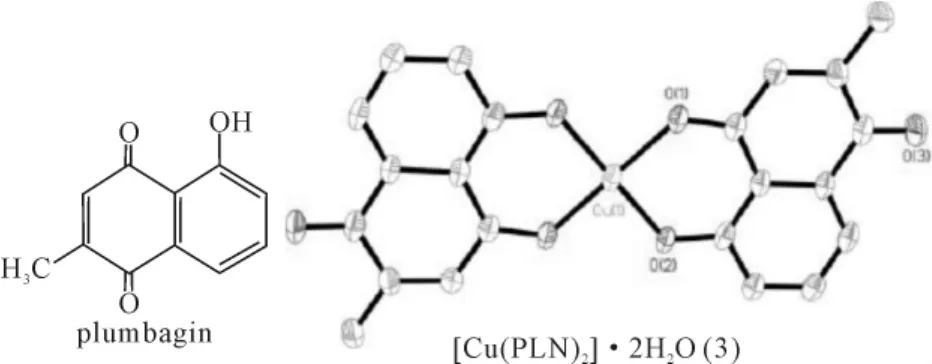
图3 化合物(3)结构
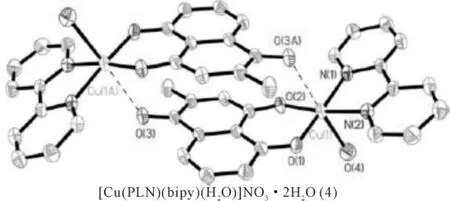
图4 化合物(4)结构
天然产物散沫花素(1awsone,2-hydroxy-1,4-naphthoquinone)通过2-2’位连接,形成具有铰链式结构的萘醌二聚(H2bhnq,2,2′-bi(3-hydroxy-1,4-naphthoquinone)。Yamada等用化合物H2bhnq与金属离子的进行配位反应得到结构新颖的多聚体结构[29]。例如与铜离子配位时形成的锯齿式(Zigzag)结构(5)。
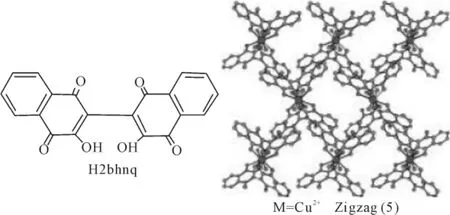
图5 化合物(5)结构
1.3 黄酮类配合物
黄酮类化合物(flavonoids)是许多中草药的有效成分。黄酮类化合物的分子骨架由两个苯环和一个吡喃环组成,具有超离域度,整个分子形成一个大π键共轭体系[30]。其分子结构中往往具有3-羟基、4-羰基;或5-羟基、4-羰基;或邻二羟基结构,这种空间结构有利于与金属形成配合物[31]。
(1)当黄酮结构中存在3-羟基,5-羟基及邻二酚羟基的结构时,3-羟基、4-羰基会优先与金属发生配位,例如:槲皮素、桑色素。
槲皮素(quercetin)是一种常见黄酮类化合物,它分子结构中具有3,5,7,3′,4′五个羟基和4位的羰基。但是在与金属铜生成配位物(6)时,反应主要发生在3位羟基和4位的羰基,5-OH 和3′,4′邻羟基几乎不发生反应[32-33]。
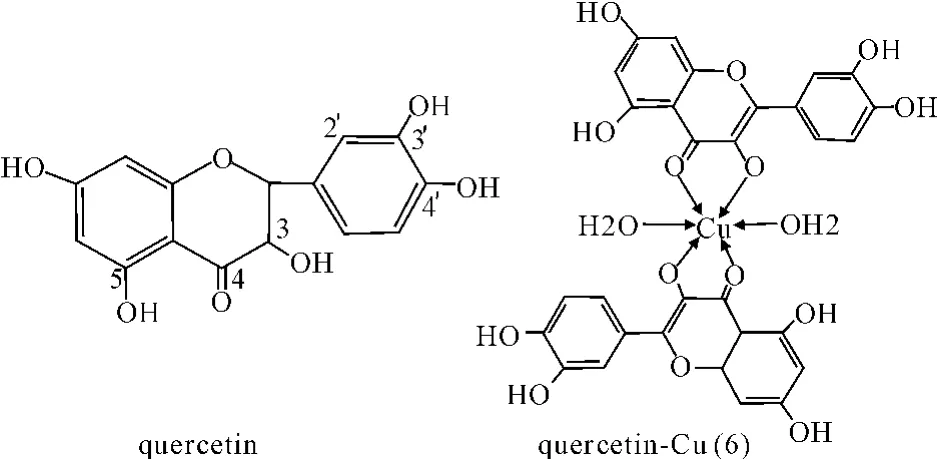
图6 配合物(6)结构
桑色素(Morin)可与铜(Ⅱ)形成1∶1的配合物(7)。通过紫外光谱、核磁共振等方法对配合物的结构进行分析,发现与槲皮素类似,3位的羟基和4位的羰基与铜离子进行配位,而5位羟基没有参与反应。推测可能原因为铜离子可与桑色素形成一个五元环平面,从而使得配合物的稳定性得到增强[34-35]。
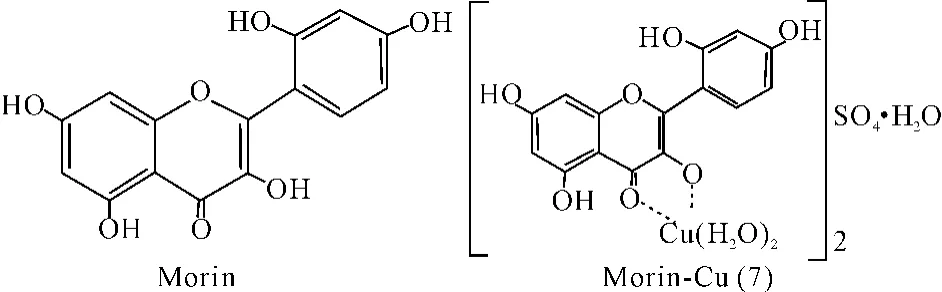
图7 配合物(7)结构
(2)当分子结构中不存在3-羟基时,则配位反应可发生在5-羟基、4-羰基上。
橙皮素(Hesperetin)、柑桔素(Naringenin)和芹菜素(Apigenin)分别能与铜离子形成配合物(8-10)。通过紫外光谱、红外光谱等方法对配合物的结构分析表明,4位羰基和5位羟基与铜离子进行了配位反应[36]。
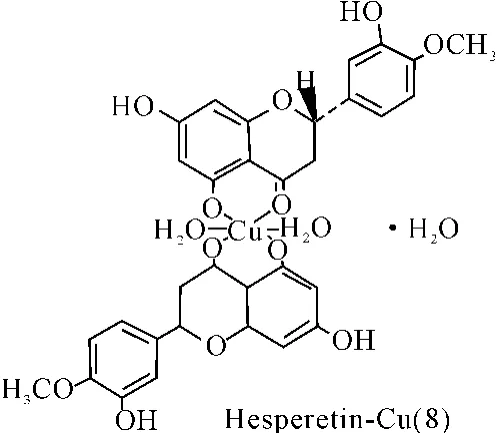
图8 配合物(8)结构
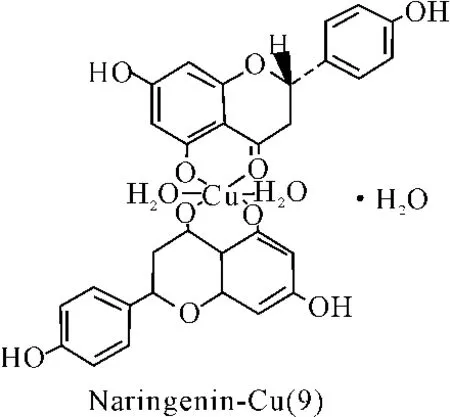
图9 配合物(9)结构
1.4 多酚类配合物
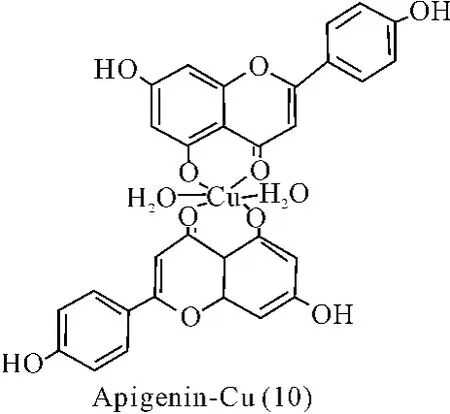
图10 配合物(10)结构
天然产物中的多酚类化合物是常见的天然抗氧化剂,能抑制人体内的低密度脂蛋白(LDL)的氧化,如茶叶中的茶多酚等[37]。这些多酚类天然产物能够很好地与金属离子形成配位。
姜黄素(Curcumin)可以与铜(Ⅱ)离子分别以1∶1和1∶2的比例配合形成的姜黄素-铜的配合物。药理活性研究表明,配合物具有清除自由基活性及超氧化物歧化酶(SOD)样作用。并且1∶1的配合物(11)的SOD样作用是1∶2的配合物(12)的十倍。结构分析显示,两个羰基参与配位反应,并且1∶1的配合物的稳定性大于1:2配合物。配合物的稳定性可能是影响姜黄素-铜配合物的抗氧化及SOD样活性的一个关键因素[38]。
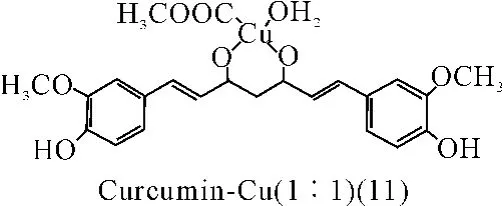
图11 配合物(11)结构
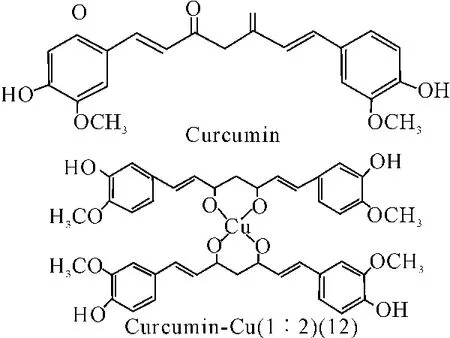
图12 配合物(12)结构
丹皮酚(Paeonol)是具有抗炎活性的化合物。将丹皮酚与硝酸铜溶液在二乙基三胺存在的条件下进行配位反应,Cu2+能与丹皮酚的羟基及二乙基三胺的三个氮原子进行配位得到配合物(13)。研究表明,丹皮酚在与金属铜离子配合后,其抗炎效果得到增强[39-40]。
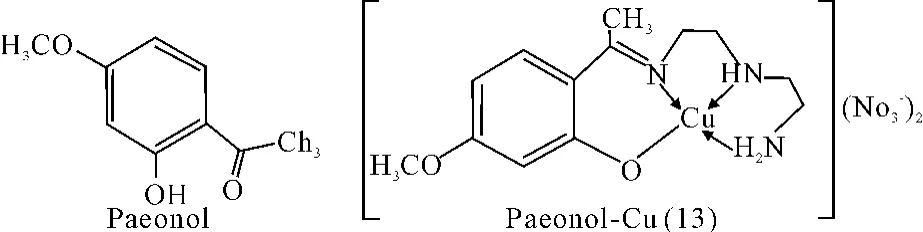
图13 配合物(13)结构
1.5 生物碱类配合物
川芎嗪(ligustrazine)是中草药川芎的有效成分[41],将川芎嗪的无水乙醇溶液与CuCl2反应(1∶1),生成蓝黑色针状结晶。通过扩展X射线吸收精细结构谱(EXAFS)来测定此配合物的配位微环境,可以推测吡嗪环上的两个氮原子分别与邻近的Cu(Ⅱ)配位[42],使Cu(Ⅱ)联结成链。配合物的中心离子Cu(Ⅱ)位于六配位的混配畸变八面体环境中,配合物成为一个无限延伸的聚合大分子(14)[43]。如图16所示。
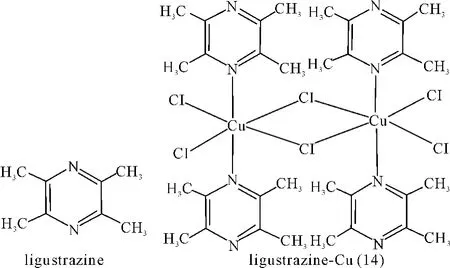
图14 配合物(14)结构
鹰爪豆碱(sparteine)及其异构体具有很强的金属配位能力。用等摩尔的金属铜、四溴化碳、鹰爪豆碱在DMSO溶液中进行反应,可得到两种鹰爪豆碱的铜配合物晶体,一种属三斜晶系(空间群P1,15a),另一种属正交晶系(空间群P212121,a=11.0563,b=11.9877,c=12.8002Å,15b)。有趣的是,用鹰爪豆碱与溴化铜在甲醇溶液中反应,亦可生成正交晶系的鹰爪豆碱的铜配合物,但晶胞参数不同(空间群 P212121,a=18.1609,b=13.3746,c=15.2231Å,15c)。三种配合物的分子结构相同,如图15所示。异鹰爪豆碱为鹰爪豆碱的C11位异构体,它也可与溴化铜在甲醇溶液中反应生成配合物(16)。
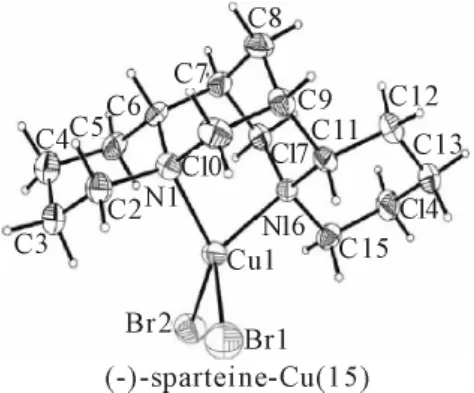
图15 配合物(15)结构
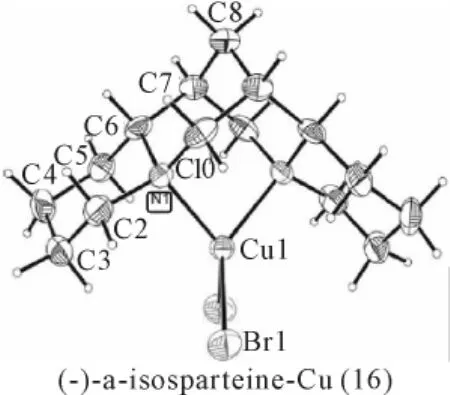
图16 配合物(16)结构
1.6 环肽类配合物
从Lissoclinum属的海鞘中提取的吡咯环肽类的化合物Ascidiacyclamide具有环状多胺结构。它能够跟铜离子发生螯合作用,生成[Cu2(ascidH2)(1,2-μ-CO3)(H2O)2]·2H2O的配合物(17)。每一分子的环肽配合物中,两个铜离子分别和三个供电子的氮原子和一个碳酸盐中的氧原子相连[45]。海鞘中的吡咯环肽类化合物的生物活性可能与金属离子的配合有关[46]。
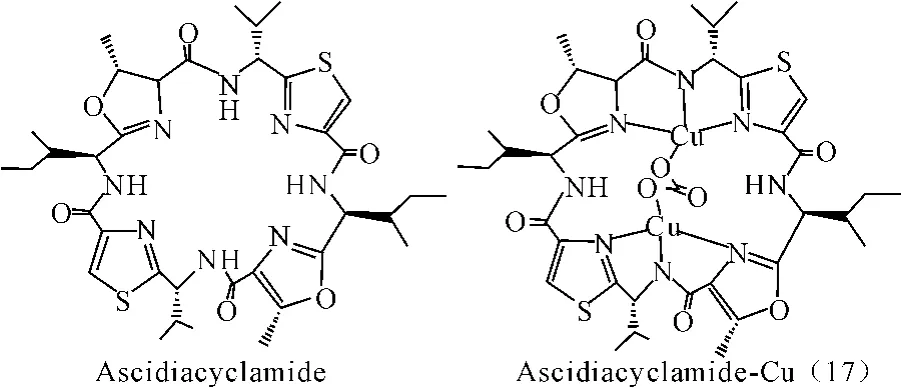
图17 配合物(17)结构
2 铜配合物的生物活性
2.1 铜配合物的抗癌作用
甲基斑蝥酸钠-2,2′-联吡啶合铜(2)具有较强的抗癌活性。分别在0.1、1、10μmol/L的配合物浓度下,对人白血病细胞 HL-60、人胃癌细胞BGC-823及人肝癌细胞Bel-7402具有抑制作用。在10μmol/L的配合物浓度下,对三种癌细胞的抑制率分别达到15.36%、23.44%及24.43%,在同样浓度下,去甲基斑蝥酸钠的抑制率分别为5.44%,12.93%,13.62%,可见配位后,化合物的抗癌作用得到增强。配位增强抗癌作用机制可能是加入联吡啶合Cu(Ⅱ)结构后增加了配合物的亲脂性,使其更易跨膜进入细胞内发挥药效,并且联吡啶合铜平面能插入DNA结构中,破坏DNA碱基对之间的氢键作用,从而使癌细胞DNA的复制受到抑制[25]。
通过 MTT法,研究两种白花丹素-铜的配合物[Cu(PLN)2]·2H2O(3)、[Cu(PLN)(bipy)(H2O)]NO3·2H2O(4)对肾癌细胞786-O、乳腺癌细胞 MCF-7、肝癌细胞HepG2、鼻咽癌细胞CNE2、结肠癌细胞HCT116等的抑制情况,白花丹素-铜配合物对多种肿瘤细胞的增值有明显的抑制作用,IC50在2.0~12.9μmol/L的范围内,并且明显强于白花丹素本身的活性(IC5012.9~67.6μmol/L)[28],提示白花丹素与铜离子之间可能具有协同抗癌作用。
同样,用MTT法研究橙皮素、柑桔素和芹菜素的铜配合物(8)、(9)、(10)的抗癌活性。分别在不同的浓度下进行实验,发现化合物(8)及(10)对 HepG2、SGC-7901肿瘤细胞的抑制率在36%~43.8%之间,而化合物(9)只对HepG2细胞(36%)表现出比较明显的抑制作用,说明黄酮-铜配合物的抗癌活性具有一定的选择性[36]。
桑色素本身具有抗癌活性,分别用铜和锌与桑色素进行配合,并采用MTT法测定两种配合物对不同的肿瘤细胞的抑制作用。结果显示,桑色素-锌的配合物对HepG2和BHK-21细胞有较强的抑制作用,而桑色素-铜的配合物(7)对HL-60细胞的抑制作用显著,在0.1μM 的浓度下,对HL-60细胞的抑制率为33.14%(计算IC50=6.7×10-5μM[34]。
通过量效实验和时效实验,在0~100μM的浓度下、0~72h的不同时间内,用 MTT法对槲皮素-铜配合物(6)的抗癌活性进行研究,发现(6)对A549癌细胞具有较强的抑制作用。作用机制研究表明,槲皮素-铜的配合物是以镶嵌的方式结合到DNA分子中,从而达到氧化性损伤DNA来抑制癌细胞DNA的复制,最终产生抑制癌细胞增殖的作用[33]。
2.2 铜配合物的抗氧化作用
通过采用DPPH法和NBT法分别测定了槲皮素-铜配合物(6)对DPPH·和超氧阴离子(O2-·)的清除作用。结果显示,槲皮素-铜配合物能有效清除DPPH·和O2-·,且清除能力均强于槲皮素本身。
用同样的方法,对柑橘素及其铜配合物进行抗氧化活性测定。发现柑橘素-铜配合物(9)在10μM的浓度下,对DPPH的清除率达到了35.5%,较单纯的柑橘素本身的DPPH清除率(2%),有很大的提高,即配合物的抗氧化活性较未配合时有显著的提高。
分别从超氧化物的清除率、抑制脂质过氧化作用和自由基清除反应能力三个方面来研究姜黄素-铜配合物的抗氧化活性。结果表明,姜黄素与铜配合后的超氧化物歧化酶样作用强于配位前,并且在1∶1的条件下配合物(11)的抗氧化能力明显强于1∶2的条件下的配合物(12)[38]。
丹皮酚是中药牡丹皮的主要成分,具有抗炎症和利尿的作用,在欧洲被用作抗高血压和镇定剂。分别用铜离子、镍离子与丹皮酚进行配位,通过超氧化物自由基的清除反应来进行抗氧化实验。发现在(3~15)μM的浓度下,丹皮酚的铜配合物(13)对超氧化物的清除作用与配合物浓度成正比关系,清除率从48.53%增加到81.62%[39]。
2.3 铜配合物的抗菌作用
对香豆素衍生物4-甲基-香豆素-6,7-二氧乙酸(4-methylcoumarin-6,7-dioxyacetic acid,4-MecdoaH2)和其铜配合物[Cu(4-Mecdoa)(phen)2]·13H2O(1)分别进行抑菌实验。结果显示,化合物(1)对SA、MRSA等八种细菌的MIC80在24.3~44.7μM 范围内,明显强于原化合物的MIC80(范围为92.6~293.6μM)。说明香豆素的衍生物在与金属铜离子配位后,其抗菌能力有较大程度的提高[23]。
用抑菌圈实验研究丹皮酚-铜配合物(13)四种致病菌(金黄色葡萄球菌、短小芽孢杆菌、大肠杆菌、沙门氏菌)的抑菌活性,在5mM的浓度下,化合物(24)对4种细菌的抑菌圈分别为13.0、15.5、13.1、14.0mm[40]。
通过琼脂稀释法,对柑橘素-铜配合物(9)的抗菌能力进行定量测试。分别对金黄色葡萄球菌(Staphylococcus aureus),大肠杆菌(Escherichia coli),蜡状芽孢杆菌(Bacillus cereus),白色念珠菌(Candida albicans)的 MIC进行测定,发现配合后的柑橘素对这些细菌的抑制作用有所增强。
2.4 铜配合物与蛋白质、核酸的作用
二氢杨梅素(DMY)是藤茶的活性成分,属于双氢黄酮类化合物,主要具有抗菌、降血脂和抗氧化的作用。运用荧光光谱法研究二氢杨梅素-铜配合物与牛血清蛋白(BSA)之间的相互作用,结果表明,DMY-Cu配合物对BSA具有较强的荧光猝灭作用,并且,DMY-Cu与BSA之间的作用力主要是静电作用。
大黄素(EM)具有抗癌、抗菌、利尿的作用,分子结构中的邻羰基和羟基结构能与金属离子进行配位。通过比较EM-Cu(Ⅱ)、EM-Cu(Ⅱ)-yRNA、EM-Cu(Ⅱ)-ctDNA 的荧光光谱,发现在EM-Cu(Ⅱ)配合物中加入核酸后,EM-Cu(Ⅱ)的荧光强度可被ctDNA和yRNA猝灭,表明大黄素-铜的配合物能与核酸发生较强的相互作用。
3 结语
金属铜离子具有较强的配位能力,可与内酯类、黄酮类、醌类及生物碱类等天然产物进行配位,并生成稳定的金属配合物,研究表明配合物比原天然产物具有更强的生物活性(如抗氧化、抗癌、抗菌等)。因此,与金属铜离子配位是一种对天然产物进行结构修饰并增强其药理活性的有效途径。但是目前这些配合物的生物活性研究多是体外实验结果,尚未得到体内实验证实;铜离子增加天然产物配体生物活性的作用机制尚不明确;且在活性增强的同时,其毒性是否增加也不明确。因此上述三个方面仍需要作深入研究。
[1]ROSENBERG B,VANCAMP L,TROSKO J E,et al.Platinum compounds:a new class of potent antitumor agents[J].Nature,1969,222:385-386.
[2]ORVIG C,ABRAMS M J.Medicinal Inorganic Chemistry:Introduction[J].Chem.Rev,1999,99:2201-2203.
[3]CLARKE M J,ZHU F C,FRASCA D R.Non-Platinum Chemotherapeutic Metallopharmaceuticals[J].Chem.Rev.,1999(99):2511-2533.
[4]WONG E,GIANDOMENICO C M.Current Status of Platinum-Based Antitumor Drugs[J].Chem.Rev,1999,99:2451-2466.
[5]JAMIESON E,LIPPARD S J.Stopped-flow kinetic studies of the binding of HMG-domain proteins to cisplatin-modified DNA[J].Chem.Rev,1999(99):2467-2498.
[6]谷学新,叶能胜.金属配合物在天然药物研究及分析中的应用进展[J].分析科学学报,2003,19(4):373-377.
[7]陈振锋,彭艳,谭明雄,等.基于中药活性成分的金属基抗肿瘤药物前期研究[J].化学进展,2009,21(5):929-933.
[8]谭明雄,陈振锋,罗旭健,等.天然药物有效成分的金属配合物研究进展[J].林产化学与工业,2008,28(6):93-99.
[9]钟地长,张淑凤,陈振锋,等.天然产物黄酮类化合物的提取、纯化及其金属配合物的研究进展[J].化学世界,2006(9):561-573.
[10]李书兰,胡育筑.黄芪中微量元素铜形态分析与黄芪多糖作用机理研究[J].广东微量元素科学,2008,15(10):22-28.
[11]沈晓芳,张勇,秦雪梅.火焰原子吸收光谱法测定中草药丹参不同部位金属元素的含量[J].光谱学与光谱分析,2006,26(1):187-188.
[12]董顺福,韩丽琴,刘建华,等.黄芪等中药总黄酮与金属元素含量测定及聚类分析[J].时珍国医国药,2010,21(3):650-652.
[13]百度百科 http://baike.baidu.com/view/2017920.htm.
[14]THEOPHANIDES T,ANASTASSOPOULOU J.Copper and carcinogenesis[J].Critical reviews in oncology/hematol-ogy,2002,42(1):57-64.
[15]BREWER G J.Copper in medicine[J].Curr.Opin.Chem.Biol,2003,7:207-212.
[16]CRICHTON R R,PIERRE J L.Old iron,young copper:from Mars to Venus[J].BioMetals,2001,14(2):99-112.
[17]HENICHART J P,WARING M J,RIOU J F,et al.Copperdependent oxidative and topoisomerase II-mediated DNA cleavage by a Netropsin/4'-(9-acridinylamino)methanesulfon-m-anisidide combilexin[J].Mol.Pharmacol,1997,51(3):448-461.
[18]PATIL B G,HAVINALE B R,SHALLOM J M,et al.yntheses and spectroscopic studies of potential antitumor copper(Ⅱ)complexes with 5-phenylazo-3-methoxysalicylidene thiosemicarbazone and N4substituted thiosemicarbazones[J].J.Inorg.Biochem,1989,36(2):107-113.
[19]FERRARI M B,BISCEGLIE F,PELOSI G,et al.Synthesis,characterisation,X-ray structure and biological activity of three new 5-formyluracil thiosemicarbazone complexes[J].Journal of Inorganic Biochemistry,2001,83:169-179.
[20]HERZBERG R P,CARANFA M J,HECHT S M.On the mechanism of topoisomerase I inhibition by camptothecin:evidence for binding to an enzyme-DNA complex[J].Biochem.1989,28(11):4629-4638.
[21]LEWIS,J S,CONNETT J M,GARBOW J R,et al.Copper-64-pyruvaldehyde-bis(N4-methylthiosemicarbazone)for the prevention of tumor growth at wound sites following laparoscopic surgery:monitoring therapy response with microPET and magnetic resonance imaging[J].Cancer Res.,2002,62:445-449.
[22]THATI B,NOBLE A,CREAVEN B S,et al.Apoptotic cell death:A possible key event in mediating the in vitro antiproliferative effect of a novel copper(II)complex,[Cu(4-Mecdoa)(phen)2](phen=phenanthroline,4-Mecdoa=4-methylcoumarin-6,7-dioxactetate),in human malignant cancer cells[J].Euro.J.Pharm.,2007,569,16-28.
[23]CREAVEN B S,EGAN D A,KARCZ D,et al.Synthesis,characterization and antimicrobial activity of copper(Ⅱ)and manganese(Ⅱ )complex of coumarin-6,7-dioxyacetic acid(cdoaH2)and 4-methylcoumarin-6,7-dioxyacetic acid(4-MecdoaH2):X-ray crystal structures of[Cu(cdoa)(phen)2]8.8H2O and[Cu(4-Mecdoa)(phen)2]13H2O(phen1=1,10-phenanthroline)[J].Inorg.Biochem.,2007,101:1108-1119.
[24]张水泉.肿瘤化学治疗的研究-N-斑蝥素衍生物的合成[J].药学学报,1981,16:784.
[25]尹富玲,申佳,邹佳嘉,等.2′,2′-联吡啶和去甲基斑蝥酸根桥联双核铜(Ⅱ)配合物的合成、结构表征及抗癌活性的研究[J].化学学报,2003(4):556-561.
[26]WURM G,GRIMM H,GERES U.Plumbagin:reactivity,toxicity,and antimicrobial activity of adrosera-and plumbago-natural substances[J].Dtsch Apoth Ztg,1984,43:2128-2132.
[27]LIN L C,YANG L L,CHOU C J.Cytotoxic naphthoquinones and plumbagic acid glucosides from Plumbago zeylanica[J].Phytochemistry,2003,62:619-622.
[28]CHEN Z F,TAN M X,LIU L M.Cytotoxicity of the traditional chinese medicine(TCM)plumbagin in its copper chemistry[J].Dalton.Trans.,2009,48:10824-10833.
[29]YAMADA K,YAGISHITA S,TANAKA H,et al.Metalcomplex assemblies constructed from the flexible hinge-like ligand H2bhnq:Structural versatility and dynamic behavior in the solid state[J].Chem.Eur.,2004,10,2647-2660.
[30]赵兵,徐清海,段丽颖.国内黄酮金属配合物的研究进展[J].化学试剂,2006,28(3):141-143.
[31]谭明雄,陈振锋,罗旭健,等.天然药物有效成分的金属配合物研究进展[J].林产化学与工业,2008,28(6):93-99.
[32]夏玉明,朴惠善,罗惠善.槲皮素铜配合物的合成及其活性研究[J].延边大学学报:自然科学版,2000,26(1):72-73,78.
[33]TAN J,WANG B C,ZHU,L C.DNA binding and oxidative DNA damage induced by aquercetin copper(Ⅱ)complex:potential mechanism of its antitumor properties[J].Biol.Inorg.Chem.,2009,14:727-739.
[34]ZHANG Q,WANG L F,LIU X.Synthesis,characterization and antitumour properties of metal(Ⅱ)solid complexes with Morin[J].Transition Met.Chem.,1996,21:23-27.
[35]PANHWAR Q K,MEMON S,BHANGER M I J.Synthesis,characterization,spectroscopic and antioxidation studies of Cu(Ⅱ)-morin complex[J].Mol.Structure,2010,967:47-53.
[36]TAN M X,ZHU J C,PAN Y M,et al.Synthesis,Cytotoxic Activity,and DNA Binding Properties of Copper(Ⅱ)Complexes with Hesperetin,Naringenin,and Apigenin[J].Bio.Chem.and Applications,2009,1155(10):1-9.
[37]YOSHIOKA H,SENBA Y,SAITO K,et al.Spin-Trapping Study on the Hydroxyl Radical Formed from a Tea Catechin-Cu(Ⅱ)System[J].Biotechnol.Biochem.,2001,8:1697-1706.
[38]BARIK A,MISHRA B,KUNWAR A,et al.Comparative study of copper(II)complexes as superoxide dismutase crimics and free radical scavengers[J].Euro.J.Med.Chem.,2007,42:431-439.
[39]QIN D D,YANG Z Y,QI G F.et al.Crystal structure and biological activities of water-solublenickel(Ⅱ)and copper(Ⅱ)complexes of a Schiff-base derived from paeonol[J].Trans.Met.Chem.,2009,34:499-505.
[40]许同桃.丹皮酚金属配合物的合成及生物活性研究[J].时珍国医国药,2009,20(4):917-919.
[41]王普善.中药川芎化学成分及其生理活性研究的回顾与展望[J].医药工业,1988,(12):553-559.
[42]KURAMOTO H,INOUE M,EMORI S,et al.PMR and ESR of copper(II)complexes incorporating pyrazine analogs as bridging ligands[J].Inorg.Chim.Acta,1979(32):209-215.
[43]田燕妮,杨频.川芎嗪-铜(Ⅱ)配合物的EXAFS测定及结构表征[J].无机化学学报,1993(4):438-439.
