CIK细胞治疗乳腺癌的临床疗效评估
2011-07-25解燕华孟明耀刘运洪郑建平金醒昉侯宗柳
解燕华,左 铁,孟明耀,刘运洪,郑建平,金醒昉,侯宗柳
(昆明市延安医院,云南 昆明 650051)
多种细胞因子诱导的杀伤细胞(cytokines induced killers,CIK) 是一类由多种细胞因子诱导的具有T细胞的抗瘤活性和NK细胞的非MHC限制性杀瘤特点。1991年由斯坦福大学的Schmidt-Wolf等报道后,现成为免疫治疗多种恶性肿瘤应用最为广泛的细胞治疗之一[1]。CIK细胞应用于临床需要足够数量的细胞及良好的活性和细胞毒作用。但CIK细胞对乳腺癌的临床治疗效果有待于进行系统地临床观察。本研究对细胞增殖规律、细胞表型和细胞毒作用进行研究,同时进行近期临床疗效、免疫反应及不良反应的观察。
材料和方法
一、研究对象:35例乳腺癌患者进行CIK细胞治疗(最大年龄82岁,最小31岁,平均年龄56.57岁)。入组标准,组织学或细胞学确诊为乳腺癌患者,接受过乳腺癌的规范化治疗包括手术、化疗,末次治疗至开始接受CIK治疗的间隔时间为4周;无法进行手术、放疗、化疗的中晚期患者,患者预期生存>3个月;PS评分≧60分,无严重的病毒、细菌感染。本研究获本单位伦理学委员会的批准,所有患者或由其法定代理人签署了知情同意书,同意进行此免疫治疗。排除标准,正在接受放疗、化疗或其他全身抗肿瘤治疗者;同时存在其他恶性肿瘤及传染性疾病者;大手术伤口未完全愈合者;怀孕期或哺乳期妇女;存在违反本试验的体检或实验室异常者;对生物制品过无敏反应者。
二、材料:RPMI1640购自美国Gibco公司。抗人CD3单克隆抗体(Anti-CD3 mAb) 购自北京市晶美基因谷科技有限公司。IL-2购自江苏金丝利有限公司。IFN-γ购自上海克隆生物高新技术有限公司。流式试剂CD4FITC/CD8PE/CD3PerCP,CD3 FITC/CD56PE/CD45PerCP购自美国BD公司。胎牛血清购自HyClone公司。淋巴细胞分离液购自天津瑞灏生物制品科技有限责任公司。流式细胞仪为美国BD Calibur FACSTM。酶标分光光度计为美国Bio-Rad Model-680。二氧化碳孵箱为美国Forma SeriesⅡModel 3111。BEL-7404人肝癌细胞株由中国科学院上海生物化学与细胞生物学研究所细胞库提供。
三、方法:1.CIK细胞培养 淋巴细胞提取,采用Ficoll离心分离,将分离的细胞密度调至1×109/L。分别悬于传统RPM I1640培养基 (RPM I1640+100ml/L FBS,2mmol/L谷氨酰胺,100μg/L青霉素,100μg/L链霉素) 和改良RPMI1640培养基(RPM I1640,100ml/L FBS,2mmol/L谷氨酰胺,100μg/L青霉素,100μg/L链霉素,HEPES 20mmol/L,丙酮酸钠8mmol/L,β-巯基乙醇20μmol/L,适量的核苷酸和脱氧核苷酸),加入IFN-γ 1000U/ml,37℃,5%CO2,培养24h后,再加入抗人CD3mAb,50ng/ml,IL-21000U/ml 37℃,5%CO2条件下培养。培养9~12d行体外细胞表型和细胞增殖检测。
2.细胞增值数量和表型测定 于培养当天及9~12d用台盼蓝拒染法计数细胞,计算细胞扩增数量,同时用流式细胞术分析细胞CD3+CD56+。方法参照文献[2]。
3.CIK细胞体外杀伤活性分析 取培养12d患者的CIK细胞作为效应细胞,靶细胞为BEL-7404人肝癌细胞,按效靶比16∶1、8∶1、4∶1比例加入96孔培养板中,另设单独靶细胞组和单独效应细胞组作为对照,在37℃,5%CO2培养48h后,弃未贴壁的死细胞,用1640培养液洗3次,加入5mg/ml MTT 50μl/孔,37℃ 5%CO2培养箱培养4h,然后每孔加入100μl DMSO温育至结晶溶解,在570nm波长处检测吸光值A,计算细胞毒活性[3,4]。

4.免疫治疗计划 每位患者在接受其他标准治疗后4周,在完善治疗前基线评估后,静脉回输CIK细胞,每次近似于2×109个,总体100ml,每3~5次为一疗程。根据患者病情,每个患者进行3~4个疗程治疗。在完成上述规定治疗后,所有患者在接受治疗后即开始进入随访期。
5.疗效评价与观察指标 主要终点评价指标为无肿瘤进展时间,次要终点评价指标为近期疗效和不良事件。无肿瘤进展时间定义为:接受免疫治疗起到肿瘤进展时间。临床疗效评价:若有可评价病灶的患者的临床疗效评定,按照卫生部颁布的实体瘤客观疗效评定标准进行。完全缓解(CR):瘤体完全消失持续至少4周以上;部分缓解(PR):肿瘤最大直径减少50%以上,持续至少4周;病情稳定(SD):肿瘤增大或缩小均不超过25%,无新病灶;病情进展(PD):肿瘤增长大于25%或出现新的病灶。完全缓解+部分缓解为近期有效率,完全缓解+部分缓解+病情稳定为疾病控制率。若无可评价病灶的患者影像学检查发现疾病复发或转移则为病情进展(PD)。接受治疗后第4周、第8周评价近期临床疗效,复查胸部CT,评估临床症状,血常规、血生化常规等;如怀疑有肿瘤转移,加做相关检查。
6.免疫学评价 接受治疗后2周末,评价12例患者治疗前后外周血中CD3+,CD4+,CD8+,CD56+的变化。
7.不良事件 依据美国国立癌症研究所制定的通用药物毒性反应标准,将各种不良事件分为0~Ⅳ度,Ⅰ度+Ⅱ度+Ⅲ度+Ⅳ度为毒性反应发生率。
8.随访 所有患者在疗效评价之后每3个月随访1次,行相关检查。如怀疑有肿瘤转移,加做相关检查。病情进展的患者接受其他治疗方案,仍然接受随访。截止时间为2010年3月31日。
9.统计学分析 数据采用SPSS13.0软件包处理,均数±标准差(SD) 表示,采用t检验,P<0.05为差异有显著意义。
结 果
一、细胞增殖结果:在CIK细胞分离培养3~6d细胞增值较慢,但是当细胞在培养9d以后细胞增殖明显,是一个快速增殖的过程,在12d以后达到了442.66±85.27。
二、细胞表型:CIK细胞在培养12d以后,CD3+CD56+达到了33%以上,在15~18d之后达到了50%左右。说明培养的CIK细胞能得到纯度很高的细胞。
三、细胞毒活性:效靶比为4∶1、8∶1、16∶1时,细胞毒活性分别为37.13±11.44、56.91±10.43和77.06±11.62,其中效靶比为16∶1时细胞毒活性最大。
四、临床疗效评价:35例患者随访时间为3~15个月,患者普遍在输注CIK细胞后精神症状好,同时增强食欲、改善睡眠、增强体力,增加体重。35例患者中,Ⅰ~Ⅱ期24例,Ⅲ~Ⅳ期11例,失访3例。所有的患者均为手术后实行CIK治疗,20例治疗了2个疗程以上。最长随访时间为31月,中期随访时间为15个月。近期疗效评价中,完全缓解24例,部分缓解6例,病情稳定1例,近期有效率为85.71%,疾病控制率为88.57%,无肿瘤进展时间为2~31个月,中位无肿瘤进展时间为15个月。
五、免疫学疗效评价:治疗结束后2周末,所有患者CD3+,CD4+,CD8+均较治疗之前有明显升高(P≤0.001),提示该疗法提高了患者体内的CD3+CD4+,CD8+基础水平,可诱导患者产生特异性的抗肿瘤免疫反应,见附表。
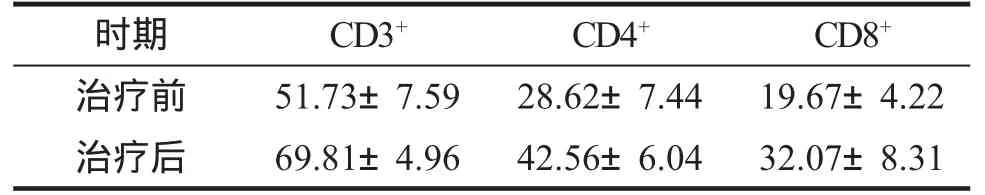
附表 CIK治疗乳腺癌前后的免疫学疗效评价
六、不良事件分析:在接受CIK细胞过继免疫治疗的35例患者中,依据美国国立癌症研究所制定的通用药物毒性反应标准,并未出现Ⅲ度+Ⅳ度的严重不良反应。1例出现一过性发热反应。
讨 论
免疫细胞过继疗法已成为放、化疗后,对肿瘤患者进行辅助治疗的重要手段之一,对于促进患者免疫系统的重建、消除残留病变,以及骨髓净化都具有良好的效果。CIK细胞是一类由多种细胞因子诱导的杀伤细胞,体外实验表明,其具有较好的扩增性能和很强的肿瘤杀伤活性[5,6],而对于自身组织则没有细胞毒作用,但将其应用于临床,必须有足够的数量和较强的细胞毒活性。我们培养中采用最常用的细胞因子组合:IFN-γ+CD3+IL-2刺激诱导CIK细胞增殖,结果表明,细胞纯度在12达到34.44%左右,与文献报道相符。细胞毒活性,CIK细胞培养13d后,对BEL-7404细胞杀瘤率平均是77.06±11.62,达到了较强的细胞毒活性。
本研究中对35例乳腺癌患者治疗后临床疗效主要表现在以下几个方面:一是大多数病例经过手术、化疗等治疗的同时或之后,输注CIK细胞治疗可以在不损伤机体免疫系统结构和功能的前提下,直接杀伤肿瘤细胞,进一步达到清除体内残留癌细胞的目的;二是该疗法提高了患者体内的CD3+CD4+基础水平,可诱导患者产生特异性的抗肿瘤免疫反应,大大提高患者自身免疫力。三是一定程度上减轻病人的痛苦,提高生活质量,同时增强食欲、改善睡眠、增强体力,增加体重。
CIK细胞疗法既可应用于乳腺癌的治疗,对于手术切除、化疗等治疗的同时或治疗后的病人疗效更佳。并且还能调节和增强全身免疫机能,在体内长期发挥抗肿瘤的活性,除可以消灭体内的肿瘤细胞外,还可防止肿瘤复发及转移。更重要的是,CIK细胞疗法对人体正常细胞、机体免疫系统没有任何伤害,是一种安全可靠、无副作用的肿瘤治疗方法。此外,CIK细胞疗法在内科治疗的基础上,对无法进行手术、晚期和高龄患者进行联合治疗,从而达到延长患者生命的目的。
[1]SCHMIDT-WOLF GD,NEGRIN RS,SCHMIDT-WOLF IG.Actived T cells and cytokine-induced CD3+CD56+killer cells[J].Annals ofHematology,1997,74:51-56.
[2]潘春华,罗荣城.CIK细胞的表型分析及生物学活性研究[J].解放军医学杂志,2003,28(11):1030-1032.
[3]任欢,徐红薇.CIK细胞的体外增殖及杀瘤活性的实验研究[J].中国免疫学杂志,1998,14(6):406-408.
[4]李淑艳,杨秀珍.MTT法检测CIK细胞的体外杀瘤活性[J].齐齐哈尔医学院学报,2003,24(1):3-5.
[5]SCHMIDT-WOLF IG,LEFTEROVA P,JOHNSTON V,et al.Propagation of large numbers of T cells with natural killercell markers[J].Br J Haematol,1994,87(3):453.
[6]FINKE S,TROJANECK B,LEFIEROVA P,et al.Increase of proliferation rate and enhancement of antitumor cytoxicity of expanded human CD3+CD56+immunologic effector cells by receptor-mediated transfection with the interleukin-7 gene[J].Gene Ther,1998,5(1):31.
