高能聚焦超声联合三维适形放疗治疗晚期肝癌19例
2011-07-17朱红梅马旭辉苗振静马晶洁翟立广
朱红梅,马旭辉,苗振静,马晶洁,李 霞,翟立广
肝癌是消化系统发生率最高的恶性肿瘤之一,目前治疗方法虽多,但疗效有限,高强度聚焦超声 (high intensity focused ultrasound,HIFU)及三维适形放疗(3-DCRT)肿瘤治疗系统均是肿瘤的物理治疗方法,能取得手术类似的效果,属于无创治疗,较手术有更广泛的适应证,且有互相增敏的作用。2005-03~2008-07对19例原发性肝癌患者采用HIFU联合3-DCRT治疗,现分析总结如下。
1 资料与方法
1.1 一般资料 本组19例。男12例,女7例;年龄30~68岁,平均49岁。所有患者均经组织学检查证实为胆管细胞性或肝细胞性肝癌。病灶数目:肝细胞性肝癌15例中,12例为单个病灶,3例为多发病灶;胆管细胞性肝癌4例中,病灶均为单发。单发病灶平均直径(8.31±3.32)cm,多发病灶平均直径(5.46±2.13)cm。所有患者预计生存期均>3个月,无抗肿瘤治疗禁忌。
1.2 方法
1.2.1 HIFU(北京源德生物医学工程有限公司 FEP-Br02型)
在机载B超下对肿瘤病灶定位,输出功率600~1000 W(200~300 V)。 每次治疗时间约为 30~60 min,间隔 48 h 重复治疗。根据病灶大小确定治疗次数及治疗范围,具体参数:①点距0.5 cm;②平均范围(X-Y轴)在可视肿瘤边缘;③层距0.8~1.0 cm。所有患者局部肿块治疗共132次,毎例平均6次,治疗时密切观察患者反应,如有必要可降低输出功率,如皮肤疼痛剧烈者可适当应用镇痛药物。
1.2.2 3-DCRT 利用体部三维定位框架及真空垫固定患者体位,腹部5 mm层距CT扫描从横隔至髂前上嵴水平,以得到病灶及其上下各5~10 cm全部影像资料。将带有体架的CT扫描结果输入到计划系统中 (北京大恒医疗公司STAR-2000),准确勾画出肝、胃、肾脏、脊髓等重要器官。原发肿瘤临床靶体积(GTV)为可见肿瘤体积(GTV)边缘外扩5~8 mm,转移淋巴结GTV不外扩直接作为GTV,计划靶体积(PTV)则依据肿瘤的部位在GTV的基础上外扩8~15 mm。常规分割和 3-DCRT 均为 2 Gy/次,5 次/周, 总剂量 56~60 Gy,5~6周完成。计划的确定标准:①95%等剂量线覆盖PTV;②正常组织不超过其最大照射耐受剂量,其中脊髓≤45 Gy,肾脏最大剂量点<25 Gy,胃肠的剂量<45 Gy。
1.2.3 评价标准 每周复查AFP、肝功能、血常规情况,治疗结束后1月复查肝脏增强CT,之后每3个月复查肝脏增强CT扫描,记录可测量病灶的变化情况。按照RECTST疗效标准为完全治愈(CR)、部分缓解(PR)、稳定(NC)、进展(PD),临床受益指数=(CR+PR+NC)%。
1.2.4 统计学分析 应用统计软件SPS11.0进行统计学分析,定量数据采用±s表示,采用t检验。
2 结 果
2.1 疗效 治疗结束后1个月,之后每3个月后复查,根据治疗前后的CT片改变评价肿瘤退缩情况。见表1。
表1 原发性肝癌治疗前后可测量病灶CT值(±s,cm)

表1 原发性肝癌治疗前后可测量病灶CT值(±s,cm)
与治疗后3个月比较,★P<0.01
治疗前 治疗后1个月 治疗后3个月 治疗后6个月单发病灶 8.31±3.32★ 6.16±2.19 5.37±1.47 5.26±1.41多发病灶 5.46±2.13★ 4.63±1.98 3.78±1.24 3.69±1.21
2.2 不良反应
2.2.1 肝功能变化 治疗前有18例肝功能指标异常,治疗结束后1周,这19例各项指标均有恢复正常的趋势,其中2例各项指标均回复正常;放疗后AFP均有不同程度的下降,其中有 3例患者放疗前 AFP>500 μg/L,放疗后 1周 AFP<30 μg/L。 见表2。
表2 原发性肝癌治疗前后肝功及AFP变化(s)

表2 原发性肝癌治疗前后肝功及AFP变化(s)
与治疗前比,*P<0.05,△P<0.01
TBIL(μmol/L)AST(U/L)r-GT(U/L)AFP(pg/L)治疗前 29.3±2.5 26.1±4.9 98.4±6.7 700±120治疗 1周后 16.7±2.3△ 13.8±5.1△ 89.7±5.6* 400±90△
2.2.2 全身及消化道反应 红细胞、血红蛋白、红细胞、血小板治疗前、中、后无明显变化,有9例出现不同程度的全身及消化道反应,表现为乏力、恶心。另外3例无任何不适。见表3。
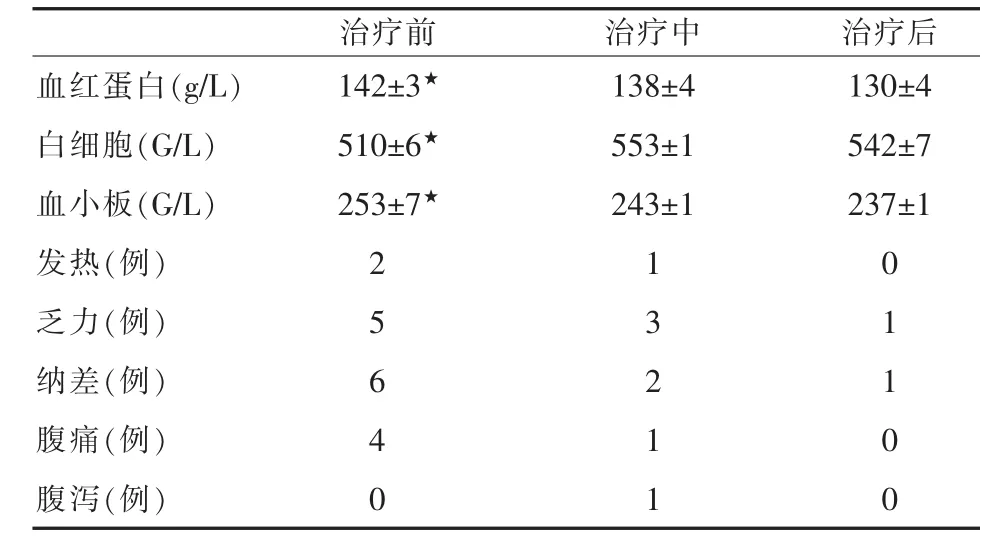
表3 原发性肝癌治疗前后血象变化及全身反应
3 讨 论
原发性肝癌发病率在全球男性中居第7位,女性中居第9位[1],在国内原发性肝癌亦是常见的恶性肿瘤之一,一经发现多数已属晚期,病死率仅次于胃癌和肺癌。对大多数无手术指征或不愿手术治疗的中晚期肝癌,放疗和超声聚焦刀治疗作为无创性治疗手段除肝TACE术外是最有价值的选择。
HIFU是利用超声地位监控的准确性:在声像图上大多数肝癌结节的边界都被清楚显示故能做到正确引导焦点至靶区,高能量多束超声波体外发射,通过水介导像肿瘤靶点处穿透并聚焦,从而发生能量转换使肿瘤靶点部位 (仅为0.5 cm×0.3 cm×0.1 cm)温度瞬间达到 70~100℃,利用超声波具有脂肪不过热,加热深度较大、穿透指向及聚焦性好,也就是利用高温、空化效应等物理作用破坏靶组织或肿瘤组织,焦域所在区域即为损伤区,它所致的损伤是造成靶组织凝固性坏死,组织细胞不可逆性破坏,从而达到治疗目的。
正常肝脏是放射敏感器官,属于放射晚反应组织,其放射敏感性仅次于骨髓、淋巴组织和肾脏,且放疗不受解剖位置限制,特别是肝门受累的病例。肝癌根治性放疗剂量为60 Gy[2],但正常肝脏耐受量所限,文献报道全肝照射30 Gy以上发生放射性肝炎和肝纤维化的危险性就急剧上升[3],常规外照射治疗不能给予肝癌根治剂量,因而疗效较差。本组用 2 Gy的分次量,1次/d,5次/周,总剂量 56~60 Gy。 放疗结束后1周AFP显著下降,异常的肝功能指标显著恢复,但影像学尚无变化,证明肿瘤细胞受到根治性剂量照射后生长代谢紊乱,分裂功能丧失,但组织学未出现变化。组织学改变出现在治疗结束后2~3个月之后。考虑到肝脏具有较高的分割敏感性,晚期损伤可能会加重,且当肿瘤体积较大时,必须考虑到部分乏氧的克隆源性细胞的存在,在较短的治疗时间内其不能很好地氧合,因对放射线抗拒而存活,治疗结束后由G0期进入G1期而可能发生肿瘤组织的加速增殖,所以大分割的远期疗效尚有待继续观察,故采用常规分割替代大分割治疗方法,取得了非常好的疗效。
利用高能聚焦超声联合三维适形放疗同步治疗肝癌可起到互相增敏的作用,大大提高了局部晚期肝癌的局部控制率及总有效率,且不良反应不叠加,值得临床进一步研究。
[1]汤钊猷.现代肿瘤学[M].上海:复旦大学出版社,2009.737.
[2]谷铣之.肿瘤放射治疗学[M].北京:中国协和医科大学出版社,2008.833.
[3]Nagashima T.The study on radiotherapy for hepatocellular carcinoma[J].Nippon Igaku Hoshasen Gakka Zasshi,1980,49(5):1141.
