血清抗GP210抗体对PBC患者的诊断价值
2011-07-13李凤惠吕洪敏向慧玲泽塔多吉周佳美
李凤惠,吕洪敏,向慧玲,王 芳,唐 飞,泽塔多吉,周佳美
(1.天津医科大学三中心临床学院消化内科,天津300170;2.天津市第三中心医院消化内科,天津300170)
原发性胆汁性肝硬化(primary biliary cirrhosis,PBC)是一种由免疫机制介导的肝脏疾病,患者血清中可出现多种自身抗体,其中抗线粒体抗体(AMA),尤其是其M2亚型(AMA-M2)被认为是PBC的标志性抗体。虽然AMA/AMA-M2特异性较高,但临床应用仍有一定局限性,并非所有PBC患者均表现为AMA/AMA-M2阳性。此外该抗体与病程进展无关,不能作为监测病情及评价疗效的指标。据报道50%PBC患者血清中可以检测到抗核抗体 (ANA)[1],而抗GP210抗体作为ANA的一个亚型,是PBC高度特异性的抗体,其特异性高达99%[2],当AMA/AMA-M2阴性时,抗GP210抗体可作为辅助诊断的重要指标。多数学者认为抗GP210抗体阳性PBC患者预后较差,易进展为肝衰竭[3-6],但亦有研究报道抗GP210抗体并非影响PBC患者预后的主要因素[7]。本文回顾性分析了142例PBC患者的临床资料,旨在进一步探讨抗GP210抗体与PBC患者病情及预后的关系。
1 资料和方法
1.1 对象 收集2006年9月~2010年9月在天津市第三中心医院住院治疗的PBC患者142例,年龄32~82岁,中位年龄62岁,男女比例为33∶109。所有患者均符合2000年美国肝病学会(AASLD)推荐的PBC诊断指南[8]。142例患者中有135例入院时已进展至肝硬变阶段(均依据病史、临床症状、实验室及影像学检查而诊断为肝硬化)。
1.2 方法
1.2.1 分组方法 根据血清抗GP210抗体阳性与否对142例PBC患者进行分组:阳性组32例,其中男性5例,女性27例,中位年龄58岁,均已进展至肝硬变阶段;将其余110例抗GP210抗体阴性患者按入院顺序进行编号(000,001,002……109),应用随机数字表随机抽取32例作为阴性组,男性8例,女性24例,中位年龄62岁,其中30例患者入院时进展至肝硬变阶段。两组患者年龄、性别比例及是否进展至肝硬变阶段等方面的差异无统计学意义(P>0.05),两组患者具有可比性。
1.2.2 检测指标及方法 采用Olympus荧光显微镜以间接免疫荧光法检测患者血清ANA、AMA、AMA-M2,免疫印迹法检测抗GP210抗体(试剂盒购自德国欧蒙医学实验诊断公司),免疫比浊法测免疫球蛋白IgG、IgM;同时采用全自动生化分析仪(TOSHIBA 120 Japan)、全自动血凝分析仪(STA-R France)分别对患者血清中的丙氨酸转氨酶(ALT)、碱性磷酸酶(ALP)、谷氨酰转肽酶(GGT)、总胆红素(TBIL)、直接胆红素(DBIL)、胆碱酯酶(CHE)、总胆汁酸(TBA)、白蛋白(ALB)、前白蛋白(PALB)、总胆固醇(CHO)、甘油三酯(TG)、凝血酶原时间(PT)、凝血酶原活动度(PTA)等指标进行测定;并根据患者入院时的情况,计算Mayo危险性评分[9][Mayo危险评分=0.04年龄+0.87loge胆红素-2.53loge白蛋白+2.38loge凝血酶原时间+0.86水肿积分(0,0.5或1分)。水肿评分标准:0分:无水肿,未使用利尿药;0.5分:轻度水肿,用利尿药后可消退;1分:水肿难控制,用利尿药后不能消退]。慢性肝衰竭诊断要点:(1)有腹水或其他门静脉高压表现;(2)可有肝性脑病;(3)血清总胆红素升高,白蛋白明显降低;(4)有凝血功能障碍,PTA≤40%。
1.3 统计学处理 服从正态分布的计量资料以均数±标准差(±s)表示,组间比较采用 t检验;偏态分布的计量资料以中位数 [四分位数点][M(IQR)]表示,组间比较采用Mann-whitney U检验;计数资料以例数(百分比)[n(%)]表示,率的比较采用四格表资料的Fisher确切概率法;组间生存曲线的比较采用log-rank检验。统计分析采用SPSS13.0软件完成,P<0.05为差异有统计学意义。
2 结果
2.1 两组患者相关临床资料及Mayo危险性评分比较 抗GP210抗体阳性组患者肝衰竭发生率(25%)较阴性组发生率(3.1%)高,两组比较差异具有统计学意义(P<0.05),而其他常见症状体征、并发症及伴随疾病的发生率差异无统计学意义(P>0.05)。抗GP210抗体阳性组及阴性组入院时Mayo危险性评分分别为(8.23±1.3)分、(7.12±1.8)分,两组间差异具有统计学意义(P=0.013)。
2.2 抗GP210抗体阳性组及阴性组患者相关实验室指标比较
2.2.1 两组患者主要生化指标的比较 阳性组血清ALT、TBIL、DBIL水平较阴性组高,而CHE水平较阴性组低,两组间差异具有统计学意义(P<0.05)。与阴性组比较,阳性组血清ALP、GGT及TBA水平有增高趋势,PTA及PALB有降低趋势,但两组间差异无统计学意义(P>0.05),见表1。
表1 两组患者主要生化指标比较(±s)

表1 两组患者主要生化指标比较(±s)
两组间比较*P<0.05,n=32
阴性组82.6±4.230.5±1.448.8±7.751.0±8.2247.2±28.9182.0±28.154.6±13.333.1±9.570.5±11.93321.6±272.39.0±1.34.0±0.41.7±0.3阳性组72.5±4.729.6±1.774.8±10.166.0±8.5261.6±27.9199.3±25.7123.2±24.282.7±16.099.8±20.02602.2±224.47.4±0.94.1±0.41.3±0.2 P 0.1160.6680.0450.2070.7210.6520.0160.0100.2110.0460.2940.8370.304项目PTA(%)ALB(g/L)ALT*(U/L)AST(U/L)ALP(U/L)GGT(U/L)TBIL*(μmol/L)DBIL*(μmol/L)TBA(μmol/L)CHE*(U/L)PALB(mg/dL)CHO(mmol/L)TG(mmol/L)
2.2.2 两组患者主要免疫学指标的比较 与阴性组相比,阳性患者血清中ANA、AMA、AMA-M2阳性率及IgM、IgG浓度均与抗GP210抗体无显著相关(P>0.05),见表 2。

表2 两组患者主要免疫学指标比较[n(%)]
2.3 随访
2.3.1 抗GP210抗体阳性组与阴性组随访情况比较 随访时间为3~48个月,中位时间18个月。阳性组死亡12例,阴性组死亡4例,阳性组死亡率37.5%,高于阴性组的12.5%,两组间差异具有统计学意义(P=0.041),两组患者主要死亡原因分布见图1。抗GP210抗体阳性组患者主要死亡原因为肝衰竭、肝癌;抗GP210抗体阴性组主要死亡原因为消化道出血。抗GP210抗体阳性组与阴性组平均生存时间分别为(33.9±3.1)月、(42.6±2.2)月,两组患者生存率间差异具有统计学意义,P=0.029,见图2。抗GP210抗体阴性组生存时间长于抗GP210抗体阳性组。
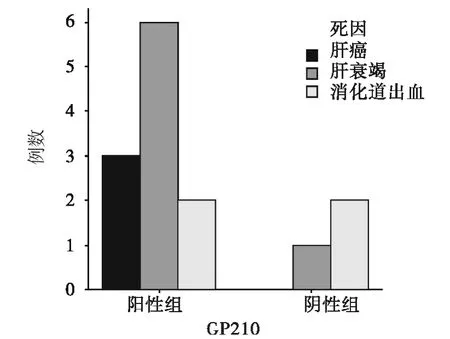
图1 抗GP210抗体阳性组与阴性组患者主要死亡原因分布

图2 抗GP210抗体阳性组与阴性组生存曲线比较
2.3.2 抗GP210抗体阳性组随访情况分析 阳性组32名患者中21名患者于出院后6~12月内进行了自身抗体的再次检测,根据检测结果分组:持续阳性组(两次进行自身抗体检测均表现为抗GP210抗体阳性)13例;转换组(再次进行自身抗体检测时抗GP210抗体由阳性转为阴性)8例。将8名PBC患者发生转换前后的临床及生化资料进行比较,结果显示:患者的一般状况(如乏力、瘙痒、黄疸等)及上消化道出血、肝肾综合征、肝性脑病等并发症的发生率均无显著差异(P>0.05),转换前后主要生化指标的比较见表3。对21名患者进行为期3~36个月的随访(中位时间12个月),随访期间,持续阳性组与转换组肝衰竭发生率分别为30.8%(4/13)、0(0),P=0.131。
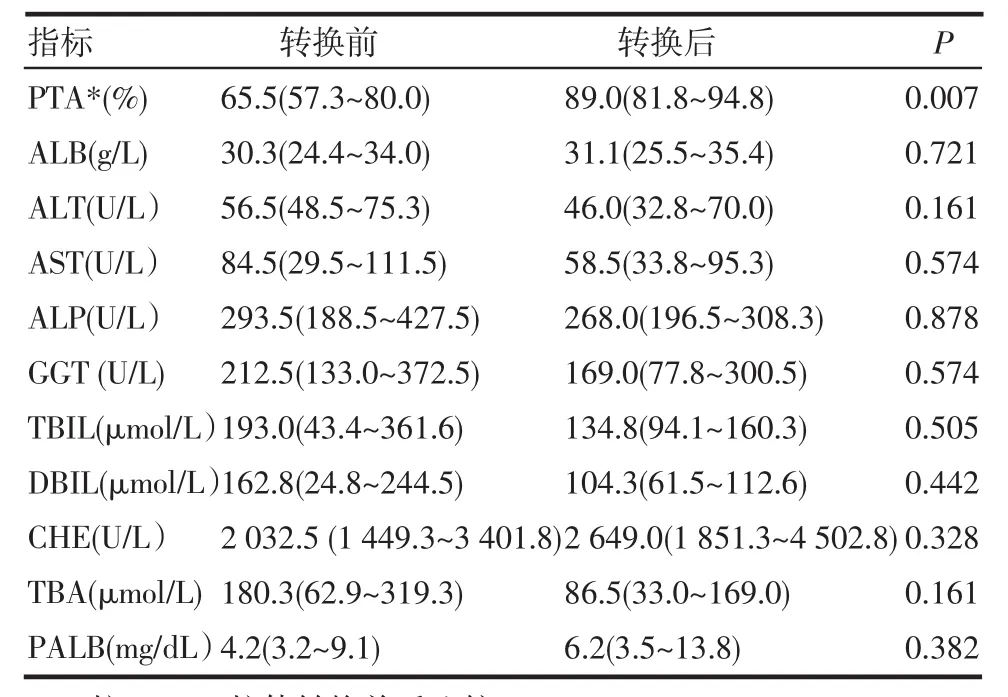
表3 8例PBC患者抗GP210抗体转换前后主要生化指标比较[M(IQR)]
3 讨论
PBC是一种以肝内中小胆管慢性进行性损伤为特征的自身免疫性疾病,病程反复,最终进展为肝硬变,据报道其发病率有逐年上升的趋势[5]。该病发病机制不明,缺乏有效治疗措施。熊去氧胆酸是唯一公认的对该病有特定疗效的药物,然而病程晚期应用该药治疗效果欠佳且不能逆转肝脏纤维化。肝移植虽然可延长终末期PBC患者的生存时间,但由于昂贵的费用限制了其在临床中的应用。因此早期诊断、及时治疗、延缓病程进展是改善PBC患者预后的关键。
抗GP210抗体针对的靶抗原是核孔复合物中分子质量为210 ku的糖蛋白[10],该抗原特异性地位于核孔区,应用免疫荧光法进行检测,发现其在核孔处呈环状核膜型荧光反应[11]。1990年,Courvalin等[10]首先报道了PBC患者血清中呈环型的抗核抗体即为抗GP210抗体。近年研究结果显示抗GP210抗体是PBC高度特异性抗体,其特异性高达99%[2],敏感性达10%~41%[1,4,11],且极少出现于其他自身免疫性疾病如自身免疫性肝炎、类风湿性关节炎、干燥综合征、多发性肌炎、系统性硬化症中[12-14]。本组资料中抗GP210抗体阳性率22.5%(32/142),其中16例出现在AMA和/或AMA-M2阴性患者中,可见对于临床表现不典型或AMA阴性的患者,血清抗GP210抗体的检测有助于PBC的早期诊断。
本研究中抗GP210抗体阳性组血清ALT、TBIL、DBIL水平较高,而CHE水平较低,这与Muratori等[12]的研究结果相似。在随访中发现:抗GP210抗体与PTA有一定的相关性,当抗GP210抗体阳性时PTA降低。考虑与以下因素有关:(1)抗GP210抗体阳性时肝脏病理损害程度较重:Nakamura等[3-4]的研究结果显示PBC患者胆管上皮细胞核被膜上有GP210抗原的显著表达,其表达程度与肝汇管区炎症、肝界面炎症及肝小叶炎症呈正相关,长期持续针对该抗原的反应可能加重PBC患者肝脏的损伤,并最终进展为肝衰竭。(2)抗GP210抗体阳性PBC患者对治疗的反应较差[7]。(3)阳性组患者入院时病情偏重。因此抗GP210抗体的出现是否意味着肝脏病理损害程度的加重,是否意味着病情的加重还有待进一步验证。
目前用于评价PBC预后的模型中以Mayo模型应用最为普遍,该模型能准确地预测高风险组PBC患者7年内的生存率,其分数与预后呈负相关。本组资料中抗GP210抗体阳性组Mayo评分高于阴性组,提示抗GP210抗体阳性患者预后较差。值得注意的是,Mayo评分模型主要用于预测PBC群体的生存率,而对个体预后的价值有限[15];此外模型中如ALB、PT、水肿等指标易受肝外因素的影响,从而限制了其在临床中的广泛应用。目前多数学者认为抗GP210抗体阳性患者预后较差,且易进展为肝衰竭[3-6],本研究也显示抗GP210抗体阳性组肝衰竭发生率高,在随访期间死于肝脏相关疾病的概率也较高,经Log-Rank检验也显示抗GP210抗体阳性组患者生存时间较阴性组短,因此抗GP210抗体可能为影响PBC患者预后的重要指标。然而Corpechot等[7]在对PBC患者预后进行多因素分析时,抗GP210抗体却未被保留。因此为进一步研究抗GP210抗体对PBC的影响及意义,笔者将阳性组分为持续阳性组及转换组,在随访期间持续阳性组肝衰竭发生率与转换组相比,差异虽无统计学意义,但仍有增高的趋势。由此推测:抗GP210抗体对PBC预后影响的大小可能与其持续时间长短有关,在PBC进程中尤其是疾病晚期,抗GP210抗体长期持续阳性提示预后不良。
综上所述,测定血清抗GP210抗体水平,不仅可以辅助AMA/AMA-M2阴性或临床症状不典型的PBC患者的早期诊断,亦有可能作为反映肝脏损害程度的指标之一,有助于病情的判断;此外,抗GP210抗体对PBC预后的影响与其持续时间相关,但尚需扩大样本的前瞻性研究进一步验证,这对今后在PBC诊断、治疗、预后判断等方面都将具有重要的指导意义。
[1]Worman HJ.Nuclear envelope protein autoantigens in primary biliary cirrhosis[J].Hepatol Res,2007,37(3):406
[2]Bauer A,Habior A.Measurement of gp210 autoantibodies in sera of patients with primary biliary cirrhosis[J].J Clin Lab Anal,2007,21(4):227
[3]Nakamura M,Takii Y,Ito M,et al.Increased expression of nuclear envelope gp210 antigen in small bile ducts in primary biliary cirrhosis[J].J Autoimmun,2006,26(2):138
[4]Nakamura M,Kondo H,Mori T,et al.Anti-gp210 and anti-centromere antibodies are different risk factors for the progression of primary biliary cirrhosis[J].Hepatology,2007,45(1):118
[5]Rautiainen H,Salomaa V,Niemel覽S,et al.Prevalence and incidence of primary biliary cirrhosis are increasing in Finland[J].Scand J Gastroenterol,2007,42(11):1347
[6]Czaja AJ.Autoantibodies as prognostic markers in autoimmune liver disease[J].Dig Dis Sci,2010,55(8):2144
[7]Corpechot C,Abenavoli L,Rabahi N,et al.Biochemical response to ursodeoxycholic acid and long-term prognosis in primary biliary cirrhosis[J].Hepatology,2008,48(3):871
[8]Heathcote EJ.Management of primary biliary cirrhosis.The American Association for the study of liver diseases practice guidelines[J].Hepatology,2000,31(4):1005
[9]Dickson ER,Grambsch PM,Fleming TR,et al.Prognosis in primary biliary cirrhosis:model for decision making[J].Hepatology,1989,10(1):1
[10]Courvalin JC,Lassoued K,Bartnik E,et al.The 210-Kd nuclear envelope polypeptide recognized by human autoantibodies in primary biliary cirrhosis is the major glycoprotein of the nuclear pore[J].J Clin Invest,1990,86(1):279
[11]Miyachi K,Miyakawa H,Oda M,et al.Primary biliary cirrhosis and autoantibodies[J].Nihon Rinsho Meneki Gakkai Kaishi,2008,31(1):47
[12]Muratori P,Muratori L,Ferrari R,et al.Characterization and clinical impact of antinuclear antibodies in primary biliary cirrhosis[J].Am J Gastroenterol,2003,98(2):431
[13]Milkiewicz P,Buwaneswaran H,Coltescu C,et al.Value of autoantibodyanalysis in the differential diagnosis of chronic cholestatic liver disease[J].Clin Gastroenterol Hepatol,2009,7(12):1355
[14]Assassi S,Fritzler MJ,Arnett FC,et al.Primary biliary cirrhosis(PBC),PBC autoantibodies,and hepatic parameter abnormalities in alargepopulationofsystemicsclerosispatients[J].JRheumatol,2009,36(10):2250
[15]Kim WR,Wiesner RH,Poterucha JJ,et al.Adaption of the Mayo primary biliary cirrhosis natural history model for application in liver transplant candidates[J].Liver Transpl,2000,6(4):489
