ADC值结合常规MRI在肝脏局灶性病变诊断中的价值*
2011-07-11李成东赵林伟董国礼曾南林
李成东,赵林伟,董国礼,曾南林,杨 林
(1.安县人民医院放射科,四川 安县 622650;2.遂宁市中心医院放射科,四川 遂宁 629000;3.川北医学院附属医院放射科,四川 南充 67000)
弥散加权成像是一种通过测量组织内水分子的弥散来提供组织对比的影像技术,在肝脏MRI中的应用日趋广泛。ADC值与水分子的运动有关,反映了组织的性质如细胞外间隙的大小、粘滞度和细胞密度等。因此,测量ADC值有助于描述肝脏局灶病变的特征和评价肝脏弥漫性疾病[1-4],并且也有评估肿瘤治疗应答的潜力[5]。由于良恶性病变的ADC值间有一定的重叠,DWI常需与常规MRI联合应用以提高诊断水平。本文回顾分析49例经组织病理证实的肝局灶性病变的常规MRI和DWI资料,分析其ADC值、常规MRI以及ADC值结合常规MRI诊断肝脏恶性局灶性病变的灵敏度、特异度和准确性,旨在进一步探讨ADC值结合常规MRI在良恶性肝局灶病变诊断中的价值。
1 资料与方法
1.1 研究对象
收集川北医学院附属医院2010年1月-2011年5月间,49例肝脏局灶性病变患者的常规MRI与DWI资料,男25例,女24例,年龄(22-69)岁,平均(48.71±12.57)岁。肝脏恶性肿瘤28例,男17例,女 11例,年龄(22-67)岁,平均(48.75±13.74)岁;其中肝细胞癌13例,胆管细胞癌8例,混合型肝癌2例,单发转移瘤5例。肝脏良性病变21例,男8例,女13例,年龄(27-69)岁,平均(48.65±11.08)岁;其中肝囊肿4例,肝血管瘤8例,肝脓肿7例,局灶性结节增生1例,炎性假瘤1例。所有病例均经CT导向穿刺活检或手术后经组织病理学证实。
1.2 检查前准备
检查前一天晚以流质饮食为主,检查前禁食(4-6)小时,禁饮(1-2)小时。训练病人呼吸,平静呼吸及屏气动度尽量保持一致,告知病人最长屏气时间,力求配合。上检查床后由MRI检查医师再对患者进行屏气训练1-2次。
1.3 扫描方法
MRI扫描采用GE Signa EXCITE 1.5T MR成像系统。线圈采用8通道腹部相控阵线圈。
MRI常规扫描序列包括轴位FRFSE T2WI:TR/TE12000/94.4ms,5.0thk/0.5sp,ET=16,FOV=(34.0×34.0)cm,矩阵256×192;轴位 Dyn fs BH T1WI:TR/TE 195.0/1.5ms,FOV=(36.0 × 36.0)cm,7.0thk/2.0sp;冠状位 SSFSE T2WI:TR/TE 2000/197.6ms,5.0thk/0.0sp,ET=0,FOV=(38.0 ×38.0)cm,矩阵256×192;SSFSE thick:TR/TE6000/1379.8ms,57.0thk/0.0sp,ET=0,FOV=(30.0 ×30.0)cm,矩阵 384×224;AX Dual echo High Res ASSET:TR125.0ms,TE2.2/4.4ms,反转角 75°,带宽20.83Hz,7.0thk/3.0sp,ET=0,FOV=(38.0 ×38.0)cm,矩阵256×192。
DWI扫描采用 SS-EPI-DWI:TR/TE=4000/55.8ms,FOV=(42.0×42.0)cm,矩阵256 ×192,采集频带宽250Hz/像数,1次信号平均,层厚=(5-7)mm,间隔=0.5mm,在X、Y、Z三个方向施加弥散梯度,b值为0和500s/mm2,1次采集,上述序列全部采用屏气扫描。
LAVA序列动态增强扫描参数:TR/TE为3.8/1.8ms,FOV=(38.0×38.0)cm,矩阵为 256 ×224,扫描层厚为4.0mm,零穿插处理(Zerofill Interpolation Processing,ZIP)× 2,FA13°。对比剂为马根维显(广州先灵),剂量0.2 mmol/kg,20ml。使用美国Medrad公司磁共振专用双管高压注射器(spectris MRI injection system)经前臂静脉注射,速度3.5ml/s,一般在(5-7)秒注射完毕,20ml生理盐水灌洗,每一时相采集时间(13-18)秒。
1.4 图像分析
由两位有经验的放射学医师在不知道临床数据及分组的情况下对所有常规MRI图像进行盲法分析,包括病灶的大小、形态、信号特点、内部结构等。不一致的地方经共同协商达成一致。
ADC值测量将DWI数据传入GE AW4.1工作站,自动生成ADC图。由两位有经验的放射学医师共同测量ADC值。ROI设置方法:以T2WI或增强扫描图像为指导,以整个病变区域作为ROI,避开肉眼可见的血管、胆管以及实质性病变的坏死区域;同时测量所有可测层面,然后取其均值作为该病灶的ADC值。
1.5 数据分析
将所有恶性肿瘤分为一组,作为病例组(恶性组);其它良性病变随机分为一组作为对照组(非恶性组),观察者间的一致性采用Kappa检验。统计良恶性病变及邻近正常肝实质的ADC值,使用方差分析(ANOVA法)比较良恶性病灶及邻近正常肝实质ADC间的差异;利用SPSS软件,行带协变量的ROC分析,评价ADC值、常规MRI、ADC值结合常规MRI诊断肝脏恶性病变的灵敏度、特异度和准确性。统计软件采用SPSS17.0,p<0.05有统计学意义。
2 结果
2.1 肝脏良恶性病灶及邻近正常肝实质的ADC值
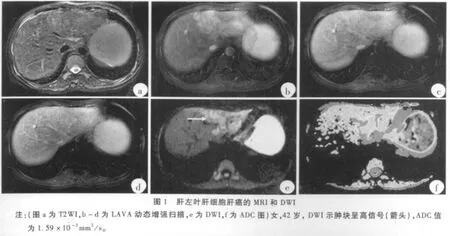
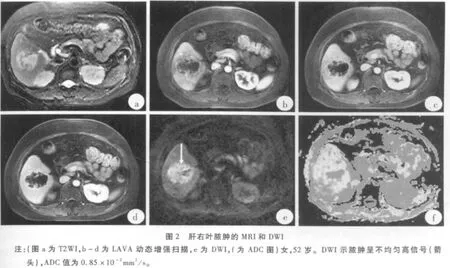
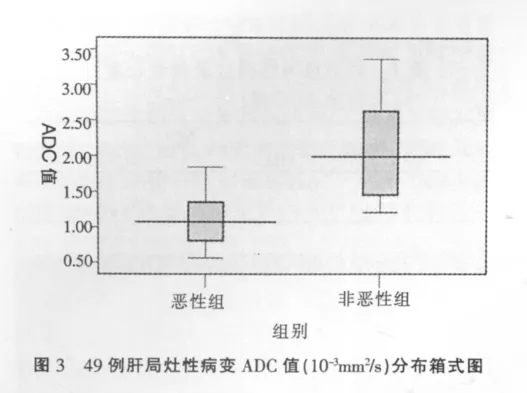
见表1,恶性组病灶与非恶性组病灶ADC值差异具有统计学意义(p<0.05),但部分病例ADC值存在重叠(图1-3)。恶性病灶与正常肝实质ADC值差异没有统计学意义(p>0.05),良性病灶与正常肝实质ADC值差异具有统计学意义(p<0.05)。
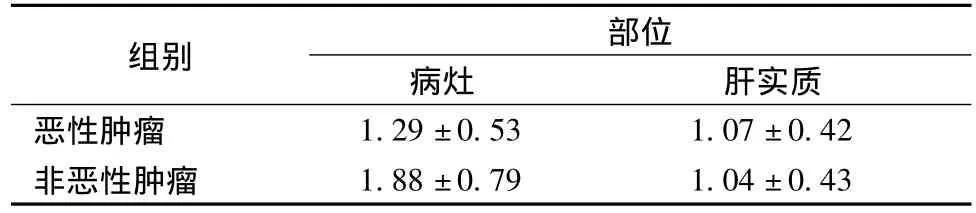
表1 肝脏良恶性病灶及邻近正常肝实质的ADC值(10-3mm2/s)
2.2 ADC值与常规MRI诊断肝脏恶性肿瘤灵敏度、特异度和准确率比较
常规MRI诊断肝脏恶性肿瘤的灵敏度、特异度和准确率分别为96.4%、80.0%和89.8%,观察者间一致性为0.86(Kappa指数)。ADC值诊断肝脏恶性肿瘤的灵敏度、特异度和准确率分别为82.1%、90.0%和83.7%。ADC值结合常规MRI诊断肝脏恶性肿瘤的灵敏度、特异度和准确性分别为92.9%、95.0%和93.9%(表2)。ADC值结合常规MRI时,ROC曲线下面积(area under the ROC curve,AUC)最大(图4),差异具有统计学意义。
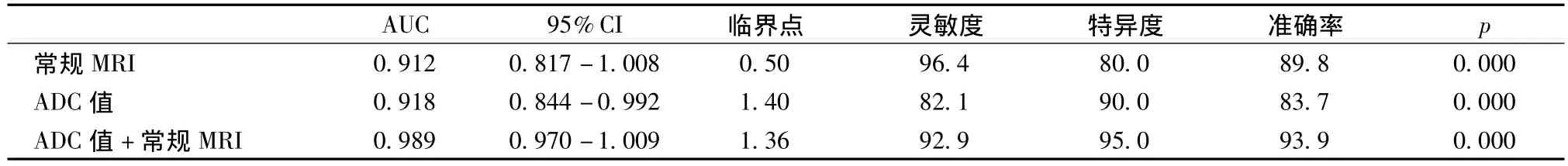
表2 ADC值、常规MRI、ADC值结合常规MRI诊断肝脏恶性肿瘤的ROC曲线比较
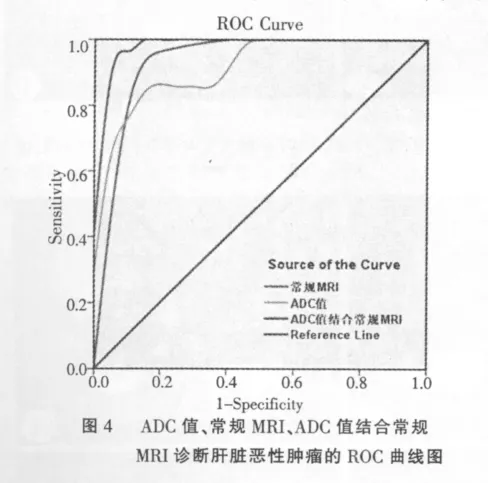
3 讨论
3.1 常规MRI在肝脏病变诊断中的价值
MRI平扫和动态增强序列在鉴别肝脏病灶的类型中很有价值。MRI软组织分辨率高,T1WI能够较好的显示病变形态及其毗邻关系;可以通过肉眼观察肝脏各种病变的信号特征或计算T1/T2值来区分良恶性。但对具体病例来说,T1与T2值的计算不够精确和方便,很难在临床诊断中常规使用;恶性病变与良性病变表现多有重叠,难以鉴别。随着MRI研究的深入和多种MRI对比剂的临床应用,动态增强检查成为MRI平扫的重要补充。在实性局灶性病变的快速多期动态增强扫描中,通过观察病变在动脉期、门静脉期与延迟期对比剂增强的演变,大部分可确定性质。但由于同一类的肿瘤血供状况不同或在其发展过程中血供形式发生变化,而出现各期强化形式的差异;即使采用肝脏特异性对比剂增强MRI,在诊断小肝癌以及与其它非恶性结节的鉴别中仍然存在一些问题。有时候富血供转移瘤与血管瘤,肝脓肿与其它肝脏恶性肿瘤等也仍然难以鉴别。
3.2 ADC值在肝脏局灶性病变中的应用
近年关于肝脏病变ADC值定量测定的研究有所增加,但是报道的ADC值有很大的差异:肝细胞癌ADC值为(0.90-3.84)×10-3mm2/s,胆管细胞癌ADC值为(0.95-1.33)×10-3mm2/s,肝转移瘤ADC值为(0.79-2.55)×10-3mm2/s,海绵状血管瘤ADC值为(1.84-5.39)×10-3mm2/s,肝囊肿ADC值为(2.61-3.18)×10-3mm2/s,肝脓肿 ADC值为(0.67 - 1.83)× 10-3mm2/s[6-10]。这些报道ADC值的差异通常与成像的b值及其它的技术参数有关:因为灌注对弥散测量的影响,低b值导致ADC值估计过高;高b值因为信噪比等而低估了ADC值。扫描时抑制呼吸运动伪影技术和导航回波技术也会产生不同的ADC值。大多数恶性肿瘤ADC值降低,被认为是细胞膜阻碍水分子运动的结果。然而,实性良性病灶具有较高的细胞密度时,也表现为ADC值降低。脓肿也可出现类似的现象,是因为带细菌的纤维胶、炎症细胞、粘液蛋白和细胞碎片导致弥散受限。另一方面,坏死和囊性恶性肿瘤因为失去细胞膜的完整性后,弥散距离增加而表现为高ADC值。良性病灶如单纯囊肿和血管瘤表现为高ADC值是因为它们的液体成分和巨大的细胞外间隙。
DWI作为显示肝脏病灶特征的一种方法,几项研究已经表明测量ADC值在显示肝脏局灶性病变的特征方面是有价值的[11-15]。Bruegel等[15]研究了102例肝脏局灶性病变的ADC值,发现以1.63×10-3mm2/s作为阈值,88%的病灶被准确的区分为良性或恶性。对病灶的定性,采用呼吸触发DW-SSEPI序列,测量肝脏局灶性病变的ADC值可能是一个有用的补充。我们的结果也表明:ADC值对于诊断肝脏恶性局灶性病变,是一种较好的方法,灵敏度、特异度和准确性分别为 82.1%、90.0%和83.7%,但良恶性病灶ADC值间存在重叠。Kumaresan等[4]研究了103例肝脏局灶性肿块的DWI后发现,实体良性病灶(除外囊肿和血管瘤)和恶性肿瘤的ADC值差异没有统计学意义,由于ADC值的重叠,ADC值并不能鉴别良性实体肿瘤与恶性病灶,并且DWI序列对运动伪影非常敏感,这使得病灶变得模糊和图像难于解释,特别是肝左叶病变。
单独的DWI并不适合显示肝脏病灶的特征,联合应用DWI和MRI增加了显示良恶性病灶特征的准确性[4,11,16,17]。近年来 DWI 与增强 MRI 的联合应用已成为影像研究的一个方向。Koh等[18]比较了MnDPDP增强扫描、DWI以及二者联合时诊断结直肠癌肝转移瘤的准确性,他们发现在两位观察者中,单独MnDPDP和DWI诊断准确性(ROC曲线下面积)分别为(0.88-0.92)和(0.83-0.90),联合MnDPDP增强扫描和 DWI时,诊断准确性最高(0.94-0.96),而主要是灵敏度增加,但特异度降低。Nasu等[2]评价了DWI结合MRI平扫与超顺磁性氧化铁(SPIO)增强扫描诊断肝转移瘤的准确性。在ROC分析的基础上,他们发现SPIO增强的灵敏度和特异度分别为66%和90%,DWI的灵敏度和特异度分别为82%和94%。我们的结果也表明,ADC值结合常规MRI诊断肝脏恶性局灶性病变的准确性较常规MRI增加,ROC曲线下面积差异具有统计学意义。尽管目前提倡DWI扫描及测量的标准化,以消除不同扫描参数导致的ADC值偏差[19],甚至制定正常脏器的ADC值参考值。由于现存各种DWI序列及后处理程序的多样性,以及DWI技术自身的不断创新和发展,开展此项工作有较大难度。在统一标准之前,每个研究者应当首先进行本单位各系统病变的ADC值测量研究,确定良恶性病变的ADC阈值,以作为常规MRI的补充。
[1]Taouli B,Vilgrain V,Dumont E,et al.Evaluation of liver diffusion isotropy and characterization of focal hepatic lesions with two single-shot echo-planar MR imaging sequences:prospective study in 66 patients[J].Radiology,2003,226(1):71 – 78
[2]Nasu K,Kuroki Y,Nawano S,et al.Hepatic metastases:diffusion-weighted sensitivity-encoding versus SPIO-enhanced MR imaging[J].Radiology,2006,239(1):122 – 130
[3]Gourtsoyianni S,Papanikolaou N,Yarmenitis S,et al.Respiratory gated diffusion-weighted imaging of the liver:value of apparent diffusion coefficient measurements in the differentiation between most commonly encountered benign and malignant focal liver lesions[J].Eur Radiol,2008,18(3):486 – 492
[4]Sandrasegaran K,Akisik FM,Lin C,et al.The value of diffusion-weighted imaging in characterizing focal liver masses[J].Acad Radiol,2009,16(10):1208 – 1214
[5]Deng J,Miller FH,Rhee TK,et al.Diffusion-weighted MR imaging for determination of hepatocellular carcinoma response to yttrium-90 radioembolization[J].J Vasc Interv Radiol,2006,17(7):1195–1200
[6]Ichikawa T,Haradome H,Hachiya J,et al.Diffusion-weighted MR imaging with a single-shot echoplanar sequence:detection and characterization of focal hepatic lesions[J].AJR,1998,170(2):397–402
[7]Quan XY,Sun XJ,Yu ZJ,et al.Evaluation of diffusion weighted imaging of magnetic resonance in small focal hepaticl lesions:a quantitative study in 56 cases[J].Hepatobiliary Pancreat Dis Int,2005,4(3):406 -409
[8]Kamangar F,Dores GM,Anderson WF.Patterns of eancer incidence,mortality,and prevalence across five continents:defining priorities to reduce cancer disparities in different geographic regions of the world[J].J Clin Oncol,2006,24(14):2137 – 2150
[9]Demir OI,Obuz F,Sagol O,et al.Contribution of diffusionweighted MRI to the differential diagnosis of hepatic masses[J].Diagn Intery Radiol,2007,13(2):81 – 86
[10]Koike N,Cho A,Nasu K,et al.Role of diffusion– weighted magnetic resonance imaging in the differential diagnosis of focal hepatic lesions[J].World J Gastroenterol,2009,15(46):5805–5812
[11]Lichy MP,Aschoff P,Plathow C,et al.Tumor detection by diffusion-weighted MRI and ADC-mapping-initial clinical experiences in comparison to PET-CT[J].Invest Radiol,2007,42(9):605 -613
[12]Coenegrachts K,Delanote J,Ter Beek L,et al.Improved focal liver lesion detection:comparison of single-shot diffusion-weighted echoplanar and single-shot T2 weighted turbo spin echo techniques[J].Br J Radiol,2007,80(955):524 – 531
[13]Low RN,Gurney J.Diffusion-weighted MRI(DWI)in the oncology patient:value of breathhold DWI compared to unenhanced and gadolinium-enhanced MRI[J].J Magn Reson Imaging,2007,25(4):848–858
[14]Coenegrachts K,Matos C,Ter Beek L,et al.Focal liver lesion detection and characterization:comparison of non-contrast enhanced and SPIO-enhanced diffusion-weighted single-shot spin echo echo planar and turbo spin echo T2 – weighted imaging[J].Eur J Radiol,2009,72(3):432 – 439
[15]Bruegel M,Holzapfel K,Gaa J,et al.Characterization of focal liver lesions by ADC measurements using a respiratory triggered diffusion-weighted single-shot echo-planar MR imaging technique[J].Eur Radiol,2008,18(3):477 – 485
[16]Feuerlein S,Pauls S,Juchems MS,et al.Pitfalls in abdominal diffusion-weighted imaging:how predictive is restricted water diffusion for malignancy[J].AJR Am J Roentgenol,2009,193(4):1070–1076
[17]Kele PG,Jagt EJ.Diffusion weighted imaging in the liver[J].World J Gastroenterol,2010,16(13):1567 -1576
[18]Koh DM,Brown G,Riddell AM,et al.Detection of colorectal hepatic metastases using MnDPDP MR imaging and diffusion-weighted imaging(DWI)alone and in combination[J].Eur Radiol,2008,18(5):903 –910
[19]Goshima S,Kanematsu M,Kondo H,et al.Diffusion-weighted imaging of the liver:optimizing b value for the detection and characterization of benign and malignant hepatic lesions[J].J Magn Reson Imaging,2008,28(3):691 – 697
