黄芩苷片对脑梗死患者的临床疗效观察及机制探讨
2011-07-11石兴兵
石兴兵
(广安市人民医院神经内科,四川 广安 638000)
缺血性脑卒中是一种以高发病率、死亡率、致残率为特征的常见病,且呈逐年上升趋势。其中脑梗死发病率约占全部脑卒中的60% -80%[1]。由于脑组织对缺氧的耐受性最差,急性缺血性脑卒中后由于脑部血液循环障碍,造成脑部急性缺氧,脑内乳酸、自由基大量生成,进一步加重脑损害。因此,急性脑卒中后尽快改善脑部血液循环、纠正脑组织缺氧、保护半暗带维持神经细胞存活和促进神经生长是本病治疗的关键[2]。
黄芩苷是唇形科植物黄芩的主要成分之一,为黄酮类化合物。研究表明,黄芩苷在外周多种组织器官(肝脏、免疫系统、心血管系统等),具有抗自由基损伤、抗炎、抗病毒、抗血栓及扩血管等作用[3]。近年来,黄芩苷在中枢神经系统的作用开始受到重视,其抗炎抗氧化特性有利于大脑梗死半暗带神经细胞的恢复。在动物水平,黄芩苷对大脑中动脉栓塞引起的脑梗死损伤有保护作用,能减轻缺血皮质谷氨酸和天门冬氮酸释放增加[4]。因此,基于上述特性,我们认为黄芩苷片可能为脑梗死的治疗提供新的思路。而国内外尚无相应临床研究报道。因此,本文采用黄芩苷片对51例脑梗塞患者进行治疗,并探讨其可能的保护机制。
1 材料与方法
1.1 临床资料
病例选自2010年2月至2011年5月间在我科住院的男性患者共51例。年龄(51-70)岁,平均(63±6)岁,全部患者均为急性期,首次发病。病程均在24小时内,CT排除脑出血、脑肿瘤以及由于血液病和房颤、心功能不全引起的脑卒中。经筛选除严重肝肾疾病患者外,全部患者均无免疫系统疾病,根据入院的日期随机分为常规治疗组(常规治疗,28例)和干预组(即在常规治疗的基础上早期应用黄芩苷片,23例)。两组患者年龄、性别无显著性差异(p>0.05)。所使用的黄芩苷片购于湖南绅泰春药业有限公司(国药准字H43021781)。用法:口服,一次0.5g,一日3次。两组患者均连续治疗1个月。
1.2 标本采集与测定
所有患者均留取发病后24小时、120小时的静脉血各5ml。离心分离血清,置于-20℃冰箱保存待测。
1.3 临床疗效评判
对两组患者分别于入院时和入院后1月进行临床疗效评定。疗效以减分率评定:基本痊愈≥89%、显效≥46%、好转≥18%、无效≤18%。其中前三种情况认为是有效。研究末期计算出有效率。神经功能缺损的评定采用1995年全国脑血管病学术会议《卒中患者神经功能缺损评分标准》(CSS)。同时评判患者的认知障碍水平(MMSE)和日常生活能力(Barthel指数)。
1.4 炎症及氧化应激指标检测
血清IL-1、TNF-α 测定,采用 ELISA 法。TNF-α试剂为R&D公司产品。丙二醛(MDA)、超氧化物歧化酶(SOD)测试盒均购自南京建成生物工程研究所。具体操作按试剂盒说明书进行。
1.5 统计学方法
2 结果
2.1 黄芩苷片对临床治疗效果的影响
结果表明,干预组总有效率为86.96%(20/23),其中,临床痊愈、显效、好转分别为2例、11例和7例;常规治疗组总有效率为78.57%(22/28)),其中,临床痊愈、显效、好转分别为1例、10例和11例。两组有效率比较未发现统计意义的差别,见表1。

表1 治疗一月后两组疗效评估
2.2 黄芩苷片对神经功能的改善
经过一个月的治疗,患者神经功能缺损水平、日常生活活动能力、认知功能障碍水平均较治疗前显著改善(p<0.05),干预组与常规治疗组比较有显著性差异(p<0.05)。说明黄芩苷片在对神经功能缺失的保护上发挥了重要作用(表2)。
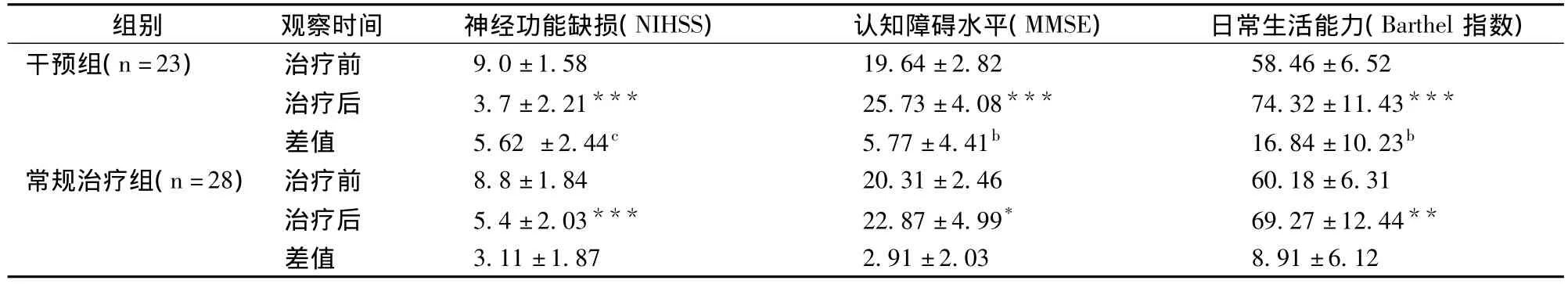
表2 治疗前后神经功能缺损、认知障碍水平,日常生活能力比较
2.3 黄芩苷片降低了炎症因子的表达
我们研究了黄芩苷片对炎症因子表达的影响。从表3可以看出,两组患者治疗初始(即24小时内)血清炎症因子(IL-1、TNF-α)含量无明显差异(p>0.05)。经过5天的药物干预,所有患者的炎症因子均表达下降(p<0.05)。相比常规治疗组,干预组血清IL-1的下降无显著差异性(p>0.05),但血清TNF-α水平却显示出更强的下降趋势(p<0.001)(表3)。
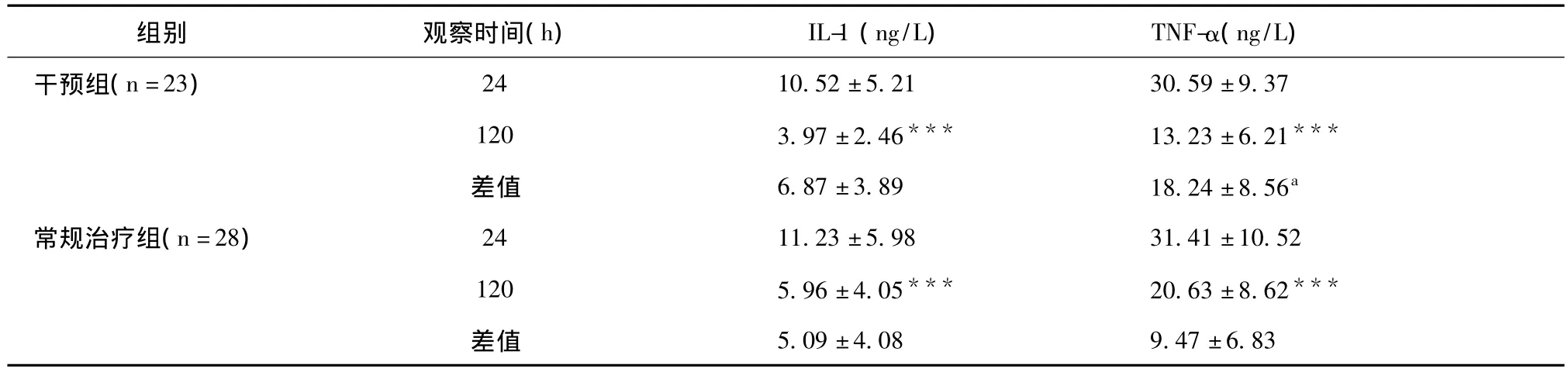
表3 治疗前后两组患者血清中炎症因子的改变
2.4 黄芩苷片降低了血清中氧化应激水平
两组患者治疗初始(即24小时内),MDA含量与SOD活性无明显差异(p>0.05)。实施不同治疗措施5天后,两组MDA含量均有明显下降而SOD活性明显上升,与治疗初始比较,差异有显著性(p<0.05)。而两组间比较,发现干预组患者血清中氧化应激水平更低(p<0.001)(表4)。
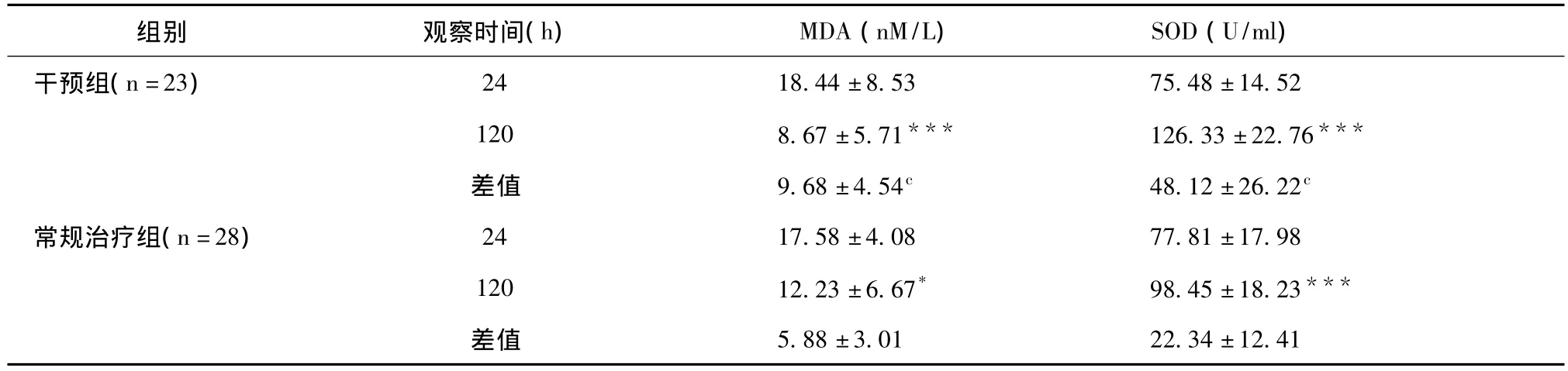
表4 治疗前后两组患者血清中MDA含量及SOD活性的改变
3 讨论
脑血管病是危害人类生命与健康的常见病和多发病,具有发病率高、致残率高、死亡率高和复发率高的特点,是中老年人致死和致残的主要疾病。由于老年人口的不断增加和生活水平的提高,脑血管病的发病率仍在不断上升。2009年卫生部统计,中国内地用于治疗脑血管病的总费用约达二百亿元人民币,其中缺血性脑卒中的直接住院费用为一百零八亿元;脑卒中的死亡率是心肌梗死的(4-6)倍,带来的经济负担是心肌梗死的十倍[5]。脑梗死是脑血管病中的常见类型,其损伤机制复杂,除了自由基损伤、钙离子超载外,近年来免疫炎症反应以及氧化应激在缺血性脑损伤中的作用已得到公众的肯定[6]。
炎性细胞因子包括肿瘤坏死因子和白细胞介素等作为炎症反应的重要递质,共同参与机体免疫反应、应激反应和炎症的调节。有文献报道,发现IL-1于发病第1天即达高峰,随时间推移逐渐下降,在第7天时仍高于正常水平。脑梗死后的星形胶质细胞可迅速表达IL-1,卒中患者的血清 IL-1在较长时间内保持高水平,具体机制目前尚不清楚。因此,在我们的研究中,两组患者于治疗后5天IL-1的下降水平差异不明显。
TNF-α是免疫调节系统中的重要组成部分,是参与炎症反应的主要介质之一,与内皮的损伤有关。急性脑梗塞发病后血清TNF的变化与IL-1变化类似。TNF-α还可刺激内皮细胞释放 IL-1,二者协同作用,能提高内皮细胞原凝血物活性,而抑制纤溶酶原激活物释放,使纤溶活性低下,血液呈高凝状态,导致血栓形成[7,8]。
氧化应激在缺血性脑损伤中也起到推波助澜的作用。脑梗死时,脑血流的阻断导致重要的营养物质和含氧量急速减少,ATP减少,Ca2+进入细胞,使线粒体功能受损,并激活Ca2+依赖性蛋白水解酶,将黄嘌呤脱氢酶水解为黄嘌呤氧化酶[9]。同时脑微血管系统中存在的谷胱甘肽-谷胱甘肽还原酶自由基清除系统功能下降,超氧化物歧化酶(SOD)活性降低,对自由基的清除能力减弱。过量的自由基能够氧化细胞膜和基底膜上的不饱和脂肪酸,引发脂质过氧化,膜的液态性、流动性改变,损伤血管内皮细胞和基底膜;并使胶原纤维的胶原蛋白交联,透明质酸降解,引起细胞外基质疏松,弹性下降,共同作用破坏了血脑屏障的完整性。向脑内注射或脑表面灌注自由基生成剂都可以增加血脑屏障的通透性;而自由基清除剂,如SOD与一些合成的自由基清除剂等都能减轻脑梗死再灌注后血脑屏障的损害。
黄芩苷是唇形科植物黄芩的有效成分之一,属葡萄糖醛酸苷类,水解后产生黄芩素和葡萄糖醛酸,具有清热解毒、抗炎、利胆、降压、利尿、抗变态反应等多方面的作用。近年来随着国际上对黄芩苷研究的持续升温以及认识的逐步深入,认为黄芩苷在清除氧自由基、减轻组织的缺血再灌注损伤、调节免疫、抗凋亡等多方面均有作用[3]。
综合上述研究,我们可以推断出黄芩苷确实可以通过下调炎症因子表达、降低氧化应激、对抗凋亡等多种途径改善脑梗死。尽管有很多动物实验支持这一假设,但是直至今日国内外尚无相应的临床研究。我们大胆的设计了此试验,并取得了良好的临床效果。在我们的研究中,每日给予黄芩苷片1.5克很好的改善了患者的临床预后。在神经功能的恢复、认知功能的改善、生活自理能力的提高上均显现出了较好的效果。在服用药物5天后即显著下调炎症因子的表达,同时也明显的降低了氧化应激。从实验结果,我们可以推断黄芩苷在给药后的第5天就已经发挥其抗炎抗氧化作用,提示早期使用黄芩苷片对脑梗死患者具有重要的治疗意义。
[1]Whisnant JP,Wiebers DO,O'Fallon WM,et al.A populationbased model of risk factors for ischemic stroke:Rochester,Minnesota[J].Neurology ,1996,47(6):1420 -1428
[2]Weinberger J.Diagnosis and prevention of atherosclerotic cerebral infarction[J].CNS Spectr.,2005,10(7):553 -564
[3]Srinivas NR.Baicalin,an emerging multi-therapeutic agent:pharmacodynamics,pharmacokinetics,and considerations from drug development perspectives[J].Xenobiotica,2010,40(5):357 -367
[4]Tu XK,Yang WZ,Shi SS,et al.Neuroprotective effect of baicalin in a rat model of permanent focal cerebral ischemia[J].Neurochem Res,2009,34(9):1626 -1634
[5]曾利明.中国每年治疗脑血管病费用达二百亿元[Z].中国新闻网,2009-06-21
[6]Wang Q,Tang XN,Yenari MA.The inflammatory response in stroke[J].J Neuroimmunol,2007,184(1 -2):53 -68
[7]Buttint M,Apdel K,Sauter A,et al.Expression of tumor necrosis factors alpha after focal cerebral ischemia in the rat[J].Neuroscience,1996,71(1):1-16
[8]Aito H,Aalto KT,Raivio KO.Biphasic ATP depletion caused by transient oxidative exposure is associated with apoptotic cell death in rat embryonal cortical llcurons[J].Pediatr Res,2002,52(1):40-45
[9]Sen CK,Packer L.Antioxidant and redox regulation of gene transcription[J].FASEB J,1996,10(7):709 - 720
