咪达唑仑对子宫平滑肌细胞钙离子移动的影响△
2011-07-06南方医科大学附属深圳妇幼保健院麻醉科深圳518028
南方医科大学附属深圳妇幼保健院麻醉科(深圳 518028)
黄穗萍 黄晓雷 李元涛▲ 曹 君 孟 馨 苏娇玲 胡 薇
研究表明[1]咪达唑仑可浓度依赖性地抑制孕和未孕大鼠子宫平滑肌收缩,但其抑制子宫收缩的作用机制仍不清楚。子宫平滑肌细胞内游离 Ca2+是肌肉兴奋-收缩偶联的活化剂,与肌动蛋白、肌浆蛋白的结合引起子宫收缩[2,3]。而咪达唑仑抑制子宫平滑肌收缩是否与影响子宫平滑肌细胞内外游离 Ca2+移动有关呢?因此本研究拟采用 Fluo-3AM钙荧光指示剂测钙技术,观察不同浓度的咪达唑仑对足月产妇子宫平滑肌细胞内外 Ca2+跨膜内流和肌浆网 Ca2+释放功能的影响,探讨其对子宫收缩影响的可能机制。
材料与方法
1 实验材料 经医院伦理委员会批准,取孕足月健康产妇子宫平滑肌组织,约 0.5cm×0.5cm×1.5cm大小;实验用 DMEM购于杭州吉诺生物医药技术有限公司;胎牛血清购于上海肯强贸易有限公司;氯化钾购于湖北清大康迪药业有限公司生产;0.2%Ⅱ型胶原酶、0.2%胰蛋白酶及咖啡因购于美国 Sigma公司;酯化形式的Fluo-3AM购于美国Molecular Prob公司;细胞观察显微镜采用日本 Olympus IX 70显微镜;钙荧光强度测定采用德国 Zeiss公司 LSM-510激光共聚焦显微镜。
2 实验方法 将子宫平滑肌组织于无菌条件下快速送实验室,用75%酒精冲洗两遍,再用 PBS冲洗 3遍后剪碎和洗涤,加入适量的 0.2%Ⅱ型胶原酶(DM EM+Ⅱ型胶原酶),37℃水浴震荡消化 4~ 5h,加入完全 DMEM培养液(80%DMEM+20%胎牛血清)DMEM培养液(DMEM+10%胎牛血清+青霉素100IU/ml+链霉素 100 μ g/ml)终止消化,用吸管反复轻轻吹打、过滤、离心、去上清液,将离心所得细胞加入适量完全 DMEM培养液充分混匀,接种于底面积为25cm2培养瓶中,置 37℃,100%饱和湿度和 5%CO2培养箱中培养。培养30h后第1次换液,以后每两天换液1次,并在倒置显微镜下观察细胞生长情况。细胞共计生长 10d后用0.2%胰蛋白酶消化后平均分别置于 12孔板中。
第一部分 将子宫平滑肌细胞在室温下用100mmol/L酯化形式的 Fluo-3AM染色 60min后,用Hank液浸洗去细胞外残余荧光染色剂,在相差显微镜下挑选活性良好的子宫平滑肌细胞进行实验。40个孔板中活性良好的子宫平滑肌细胞随机等分为 4组(n=10):对照组、低浓度咪达唑仑组(M1组)、中浓度咪达唑仑组(M2组)、高浓度咪达唑仑组(M3组),用 LSM-510激光共聚焦显微镜测定反映游离 Ca2+浓度的细胞内钙荧光强度(激发波长 488nm,发射波长 505nm),测定钙荧光强度的基础值后,分别给予 Hank’s液、终浓度 为 1 μ mol/L、 3 μ mol/L、 15 μ mol/L 咪 达 唑 仑处 理20min后再测定钙荧光强度,然后加入氯化钾(批号:H42020421),同时每隔 10s扫描一幅记录钙荧光强度峰值。每个孔板在激光共聚焦显微镜下随机选定10个子宫平滑肌细胞,利用图形分析软件分析细胞内钙荧光强度,记录峰值后取平均值。
第二部分以咖啡因(终浓度 20mmol/L)代替氯化钾,其余同第一部分。
结 果
1 子宫平滑肌细胞培养及荧光染色子宫平滑肌细胞图 见图 1~3。
2 游离Ca2+浓度测定结果 见表1~ 2。第一部分与基础值比较:各组加入咪达唑仑后钙荧光强度无显著性差异(P>0.05),但加入氯化钾后钙荧光强度升高(P<0.01);M1组与对照组加入氯化钾后钙荧光强度无显著性差异(P>0.05),M2组与 M3组加入氯化钾后钙荧光强度峰值低于对照组(P<0.01),且 M3组低于 M2组(P<0.05)。第二部分与基础值比较,各组加入咪达唑仑后钙荧光强度无显著性差异(P>0.05),加入咖啡因后钙荧光强度升高(P<0.01);加入咖啡因后各组钙荧光强度无显著性差异(P>0.05)。

图1 子宫平滑肌细胞 (×40)

图2 荧光染色子宫平滑肌细胞(×40)
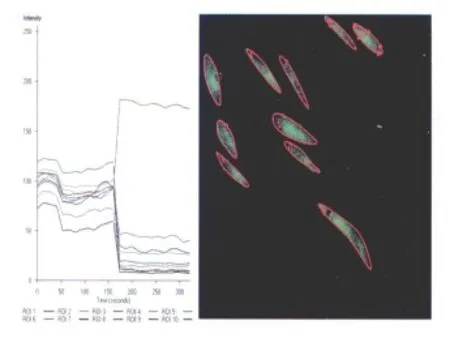
图3 图形分析软件所示结果
表1 咪达唑仑对氯化钾诱发子宫平滑肌细胞钙离子荧光强度峰值变化的影响(n=10,±s)
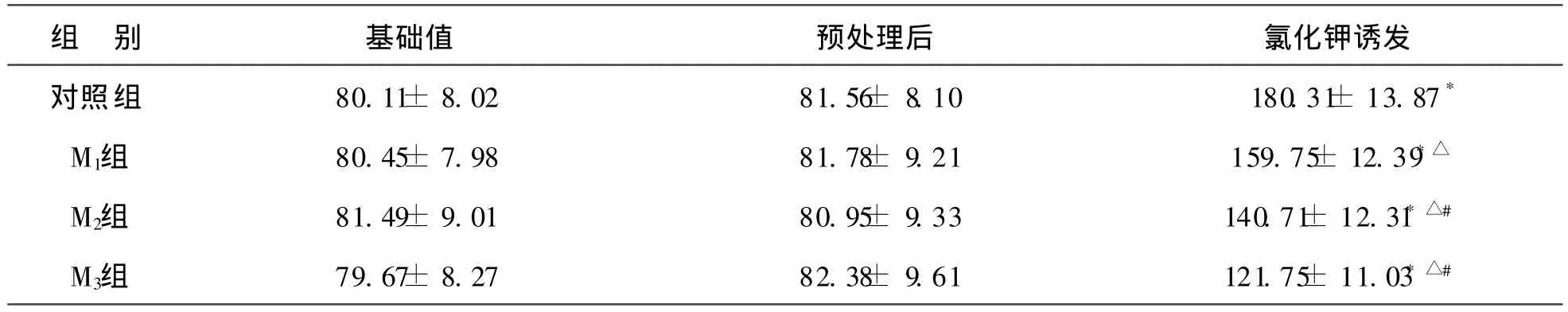
表1 咪达唑仑对氯化钾诱发子宫平滑肌细胞钙离子荧光强度峰值变化的影响(n=10,±s)
※注:与基础值比较,* P<0.01;与对照组比较,△ P<0.01;与 M1组比较,#P<0.01;与 M2组比较,※ P<0.01
组 别 基础值 预处理后 氯化钾诱发对照 组 80.11± 8.02 81.56± 8.10 180.31± 13.87*M1组 80.45± 7.98 81.78± 9.21 159.75± 12.39* △M2组 81.49± 9.01 80.95± 9.33 140.71± 12.31* △#M3组 79.67± 8.27 82.38± 9.61 121.75± 11.03* △#
表2 咪达唑仑对咖啡因诱发子宫平滑肌细胞钙离子荧光强度峰值变化的影响(n=10,±s)

表2 咪达唑仑对咖啡因诱发子宫平滑肌细胞钙离子荧光强度峰值变化的影响(n=10,±s)
注:与基础值比较,* P<0.01
组 别 基础值 预处理后 咖啡因诱发对照 组 81.75± 7.94 81.41± 5.16 121.64± 10.33*K1组 79.58± 9.24 82.07± 9.23 122.64± 12.07*K2组 83.35± 7.90 82.84± 6.17 121.54± 11.71*K3组 83.11± 7.997 82.35± 6.16 120.95± 11.32*
讨 论
细胞内钙离子([Ca2+]i)作为第二信使,对细胞、组织、器官及整个生命系统的功能具有非常重要的影响。 [Ca2+]i浓度的变化,是诸多生理和病理变化的起动和发展的重要中介因素。子宫收缩的动因来自内源性催产素和前列腺素的释放。催产素可促进钙离子向肌细胞内移动,前列腺素是钙离子的载体,其与钙离子形成复合体并将其带入肌细胞内。细胞内游离钙离子是肌肉兴奋-收缩偶联的活化剂,与肌动蛋白、肌浆蛋白的结合引起子宫收缩与缩复,使肌纤维间子宫血管受压而迂曲闭塞,加之内源性前列腺素作用下血小板的聚集、凝固加强,参与并引发凝血和血栓形成,堵塞胎盘剥离面处子宫血管,从而完成分娩的自然止血。可见所有影响子宫平滑肌细胞内外钙离子移动的因素都有可能干扰子宫收缩,导致产后出血。 Gursoy等[4]发现吸入麻醉药抑制妊娠子宫平滑肌收缩性与钙离子活动有关。 Tsujiguchi等[5]发现丙泊酚抑制缩宫素诱发的孕鼠子宫平滑肌收缩,其可能机制是丙泊酚抑制孕鼠子宫平滑肌细胞膜上的钙通道导致钙内流减少。Yamakage等[6]发现咪达唑仑通过抑制细胞膜上的钙通道,降低细胞内钙引起犬气道平滑肌松弛。因此我们推测咪达唑仑可能影响子宫平滑肌细胞内、外 Ca2+移动而影响子宫收缩。
咪达唑仑是一种具有较强镇静、顺行性遗忘作用的静脉全麻药,对呼吸循环系统影响较轻,广泛应用于临床麻醉,其临床诱导峰浓度为3 μmol/L。参照李继昌等[7]研究咪达唑仑对大鼠心肌细胞内钙离子的影响,本研究选择 1、3、15 μ mol/L 3种浓度的咪达唑仑预处理子宫平滑肌细胞进行实验。
Fluo-3AM是一种高度特异性的 Ca2+荧光探针,进入细胞后经水解去掉乙酸甲酯(AM)成为 Fluo-3。Fluo-3在无 Ca2+存在时基本不发荧光.而与细胞内游离 Ca2+结合后.其荧光强度明显增强.因此细胞内荧光强度的改变可灵敏地反映细胞内游离 Ca2+浓度的变化。细胞内有游离钙和结合钙两种 Ca2+存在,游离钙的浓度 [Ca2+]i受 Ca2+跨膜转运和细胞内钙库的 Ca2+动员影响。理论上高浓度的氯化钾可促使细胞膜去极化,细胞膜上电压依赖性钙通道开放,钙离子跨膜内流,使 [Ca2+]i升高而产生相应的效应[8]。而咖啡因为动员 Ryanodine型钙释放而使 [Ca2+]i升高[9]。本研究参照李元涛等[10]实验,选择 40mmol/L的氯化钾和20mmol/L的咖啡因诱发子宫平滑肌细胞 [Ca2+]i升高,观察不同浓度的咪达唑仑对其钙离子移动变化的影响。
本研究第一部分各组加入 40mmol/L氯化钾后,细胞内钙荧光强度迅速升高,提示氯化钾可引起子宫平滑肌细胞内钙离子浓度的升高。氯化钾引起的钙离子浓度升高与细胞内钙释放及细胞膜上的受体无关,主要源于细胞外高浓度的钾离子对细胞膜外向钾电流的抑制导致细胞膜的去极化,从而激活了 L-型电压依赖性钙通道(L-VDCC),继而引起细胞外 Ca2+的跨膜内流,从而导致细胞内 Ca2+浓度升高[11]。 K1组结果显示,预先应用 30 μ mol/L的咪达唑仑后,氯化钾引起的Ca2+浓度升高幅度无明显变化,但 K2、K3组结果显示,预先应用 100 μ mol/L、300 μ mol/L的咪达唑仑后 ,氯化钾引起的 Ca2+浓度升高幅度明显变小,且 K3组明显小于K2组。由于L-VDCC是氯化钾引起的细胞内Ca2+浓度升高的主要途径,由此推测,低浓度咪达唑仑对子宫平滑肌细胞膜上的 L-VDCC无抑制作用,而中、高浓度咪达唑仑可能对子宫平滑肌细胞膜上的 L-VDCC存在一定程度的抑制作用,其抑制作用呈浓度依赖性。
第二部分各组加入 20mmol/L咖啡因后,细胞内钙荧光强度升高,提示咖啡因可引起子宫平滑肌细胞内Ca2+浓度的升高,咖啡因是细胞内Ca2+释放剂,可引起肌浆网释放 Ca2+,各组预先应用咪达唑仑后,咖啡因引起的Ca2+浓度升高幅度无明显变化,由此推测,咪达唑仑对子宫平滑肌细胞内肌浆网 Ca2+释放功能无明显影响。
我们推测咪达唑仑可能通过抑制子宫平滑肌细胞膜上 L-VDCC,减少 Ca2+内流,降低细胞内游离 Ca2+浓度,影响子宫平滑肌细胞收缩。而咪达唑仑对子宫平滑肌细胞膜上的受体门控通道(ROC)、钙库控制通道(SOC)等 Ca2+通道的影响有待于进一步研究。
综上所述,高浓度咪达唑仑可明显抑制人子宫平滑肌收缩,可能会引起宫缩乏力,导致产后出血,因此产科麻醉避免使用高浓度的咪达唑仑,尤其是存在有宫缩乏力高危因素的产妇。
[1]李子刚,汤慧芳,陈季强.地西泮与咪达唑仑对离体大鼠子宫平滑肌收缩的影响 [J].中国药理学与毒理学杂志,2006,20(5):372-376.
[2]W ray S,Shmygol A.Role of the calcium store in uterine contractility[J].Semin Cell Dev Biol,2007,18(3):315-320.
[3]ArthurP,Taggart M J,Mitchell BF.Oxytocin and parturition:a role for increased myometrial calcium and calcium sensitization[J].Front Biosci,2007,12(6):619-633.
[4]Gursoy S,Kaya T,Kunt N,et al.Interactive effect of sevoflurane with isradipine or indomethacin on spontaneous contractile activity of isolated pregnant rat myometrium[J].Int J Obstet Anesth,2004,13(2):234-238.
[5]Tsujiguchi N,Yamakage M,Namiki A.Mechanisms of direct inhibitory action of propofol on uterine smooth muscle contraction in pregnant rats[J].Anesthesiology,2001,95(5):1245-1255.
[6]Yamakage M,Tsujiguchi N,Matsuzaki T.Inhibitory effects of diazepam and midazolam on Ca2+and K+channels in canine tracheal smooth muscle cells[J].Anesthesiology,1999,90(1):197-207.
[7]李继昌,庄心良,李士通,等.几种静脉麻醉药对大鼠心室肌细胞游离钙离子移动的影响 [J].中华麻醉学杂志,1999,19(9):550-553.
[8]Lopez-Escamez JA,Schacht J.Mechanically induced calcium increases in isolated vestibular hair cells of the guinea pig[J].Acta Otolaryngol,1995,115(5):759-764.
[9]Tribe RM,Borin M L,Blaustein M P.Functionally and spatially distinct Ca2+stores are revealed in cultured vascular smooth muscle cells[J].Proc Natl Acad Sci USA,1994,91(80):5908-5912.
[10]李元涛,杨京利,周 龙,等.七氟醚对豚鼠耳蜗外毛细胞 Ca2+跨膜内流和内质网钙释放功能的影响 [J].中华麻醉学杂志,2008,28(5):427-429.
[11]Hideaki K,Hiroshi O,Masatoshi H,et al.Calcium movements,distribution,and functions in the smooth muscle[J].Pharmacol Rev,1997,49(2):157-230.
