M2e-HBC融合蛋白的真核表达
2011-07-06西安市第四医院呼吸科西安710004李志奎
西安市第四医院呼吸科(西安 710004)刘 蕊 李志奎
流感病毒是一种引起急性呼吸道传染性疾病的病毒。按照NP和M1蛋白的抗原性可将流感病毒分为甲、乙、丙 3型。根据 HA和 NA抗原性不同,甲型流感病毒又分为不同的亚型。目前用于人群的流感疫苗主要针对 HA和NA抗原,能在儿童和成人中产生有效保护[1]。病毒样颗粒(Virus-like particle,VLP)在形态和结构上类似于病毒,但不含病毒基因组。它一般具有天然的自我装配能力,可包裹核酸或其他小分子,可作为基因或药物的装载工具。VLP目前主要用作基因载体,既能将自身作为病毒疫苗,也能作为疫苗递送工具[2]。
本实验构建了以 HBC为载体的 M2基因胞外区(M2e)通用疫苗杆粒,利用昆虫细胞杆状病毒表达系统,进行了初步的蛋白表达。为制备流感通用疫苗奠定了基础。
材料与方法
1 实验材料 HBC基因序列由大连 TaKaRa公司合成,昆虫细胞杆状病毒载体质粒pFastHT A、脂质体cellinfectin reagent、sf900Ⅲ昆虫细胞培养基和 sf9昆虫细胞购自美国 invotrgon公司,感受态细胞 DH5a和 DH10Bac由军事医学科学院微生物流行病研究所保存,限制性内切酶 Kpn I、Nco I、T4连接酶及 DNA/RNA Minibest extraction kit ver 3.0购自大连Takara公司,低熔点琼脂糖粉购自德国 Sigma公司。
2 实验方法
2.1 基因合成 两条由 Takara公司合成的基因序列来源分别为NCBI Genbank所报道。HBC序列号为 AM184126,gene1814~2458,全长 644bp,经测序正确。
2.2 引物设计 根据 Takara公司合成的基因序列 设 计 一 对 引 物。 上 游 引 物: 5’-atggatccatgagtcttctaaccgaggtcgaaacgcctatcagaaacgaat gggggtgcagatgcaacgattcaagtgatcaactttttcacctctgcct-
3’,下游引物:5’-cgaagcttgcgtttagcagt-3’。引入 BamHⅠ ,HindⅢ酶切位点。
2.3 PCR和扩增产物回收 按说明配制 PCR反应体系:10倍 PCR缓冲液 2.5μ l,10mmol/L dNTPs 1 μ l,50 pmol/L上游引物 1μ l,50 pmol/L下游引物 1 μ l,Taq DNA聚合酶 0.3μ l,超纯水 17.2 μ l。瞬时离心后,94℃预变性 5 min;94℃ 45 s,58℃ 45 s,72℃ 90 s,25个循环;72℃延伸 10 min,4℃运行 10 min。 PCR产物经1%琼脂糖凝胶电泳鉴定,回收目的片断。
2.4 构建含 sf9昆虫细胞表达载体的质粒与鉴定 回收的目的片断与载体 pFastBac HTA质粒DNA分别经限制性内切酶BamHⅠ ,HindⅢ双酶切回收后,在 T4连接酶的作用下将目的基因片段与载体片段按 3∶1物质的量比例进行连接,连接产物转化感受态大肠杆菌 DH5a,挑取经氨苄青霉素抗性筛选的单克隆菌落扩增培养,提取重组质粒DNA,经双酶切,PCR方法鉴定正确的重组质粒送至上海英骏生物技术有限公司测序鉴定。将鉴定结果提交 Genbank进行 Blast比对。
2.5 同源重组 将重组质粒用 CaCl2转化方法转化 DH10Bac,挑取经 Kana、Tet、Gen和蓝白斑筛选的单克隆菌落扩增培养。碱裂解法提杆粒,用 M13-M4、M13-RV引物进行 PCR扩增,以进一步鉴定阳性重组体。
2.6 转染sf9昆虫细胞 转染前在6孔平板上每一孔内加入 9× 105sf9昆虫细胞,27℃放置 1h,将 1 μ g杆粒和 6 μ l转染试剂分别稀释至 100μ lsf900Ⅲ昆虫细胞培养基中,两者混匀,室温孵育 15~ 45 min后覆盖于细胞上,27℃放置 5h,弃去转染混合物加入 sf900Ⅲ昆虫细胞培养基,27℃孵育 72 h。收获病毒,DNA/RNA minibest extraction kit提取病毒 DNA,PCR分析细胞培养物的病毒颗粒,鉴别重组体,证明插入序列的大小。
2.7 空斑试验 在6孔平板上每一孔内加入1×106sf9昆虫细胞,27℃放置1 h,将病毒上清作 8 Log系列稀释(10-1~ 10-8)。将孔内上清弃去后,依次加入1 ml对照培养基及各病毒稀释液,27℃放置 1 h,按 3∶1比例混匀sf900昆虫空斑培养基(1.3×)与4%琼脂凝胶,于 40℃水浴,分别加 2 ml于各孔中,27℃孵育 4~ l0d,每天观察平板直至空斑计数连续两天不变。
2.8 重组病毒表达 将转染后的细胞用3%多聚甲醛固定 20 min;PBS洗 2次;0.2%TritonX-100打孔5 min;PBS洗 1次;10%FBS封闭 20 min;PBS洗 3次;3%BSA稀释带有 HiS-tag的小鼠单克隆抗体,室温孵育 1 h;PBS洗 3次;1%Triton X-100+3%BSA打孔 5 min;PBS洗 2次;3%BSA稀释带有 FITC荧光素的羊抗鼠二抗,室温孵育 1 h;PBS洗 3次;80%甘油封片,荧光显微镜观察;收集感染后的细胞加入 5×SDS凝胶上样缓冲液,100℃煮沸 5 min,室温下离心 1 min,取 10 μ l进行 SDS-PAGE(聚合胶 5%,分离胶 15%),考马斯亮蓝染色。
2.9 电镜观察 收集感染重组杆状病毒 72 h的sf9昆虫细胞各107,加入约 5倍体积昆虫细胞裂解液,辅以简短超声裂解,3000 r/min离心 30 min,去除沉渣,取上清,30000 r/min超速离心 3 h,吸出管底液体,取10 μ l滴于碳膜包被的铜网上,室温放置5 min,吸取多余液体,再经磷钨酸负染,在透射电镜下观察重组病毒VLP在昆虫细胞中的存在状况。
结 果
1 扩增 M2e-HBC 经 1%琼脂糖凝胶电泳鉴定,获得大小约 700bp的目的基因片段,与预计片段大小相符(见图1),表明获得所需的目的片段。
2 含昆虫细胞表达载体的质粒鉴定 提取质粒DNA,凝胶电泳显示,M2e-HBC-pFas+BacHTA大小为 5.5kb,与预计片段大小相符。用双酶切鉴定,M2e-HBC-pFas+Bac HTA电泳为两条带,分别为 700bp和4.8 kb。将酶切鉴定为阳性的质粒DNA进行PCR,电泳出现大小约700bp的目的基因片段(见图2)。测序结果提交Genbank进行Blast比对,目的基因片段序列与 M2e-HBC完全一致。
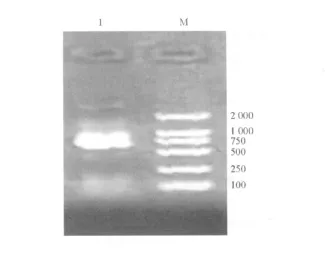
图1 PCR扩增 M2e-HBC基因 1示 M2e-HBG基因片断;M示标准分子量 DL2000

图2 M2e-HBG-pFas+Bac HYA质粒鉴定结果 M 1示DN A标准 (DL15000);1示 M2e-HBC-pFas+BacHTA质粒电三疗结果;2示 M2e-HBC-pFas+BacHTA酶切结果;3示 M2e-HBC-pFas+BacHTA鉴定结果;M2示 DN A标准 CDL2000
3 同源重组鉴定 同源重组后,碱裂解法提取杆粒,获得大小约 135 kb的基因组。 M2e-HBC转位pFastBac HTA的杆粒 PCR,经 0.7%琼脂糖电泳鉴定,可见大小约为 3100 bp的基因片段(见图 3)。
4 转染 sf9昆虫细胞结果 转染前sf9昆虫细胞形态正常,转染后sf9昆虫细胞变大、变圆,或形态不规则,胞膜溶解,细胞破碎。
5 空斑试验结果 肉眼观察,重组病毒产生很淡的牛奶样空斑,经计算,原始母株效价约为 3×106pfu/ml。
6 蛋白表达结果 收集感染的sf9昆虫细胞进行SDS-PAGE,结果显示在26000有一条带,而在对照则无此条带(见图 4),表明M2e-HBC重组病毒可表达出蛋白,约占细胞总蛋白的l0%。

图3 杆粒 M2e-HBG-PCR鉴定 1示 M2e-HBC杆粒 PCR结果;M示 DNA标准 (CDL15000)

图4 12%SDS-PAGE检测 M2e-HBC蛋白 sfs细胞的表达 1示 sfs细胞表达 M2e-HBC蛋白;2示空白对照(sf9细胞);M示低分子量标准量蛋白
供体载体 pFas+Bac HTA N端带有6×His-tag,因此转染后的细胞经荧光抗体染色法染色后,置于荧光显微镜下观察,可见转染成功,表达 His-tag蛋白的细胞发出强烈的绿色荧光;而未表达 His-tag蛋白的细胞则较为暗淡 ,为非特异性荧光(见图 5)。
7 电镜观察 经透射电镜观察表明细胞内有球形空心病毒样颗粒形成,大小约 50 nm(见图 6),表明M2e-HBC VLP是由重组杆状病毒感染后昆虫细胞合成的。

图5 荧光显微镜下检测到的表达带有 His-tag蛋白的细胞
图6 电镜下的 M2e-HBC病毒样颗粒(箭头示)(×65 000)
讨 论
自从1933年第一株流感病毒被分离以来,所有报道的人类M2e序列经比对后证实高度保守,只有两个位置有氨基酸的替换。通过连接M2e到合适的载体上,证实了其可呈递它的免疫原性,并且发现抗体反应有效,能够完全保护小鼠逃避潜在致死性流感病毒感染[2~3]。因此,目前关于甲型流感病毒 M2e蛋白疫苗的研究成为一个热点。据报道,英国和比利时的公司已经在进行 M2e-HBC融合蛋白疫苗的开发,但他们是将M2e-HBC蛋白表达在原核细胞内。本实验采用昆虫细胞杆状病毒表达系统,由于是真核表达系统,表达的重组蛋白具有完整的生物学功能,结构及功能上接近天然蛋白且表达水平高,所以被选择替代大肠杆菌系统,以期得到更加优化的重组目的蛋白。天然分离或人工合成的具有免疫原性的表位(M2e)可以通过基因工程方法在机体得到表达,但该方法也具有一定弊端:①病原体抗原和人工表位相对分子质量常常较小,免疫原性低,难以产生足够的免疫反应;②外源肽段在机体免疫系统内仅能获得弱的呈递性;③小分子肽段在体内容易降解,故免疫力持续时间短;④单一表位往往在人群中的覆盖率低,难以产生有应用价值的广泛的保护性。所以,在当今的疫苗研制工作中以添加佐剂和使用结构复杂病毒蛋白作为表位免疫原性的放大载体就成为工作中的一个热点。重组体蛋白是否具有免疫原性及免疫原性的高低主要依赖重组体病毒是否在细胞中自我包装成VLP。在本实验中,HBC融合 M2e后,通过电镜观察说明仍可自动装配出VLP,从而为增强 M2e的免疫原性提供了依据。进一步的试验纯化出蛋白后,通过敏感动物模型,可以确定VLP-M2e通用疫苗最佳免疫策略,包括免疫途径、佐剂、免疫剂量及次数等。将人禽流感病毒 HA、NA、NP等基因片段的保护序列分别与M2e融合,建立高表达VLP-M2e-X的昆虫杆状病毒系统,筛选出具有良好保护效果的通用疫苗 VLPM2e-X等都是今后试验的目标。制备流感通用疫苗甚至人禽流感通用疫苗具有良好的前景,可以依靠多种方法、途径来实现。
[1]Nicholson KG,Wood JM,Zambon M.Influenza[J].Lancet,2003,362(9397):1733-1745.
[2]王惠明,吴玉章.以病毒样颗粒为平台的分子载体和疫苗设计 [J].免疫学杂志 ,2006,22(1):110-113.
[3]HuleattJW,NakaarV,DesaiP,etal. Potent immunogenicity and efficacy of a universal influenza vaccinecandidate comprising a recombinantfusion protein 1inking influenza M2e to the TLR5ligand nagellin.Vaccine,2008,26(2):201-214.
