哮喘患者外周血Th1、Th2、CD4+CD25+T细胞的变化及其意义
2011-07-05谢华健周小敏林奇栋
谢华健,周小敏,林奇栋
(儋州市第一人民医院,海南 儋州 571700)
支气管哮喘(简称“哮喘”)是一种由多因素引起的以可逆性气道阻塞、气道高反应性和气道炎症为特征的免疫变态反应性疾病,其中以气道炎症为最主要的病理变化,并决定气道阻塞和气道高反应性的程度[1]。辅助性T细胞(Th细胞)及其产生的细胞因子在哮喘慢性气道炎症中起主要作用[2],同时有研究发现CD4+CD25+T细胞对于维持自身免疫耐受,抑制自身免疫性疾病具有重要作用[3-4]。本文以52例急性哮喘患者和56例慢性哮喘患者为研究对象,采用流式细胞术检测哮喘患者外周血中Th1、Th2和CD4+CD25+T细胞的水平,观察Th1/Th2细胞平衡的变化,并选择60名健康人群作为对照,探讨Th细胞和CD4+CD25+T细胞与哮喘发病的关系。
1 对象与方法
1.1 研究对象 选自2008年1月至2010年1月在我院门诊和住院治疗的哮喘患者,诊断及病情严重程度分类均符合中华医学会呼吸病分会哮喘学组制定的哮喘诊断标准[5]。所有哮喘患者均仔细询问病史及严格体检,必要时检查X线胸片排除肺炎。108例哮喘患者中,急性哮喘患者52例(急性组),男29例,女23例,年龄18~63岁,平均 (46.2 ±12.6)岁;慢性哮喘患者56例(慢性组),男32例,女24例,年龄21~66岁,平均(49.5±16.3)岁;60名健康对照人群(对照组)均来自同期我院健康体检中心体检,男34例,女26例,年龄20~60岁,平均 (39.7 ±14.8)岁。所有对象均排除脑外伤、脑肿瘤、脑血管疾病、泌尿系统、消化系统及其他系统疾病,各组的年龄差异和性别分布差异无统计学意义(P>0.05)。
1.2 研究方法
1.2.1 试剂和仪器 鼠抗人单克隆抗体(mAb)CD3-FITC、CD8-PercP、IFN-γ-PE、IL-4-PE、CD4-PercP、CD25-PE及其相应同型对照IgG1-PE、IgG2a-PE和FACS Calibur流式细胞仪均为美国Becton Dickinson公司产品。佛波酯(PMA)、离子霉素(Ionomycin)以及布雷菲德菌素A(BFA)购自美国Sigma公司。
1.2.2 Th1、Th2细胞测定 安静状态下无菌抽取研究对象空腹静脉血2 ml,肝素钠抗凝,取400 μl平均分为刺激管及未刺激管,前者加入PMA(1 mg/L)、Ionomycin(50 mg/L)及 BFA(0.5 g/L),后者仅加入BFA。混匀后加进细胞培养板中,置于CO2培养箱中培养5 h。收集细胞,分为对照管和试验管,分别加入mAbCD3-FITC及CD8-PercP各20 μl进行胞膜表面标记染色,室温避光孵育15 min,固定洗涤细胞进行破膜及胞内因子标记,每管中加入100 μl破膜剂及相应的细胞内因子mAb IFN-γ-PE、IL-4-PE和相应阴性对照IgG1-PE、IgG2a-PE各20 μl,室温避光15 min。洗涤并加500 μl PBS重悬细胞,上机检测。
1.2.3 CD4+CD25+T细胞检测 安静状态下无菌抽取研究对象空腹静脉血2 ml,肝素钠抗凝,分别向检测管和同型对照管中加入外周血100 μl,检测管加入mAbCD4-PercP及CD25-PE各20 μl,同型对照管加入同型对照鼠抗人IgG1/PE及IgG2a/PE标记抗体各20 μl,混匀,室温避光孵育15 min后,每管各加红细胞裂解液3 ml,振荡混匀后置室温孵育15 min,至液体透亮,1 000 r/min离心5 min,弃上清,加入500 μl磷酸缓冲液(PBS)重悬细胞,室温避光10 min后上机检测。
1.2.4 检测分析细胞 用同型对照确定荧光阴性范围,设定相应各信道电压及之间的荧光补偿后,依次使用流式细胞仪检测标本,根据前向散射(FSC)和侧向散射角(SSC)对淋巴细胞群进行设门,每次获取设门内10 000个细胞,用CellQuest软件获取并分析结果。
1.3 统计学方法 应用SPSS13.0统计软件进行统计学处理。结果采用均数±标准差(±s)表示。采用单因素的方差分析对各组外周血中Th1、Th2水平、Th1/Th2比值和CD4+CD25+细胞的水平进行比较,在此基础上进行组间两两比较(LSD法),上述分析均采用双侧检验,以α=0.05为统计意义水准。
2 结 果
2.1 各组外周血中Th1、Th2水平和Th1/Th2比值 由表1可知,各组外周血中Th1、Th2水平和Th1/Th2比值差异均有统计学意义(P<0.05)。组间两两比较(表2)显示:急性组患者外周血中Th1水平显著低于慢性组患者和健康对照人群(P<0.05),同时慢性组患者与健康对照人群的差异也具有统计学意义(P<0.05);急性组患者外周血中Th2水平显著高于慢性组患者和健康对照人群(P<0.05),同时慢性组患者与健康对照人群的差异也具有统计学意义(P<0.05);急性组患者外周血中Th1/Th2比值显著低于慢性组患者和健康对照人群(P<0.05),同时慢性组患者与健康对照人群的差异也具有统计学意义(P<0.05)。
2.2 各组外周血中CD4+CD25+细胞的水平 由表3可知,各组外周血中CD4+CD25+细胞的水平差异均有统计学意义(P<0.05)。组间两两比较(表4)显示:急性组患者外周血中CD4+CD25+细胞的水平显著低于慢性组患者和健康对照人群(P<0.05),同时慢性组患者与健康对照人群的差异也具有统计学意义(P<0.05)。
表1 各组外周血中Th1、Th2水平和Th1/Th2比值(±s)

表1 各组外周血中Th1、Th2水平和Th1/Th2比值(±s)
组别 例数Th1(%)Th2(%)Th1/Th2急性组慢性组对照组FP 52 56 60 10.216 0.000 11.62±4.52 13.36±4.34 15.11±3.40 10.216 0.000 3.88±1.32 3.07±0.84 2.46±0.58 31.617 0.000 4.29±1.50 3.07±1.57 7.97±.67 23.333 0.000
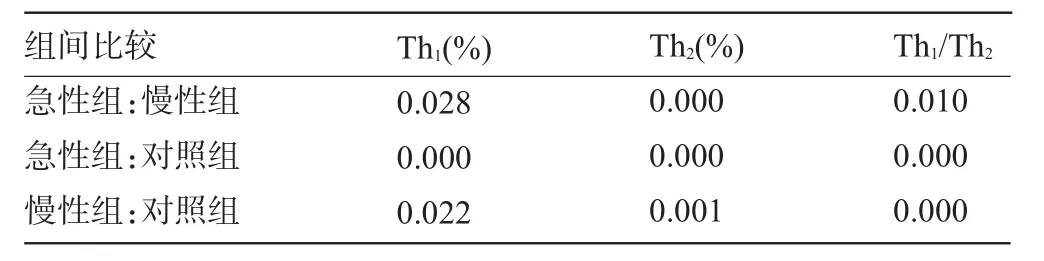
表2 外周血中Th1、Th2水平和Th1/Th2比值组间两两比较结果
表3 各组外周血中CD4+CD25+细胞的水平(%,±s)

表3 各组外周血中CD4+CD25+细胞的水平(%,±s)
组别急性组慢性组对照组FP例数52 56 60 CD4+CD25+4.29±1.50 6.56±1.57 7.97±1.67 75.909 0.000
表4 外周血中CD4+CD25+细胞的水平组间两两比较结果(±s)

表4 外周血中CD4+CD25+细胞的水平组间两两比较结果(±s)
组间比较急性组:慢性组急性组:对照组慢性组:对照组CD4+CD25+0.000 0.000 0.000
3 讨论
哮喘的病因和发病机制非常复杂,在其气道慢性变应性炎症中,有多种炎症细胞、炎症介质和细胞因子参与炎症过程,T淋巴细胞及其分泌的各种细胞因子在其中发挥了重要作用。随着研究的进展,Th细胞对哮喘的作用越来越受到重视,成为可能揭示哮喘发病机制的一个新的途径[6]。Th细胞根据其分泌的细胞因子不同,主要分为Th1和Th2亚群。Th1细胞分泌IL-2和IFN-γ等细胞因子,可活化吞噬细胞,增强其抗感染能力,介导细胞免疫,同时可抑制过度的Th2细胞介导的免疫反应;Th2主要分泌IL-4,而IL-4可促进B细胞分化,诱导B细胞合成IgE,介导体液免疫反应。因此,Th2淋巴细胞在哮喘发病过程中起关键作用。过敏原对哮喘患者Th细胞增殖有选择性,促进Th2细胞优势表达,从而使Th1/Th2平衡向Th2转化[7]。当Th2细胞占优势时,IL-4分泌增加,易发生高IgE血症,结果导致哮喘的发作。本研究结果显示:与健康对照人群组比较,急性哮喘患者外周血中的Th1细胞明显降低,而Th2细胞数明显升高,且Th1/Th2比值明显下降,说明哮喘患者Th亚群之间的平衡发生了改变,引起Th1细胞相对减少而Th2细胞相对增加,Th细胞亚群之间的相互抑制交叉调节的功能被削弱,由此可以推测Th细胞亚群之间的平衡破坏是哮喘发病中的重要因素。
2004 年Wickelgren从人的血液中分离到了CD4+CD25+T细胞,并证实其对其他T细胞的增殖具有抑制作用[8]。近年研究表明,CD4+CD25+T细胞在维持机体自身稳定性及免疫耐受方面具有重要作用。在体外用抗原刺激后,人类CD4+CD25+T细胞可以抑制CD4+CD25+T细胞增殖和Th2型细胞因子的产生[9]。CD4+CD25+T细胞免疫功能可能是抑制Th2细胞对环境抗原的不适当应答,所以哮喘等过敏性疾病的发生机制可能就是此种调节功能的缺陷或者不足。本研究结果显示:急性组患者外周血中CD4+CD25+细胞的水平显著低于慢性组患者和健康对照人群。说明CD4+CD25+细胞数目的明显减少,导致抑制Th2细胞的能力下降,Th2型细胞因子的产生增加,使哮喘发病。但是也有研究提示哮喘患者的CD4+CD25+T细胞在数量上无明显减少,但在功能上存在缺陷[10]。
综上所述,哮喘患者中Th细胞和CD4+CD25+T细胞出现明显的数目变化,使某些细胞因子(IL-2、IFN-γ、IL-4、IL-5)的分泌增加,从而介导细胞和体液免疫,导致哮喘的发生。因此Th1和Th2细胞的平衡破坏、CD4+CD25+T细胞数目和功能的下降在哮喘的疾病活动中起到重要的作用,是导致哮喘患者细胞免疫失调的重要原因。
[1] 白 敏,刁晓源,张湘燕,等.支气管哮喘发病机制研究进展[J].医学综述,2009,15(15):2294-2297.
[2] Mochizuki H,Shigeta M,Morikawa A.Develeprnent of bronchial hyperresponsiveness during childhood[J].J Asthma,2001,38(1):11-21.
[3] Ng WF,Duggan PJ,Ponchel F,et al.Human CD4(+)CD25(+)cells:a naturally occuring population of regulatory T cells[J].Blood,2001,98(9):2736-2744.
[4] 陈万军,张 恒.CD4+CD25+T免疫调节细胞在疾病发生和临床应用中的意义[J].中华医学杂志,2005,85(41):2948-2951.
[5] 中华医学会呼吸病分会哮喘组.支气管哮喘防治指南[J].中华结核和呼吸杂志,2003,26(2):133.
[6] 夏 雯,葛传生,潘晓勤,等.哮喘发作期患儿Th1/Th2亚群平衡变化的观察[J].江苏医药杂志,2002,28(9):681-682.
[7] Moveragre R,Elfinan L,Stalenheim G,et al.Study of the Th1/Th2balance,including IL-10 production,in cultures of peripheral blood mononuclear cells from birch-pollen-allergic patients[J].Allergy,2000,55(2):171-175.
[8] Wickelgren I.lmmunology:Policing the immune system[J].Science,2004,306(5696):596-599.
[9] Bellinghausen I,Klostermann B,Konp J,et al.Human CD4+CD25+T cells derived from the majority of atopic donors are able to suppress Th1and Th2cytokine production[J].J Allergy Clin Immunol,2003,111(4):862-868.
[10] Lee JH,Yu HH,Wang LC,et al.The levels of CD4+CD25+regulatory T cells in paediatric patients with allergic rhinitis and bronchial asthma[J].J Clin Exp Immunol,2007,148(1):53-63.
