子宫内膜异位症患者雌*、孕激素受体和Bcl-2、Bax表达的研究
2011-06-21李斌王君范颖
李 斌 王 君 范 颖
(首都医科大学附属北京安贞医院妇产科,北京 100029)
子宫内膜异位症(endometriosis,EM)多发生于育龄妇女,是一种雌激素依赖性疾病。正常子宫内膜的增殖和分泌受到雌孕激素及其受体(ER、PR)的调节。多数学者认为 EM患者子宫内膜细胞凋亡减弱、增殖增强[1,2]。本研究通过免疫组织化学的方法检测 EM在位及异位内膜上 ER、PR与凋亡抑制基因(Bcl-2)、促凋亡基因(Bax)的表达情况,探讨雌孕激素受体在 EM细胞凋亡与增殖活动中的调控作用。
1 临床资料与方法
1.1 一般资料
EM组 40例,年龄 26~45岁,(36.0±6.3)岁。选取 2006年 8月 ~2007年 8月在我院因 EM行腹腔镜手术的患者,术中取在位及异位子宫内膜,术后均经病理证实为 EM,其中增殖期 20例,分泌期 20例。
对照组 40例,年龄 27~44岁,(34.6±5.2)岁。为同期因其他非激素依赖性疾病(15例输卵管积水、13例卵巢浆液性囊腺瘤、12例卵巢黏液性囊腺瘤)行腹腔镜手术患者的子宫内膜,增殖期 20例,分泌期 20例。符合以下标准:①月经周期规则,经量中等;②术中及术后病理证实无子宫内膜异位症、子宫腺肌病、子宫肌瘤、宫内节育器、不明原因的不孕症及能分泌激素的卵巢肿瘤等可能影响观察指标的疾病;③诊刮排除子宫内膜病变;④至少 6个月内未服用甾体类激素(包括避孕及流产药物)。2组年龄统计学上无显著差异(t=1.084,P=0.282)。
1.2 方法
标本离体后经 10%福尔马林固定,石蜡包埋,每份标本连续切片 4μm×5张,一张进行 HE染色作月经周期分期,其余做免疫组化链霉素抗生物蛋白 -过氧化物酶(SP)法染色,检测 EM患者和对照组子宫内膜组织中 ER、PR、Bcl-2、Bax的表达情况。一抗工作液均为 1:50浓度。阴性对照以磷酸缓冲液(PBS)代替一抗。阳性对照采用乳腺癌组织切片。以上试剂盒均购自北京中杉金桥生物技术有限公司。
SP染色具体步骤:石蜡切片脱腊和水化后,用PBS(pH 7.4)冲洗 3次,每次 3min。根据每一种抗体的要求对组织抗原进行相应的修复。每张切片加1滴 3%过氧化氢溶液,室温下孵育 15 m in,以阻断内源性过氧化物酶的活性。PBS冲洗 3次,每次 3 min。除去 PBS液,每张切片加 1滴正常山羊血清封闭抗原,室温下 15min。除去血清,每张切片加 1滴一抗,4℃过夜。PBS冲洗 3次,每次 3 min。除去 PBS液,每张切片加 1滴二抗,37℃孵育 15min。PBS冲洗 3次,每次 3 min。除去 PBS液,每张切片加 1滴链霉菌抗生物素 -过氧化物酶溶液,37℃孵育 15m in。 PBS冲洗 3次,每次 3 min。除去 PBS液,每张切片滴加 DAB显色剂,显微镜下观察 3~10min。自来水冲洗,苏木素复染。脱水、透明、封片、镜检。
1.3 结果判定
采用数码医学图像分析系统定量测定内膜细胞ER、PR、Bcl-2、Bax的表达情况,免疫组化切片经 2名有经验的病理科医师采用双盲法观察,每名观察者选择染色均匀的区域,以切片中细胞着棕黄、棕褐色为阳性细胞(图 1~12),每张切片在高倍(×400)光镜下随机选取 5个视野,测出每个视野阳性细胞的平均光密度(OD)值,光密度值与 ER、PR、Bcl-2、Bax表达量成正比。
1.4 统计学处理
用 SPSS11.5软件包进行统计学处理,计量资料以均数 ±标准差±s)表示,采用 t检验,P<0.05为差异有显著性。相关性分析采用直线相关。
2 结果
2.1 增殖期 ER、PR、Bcl-2和 Bax表达情况(光密度值)的比较(表1)
增殖期 ER表达:EM患者在位内膜高于异位内膜(P<0.05),异位内膜高于正常内膜(P<0.05);增殖期 PR表达:EM患者在位内膜高于异位内膜(P<0.05),异位内膜低于正常内膜(P<0.05);增殖期 Bcl-2表达:EM患者在位内膜高于异位内膜(P<0.05),异位内膜高于正常内膜(P<0.05);增殖期 Bax表达:EM患者异位内膜低于正常内膜(P<0.05)。增殖期 Bax表达,在位内膜与异位内膜差异无统计学意义(P>0.05)。
表1 增殖期 ER、PR、Bcl-2、Bax表达情况的比较(OD值)±s)
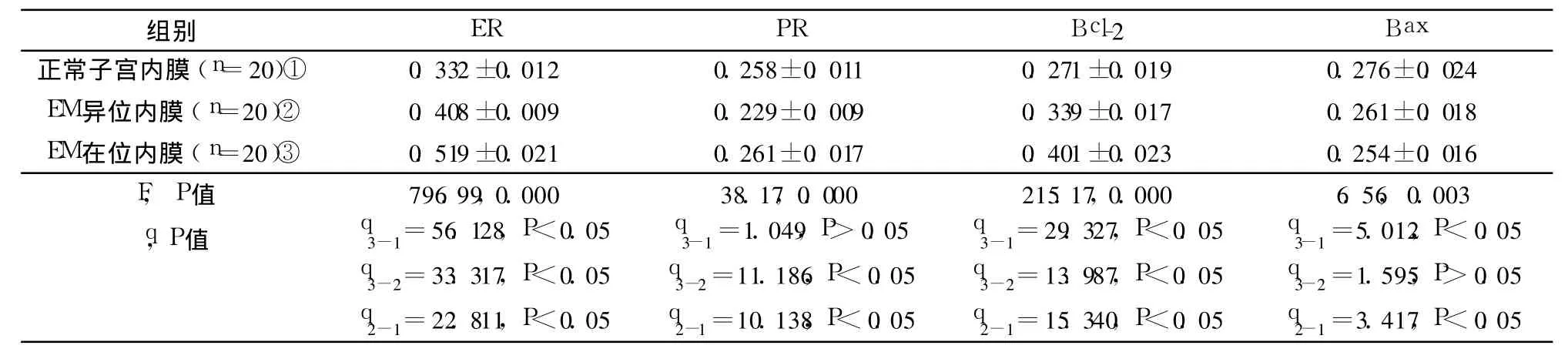
表1 增殖期 ER、PR、Bcl-2、Bax表达情况的比较(OD值)±s)
组别 ER PR Bcl-2 Bax正常子宫内膜(n=20)① 0.332±0.012 0.258±0.011 0.271±0.019 0.276±0.024 EM异位内膜(n=20)② 0.408±0.009 0.229±0.009 0.339±0.017 0.261±0.018 EM在位内膜(n=20)③ 0.519±0.021 0.261±0.017 0.401±0.023 0.254±0.016 F,P值 796.99,0.000 38.17,0.000 215.17,0.000 6.56,0.003 q,P值 q3-1=56.128,P<0.05 q3-2=33.317,P<0.05 q2-1=22.811,P<0.05 q3-1=1.049,P>0.05 q3-2=11.186,P<0.05 q2-1=10.138,P<0.05 q3-1=29.327,P<0.05 q3-2=13.987,P<0.05 q2-1=15.340,P<0.05 q3-1=5.012,P<0.05 q3-2=1.595,P>0.05 q2-1=3.417,P<0.05
2.2 分泌期 ER、PR、Bcl-2和 Bax表达情况(光密度值)的比较(表2)
分泌期 ER表达:EM患者在位内膜高于异位内膜(P<0.05),异位内膜高于正常内膜(P<0.05);分泌期 PR表达:EM患者在位内膜高于异位内膜(P<0.05),正常内膜与异位内膜 PR表达差异无统计学意义(P>0.05);分泌期 Bcl-2表达:EM患者在位内膜高于异位内膜(P<0.05),异位内膜高于正常内膜(P<0.05);分泌期 Bax表达:EM患者异位内膜低于正常内膜(P<0.05),在位内膜与异位内膜差异无统计学意义(P>0.05)。
表2 分泌期 ER、PR、Bcl-2、Bax表达情况的比较(OD值)±s)
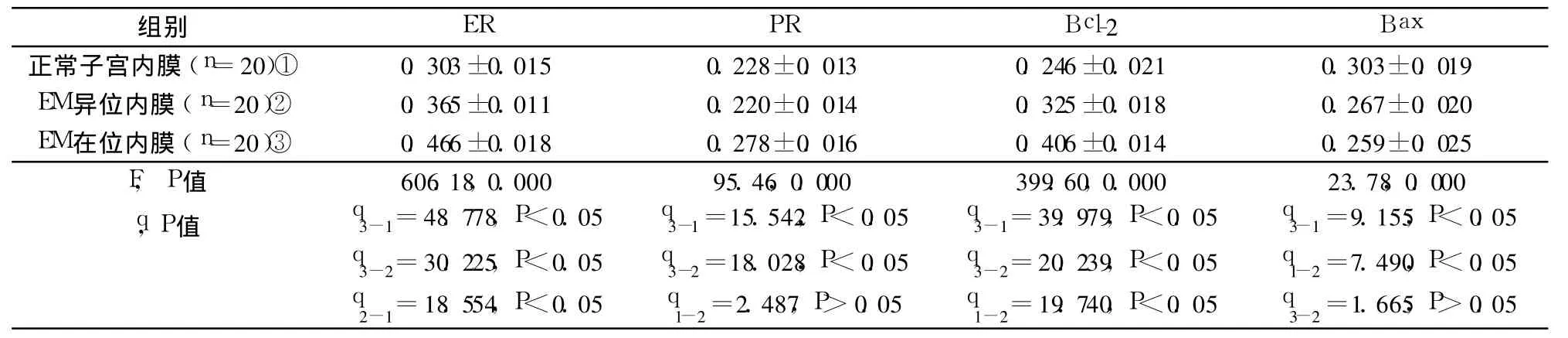
表2 分泌期 ER、PR、Bcl-2、Bax表达情况的比较(OD值)±s)
组别 ER PR Bcl-2 Bax正常子宫内膜(n=20)① 0.303±0.015 0.228±0.013 0.246±0.021 0.303±0.019 EM异位内膜(n=20)② 0.365±0.011 0.220±0.014 0.325±0.018 0.267±0.020 EM在位内膜(n=20)③ 0.466±0.018 0.278±0.016 0.406±0.014 0.259±0.025 F,P值 606.18,0.000 95.46,0.000 399.60,0.000 23.78,0.000 q,P值 q3-1=48.778,P<0.05 q3-2=30.225,P<0.05 q2-1=18.554,P<0.05 q3-1=15.542,P<0.05 q3-2=18.028,P<0.05 q1-2=2.487,P>0.05 q3-1=39.979,P<0.05 q3-2=20.239,P<0.05 q1-2=19.740,P<0.05 q3-1=9.155,P<0.05 q1-2=7.490,P<0.05 q3-2=1.665,P>0.05
2.3 相关性分析
EM患者异位内膜及在位内膜 ER与 PR表达无相关性,EM患者异位内膜 ER与 Bax、PR与 Bax表达无相关性。虽然 ER、PR与 Bcl-2在 EM患者在位内膜表达均增强,但 EM患者异位内膜 ER与 Bcl-2、PR与 Bcl-2表达无相关性,EM患者在位内膜 ER与 Bax、PR与 Bax表达无相关性 (r=-0.031、0.281,P=0.891、0.729)。见表3,4。

表3 EM患者异位内膜细胞 ER、PR、Bcl-2、Bax相关性

表4 EM患者在位内膜细胞 ER、PR、Bcl-2、Bax相关性
3 讨论
EM在生育年龄妇女发病率为 10%~15%[3],在妇科疾病中,其发病率仅次于子宫肌瘤[4]。EM是激素依赖性疾病,虽为良性病变,却具有类似恶性肿瘤远处转移和种植生长的能力。自 1860年 Von Rokitansky在 1具尸体检查中首次发现该病以来已经有 140余年的历史,但由于人们对其发病机制尚未清楚,治疗结果一直不理想。探讨内异症发病机制一直是妇科领域研究的热点。
甾体类激素通过核内受体蛋白发挥生物学作用,其生物学效应受配基和受体水平影响。当受体与激素结合形成复合物后,以活化的形式结合到染色质特定部位,继发新的蛋白质形成,进而调节细胞的生长、代谢。正常子宫内膜组织中 ER与 PR存在一定的正相关关系,PR随 ER的上升而增加,PR的合成依赖于 ER的合成通路[5]。本研究提示 EM患者无论是增殖期还是分泌期,在位内膜 ER、PR表达均高于异位内膜(P<0.05),并且 ER在异位内膜的表达高于正常内膜(P<0.05),这种改变既减轻了体内性激素周期性波动对在位子宫内膜细胞生长的影响,又提高了在位子宫内膜细胞在分泌期对 E2的敏感性,使在位子宫内膜细胞持续低水平增殖。提示 EM的发生可能与 ER在在位内膜的高表达有关,支持“在位内膜决定论”[6],同时也印证了 EM是一种雌激素依赖性疾病。
Bcl-2被称为“凋亡抑制基因”。Bcl-2过度表达可通过抑制程序性细胞死亡来阻碍或延迟正常细胞的分化,从而延长细胞的寿命。Bax是促凋亡基因,可以自身形成同源二聚体诱导凋亡。正常子宫内膜Bcl-2与 Bax表达具有一定周期性,Bcl-2表达增殖期高于分泌期、Bax表达分泌期高于增殖期[7~9],说明雌孕激素可能通过调节细胞凋亡与增殖来维持子宫内膜的正常生理功能。本研究提示 EM患者无论是在位内膜还是异位内膜均表现为 Bcl-2表达较正常内膜增强(P<0.05),而 Bax表达减弱,Bcl-2/Bax比值上升。Bcl-2和 Bax的表达均与子宫内膜周期性改变无关,不受卵巢激素调节,细胞凋亡持续性减弱,增殖性能持续性增强。无论是增殖期还是分泌期 EM患者在位内膜 Bcl-2表达均高于异位内膜(P<0.05),说明在位内膜比异位内膜细胞凋亡更弱、增殖性能更强,可能这样的内膜异位于盆腹腔或腹壁切口,导致了 EM的发生,支持“在位内膜决定论”。同时也提示提示内膜细胞抗凋亡能力明显增强,破坏了细胞增殖和凋亡的平衡,使异位内膜细胞的凋亡率下降,细胞周期延长;异位灶得以不断发展,与 Ding等[10]的结论相似。可见子宫内膜异位灶 Bcl-2和 Bax表达异常可能参与了 EM子宫内膜凋亡特性的改变,并对 EM的发生和发展起到一定的作用。
Lessby等[11]研究正常子宫内膜腺细胞 Bcl-2和雌、孕激素受体的周期性表达,结果显示三者表达一致,三者具有正相关关系。EM患者内膜细胞中 ER、PR、Bcl-2、Bax表达是否具有相关性,本课题希望以此为切入点,探讨雌孕激素受体在 EM患者内膜细胞的细胞凋亡与增殖活动的调控作用,将 EM的发病机制深入到调控基因水平。本研究结果提示,EM患者在位及异位内膜 ER、PR表达不同步;虽然 ER、PR与Bcl-2在 EM患者在位内膜表达均增强,但两者不具有相关性(两两相关 P值均 >0.05)。通过本研究还不能说明雌孕激素受体在 EM细胞凋亡与增殖活动中具有调控作用。也有研究认为 ERβ与 Bcl-2的基因表达呈相关性,提示雌激素通过 β受体亚型途径介导 Bcl-2的表达[12]。本研究结果未显示 ER、PR与Bcl-2、Bax之间有相关关系,可能与本研究检测的是传统的 ERα和 PR-A亚型有关。
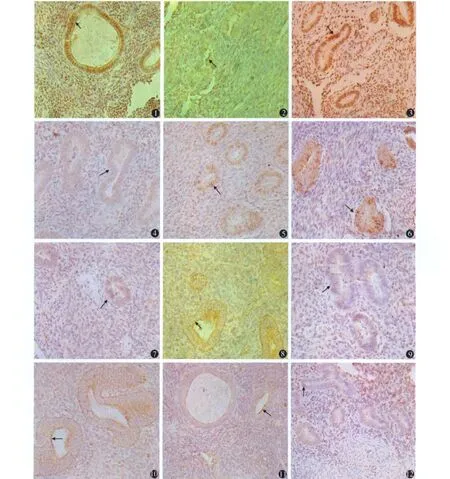
图 1 内异症在位内膜ER阳性表达(免疫组化 SP染色 ×400) 图 2 内异症异位内膜 ER阳性表达(免疫组化 SP染色 ×400) 图 3 正常子宫内膜 ER阳性表达(免疫组化SP染色 ×400) 图4 内异症在位内膜PR阳性表达(免疫组化SP染色 ×400) 图 5 内异症异位内膜 PR阳性表达(免疫组化 SP染色 ×400) 图 6正常子宫内膜 PR阳性表达(免疫组化SP染色 ×400) 图 7 内异症在位内膜Bc l-2阳性表达(免疫组化SP染色 ×400) 图 8 内异症异位内膜 Bcl-2阳性表达(免疫组化 SP染色 ×400) 图 9 正常子宫内膜 Bc l-2阳性表达(免疫组化SP染色 ×400) 图 10 内异症在位内膜 Bax阳性表达(免疫组化 SP染色 ×400) 图 11内异症异位内膜 Bax阳性表达(免疫组化 SP染色 ×400) 图 12 正常子宫内膜 Bax阳性表达(免疫组化 SP染色 ×400)
1 Mclaren J.Immunolocalization of the apoptosis regulating proteins Bcl-2 and Bax in human endometrium and isolated peritoneal fluid macrophages in endometriosis.Hum Reprod,1997,12(1):146-152.
2 Beliard A,Noel A,Foidart JM.Reduction of apoptosis and proliferation in endometriosis.Fertil Steril,2004,82(1):80-85.
3 Story L,Kennedy S.Animal studies in endometriosis:a review.ILAR J,2004,45:132-138.
4 Gianetto-Berrutti A,Feyles V.Endometriosis related to infertility.Minerva Ginecol,2003,55:407-416.
5 夏雅仙,周馥贞.子宫内膜受体研究的再探讨.国外医学·计划生育分册,1995,14∶14-17.
6 郎景和,主编.子宫内膜异位症的基础与临床研究.北京:中国协和医科大学出版社,2003.35-50.
7 Mertens HJ,Heineman MJ,Evers JL.The expression of apoptosis related proteins Bcl-2 and Ki67 in endometrium of ovulatory menstual cycles.GynecolObstet Invest,2002,53(4):224-230.
8 Vaskivuo TE,Stenback F,Karhumaa P,et al.Apoptosis and apoptosis related proteins in human endometrium.Mol Cell Endocrinol,2000,165(122):75-83.
9 Meresman GF,Bilotas MA,Lombardi E,et al.Effect of GnRH analogues on apoptosisand release of interleukin-1beta and vascular endothelial growth factor in endometrial cell cultures from patients with endometriosis.Hum Reprod,2003,18(9):1767-1771.
10 Ding J,Shen J,Brau DP,eta1.Apoptosis in endometrial glandular and stroma1 cells in women with and without endometriosis.Hum Reprod,2001,16(9):1802-1808.
11 Lessby BA,Killam AP,Metzger DA,et al.Immunohistochemical analysis of human uterine estrogen and progesterone receptors throughout the menstrual cycle.J Clin Endocrinol Metab,1988,67:334-340.
12 Dubal DB,Shughrue PJ,Wilson ME,et al.Estradiol modulates Bcl-2 in cerebral ischem ia:a potential role for estrogen receptors.Neurosci,1999,19(15):6385-6393.
