榄香烯抑制Raf/MEK/ERK信号通路诱导人源胶质瘤U87细胞凋亡
2011-06-18赵永顺吴春明位振清徐英辉
赵永顺,吴春明,董 斌,位振清,徐英辉*
胶质瘤作为最常见的恶性脑肿瘤,具有高度侵袭性,即使经手术及放化疗,平均生存期也很短[1]。榄香烯(Elemene)是从中药莪术中提取的、由我国自主开发的国家二类抗肿瘤新药,主要成分为β-榄香烯,属于不含氧的倍半烯烃类。由于其低毒、高效和广谱,被广泛用于治疗多种肿瘤[2-3]。体外研究发现,榄香烯能有效抑制胶质瘤细胞生长,具有明确的抗胶质瘤作用[4]。榄香烯抑制胶质瘤细胞增殖和诱导胶质瘤细胞凋亡是其抗胶质瘤的重要机制,并且抑制增殖作用与p38MAPK信号通路的活化密切相关[5-7],但其诱导胶质瘤细胞凋亡的机制尚未阐明。本研究旨在通过观察榄香烯对人源胶质瘤U87细胞系Raf/MEK/ERK信号通路各蛋白活性及癌基因Bcl-2家族成员表达的影响,探讨其诱导胶质瘤细胞凋亡的相关机制,为榄香烯治疗胶质瘤提供理论依据和实验基础。
1 材料和方法
1.1 材料 2%榄香烯乳剂购自大连金港制药公司;人源胶质瘤U87细胞系购自中国科学院上海细胞生物学研究所;DMEM培养基购自美国GIBCO BRL公司;Raf-1、ERK、磷酸化ERK蛋白质单克隆抗体购自美国 Cell Signaling公司;磷酸化Raf-1(Tyr340/341)、Bcl-2、Bax、β-actin 蛋白质单克隆抗体购自Santa Cruz Biotechnology公司。
1.2 方法
1.2.1 细胞培养 将人源胶质瘤U87细胞培养于含10%胎牛血清(FBS)的DMEM(Dulbecoo's modified Eagle'smedium)培养基(青霉素50 IU/mL、链霉素 50 mg/mL)中,置 37℃、5%CO2培养箱中培养至对数生长期。
1.2.2 流式细胞仪检测细胞凋亡 取对数期U87胶质瘤细胞,以5×104/mL密度接种25 cm2培养瓶,每瓶5mL。24 h后,以榄香烯(40μg/mL)分别处理 U87 细胞0(对照组)、1、3、5、7、9 d,用含榄香烯(40μg/mL)的培养液每2 d换液。分别于处理后各个时间点收集各组细胞,PBS洗2次,1000 r/min离心5min,用4℃ PBS悬浮细胞并计数,制成约1×106/mL的单细胞悬液。在振荡器上,缓慢加入2倍体积预冷-20℃的95%乙醇,充分摇匀,固定。4℃冰箱保存,2周内检测。检测当天,固定细胞用PBS洗2次,1000 r/min离心5min,加入RNase A 100 U/mL,置37℃水浴摇床30min,用10μg/mL 含 Triton X-100 的 PI染液染色,4℃避光30min。尼龙网过滤,流式细胞仪检测,根据DNA直方图中出现的亚二倍体峰(Ap峰),由CellQuest软件分析结果并计算凋亡细胞百分率(Apoptosis rate,AR)。
1.2.3 Raf-1、ERK、Bcl-2、Bax 蛋白质表达的Western blot检测 ①取对数生长期的人源U87胶质瘤细胞,以4×105/孔密度接种于6孔培养板中,培养24 h,再分别与 0、20、40、60 及 80μg/mL浓度的榄香烯共同孵育2 h。②吸掉培养液,PBS冲洗2次(在冰上操作),每孔加裂解缓冲液RIPA buffer[50mm Tris-HCl(pH 7.4),1.0%NP-40,0.25%Na-deoxycholate,150mm NaCl,1mm EDTA,1mm aprotinin,1 mg/mL PMSF,leupeptin and pepstatin]100μL,刮除细胞后混匀 30min,离心,取上清,分光光度计检测浓度,加入上样缓冲液调至相同终浓度,94℃煮5min。③配制10%SDS聚丙烯酰胺凝胶,上样,60 V电泳1 h,然后调至100 V继续电泳,直至溴酚蓝稍跑出,将蛋白从SDS聚丙烯酰胺凝胶转至PVDF膜上。④加一抗,4℃过夜。加二抗,室温1 h。⑤ECL(Amersham)检测,图像定量分析软件(ImageQuant 5.2 software,Amersham)分析蛋白条带。
1.2.4 统计学处理 数据统计采用SPSS 10.0软件,细胞计数检测值以表示,数据差异采用方差齐性检验及单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 榄香烯呈时间依赖性诱导U87细胞凋亡流式细胞仪检测结果显示,U87细胞未经榄香烯处理时,自然凋亡率很低。经40μg/mL榄香烯处理0(对照组)、1、3、5、7、9 d 后,呈时间依赖性诱发凋亡。DNA含量直方图可见,G0/G1峰前出现明显的亚二倍体峰(Ap峰),与对照组细胞相比,差异有统计学意义(P<0.05)。见图1、图2。
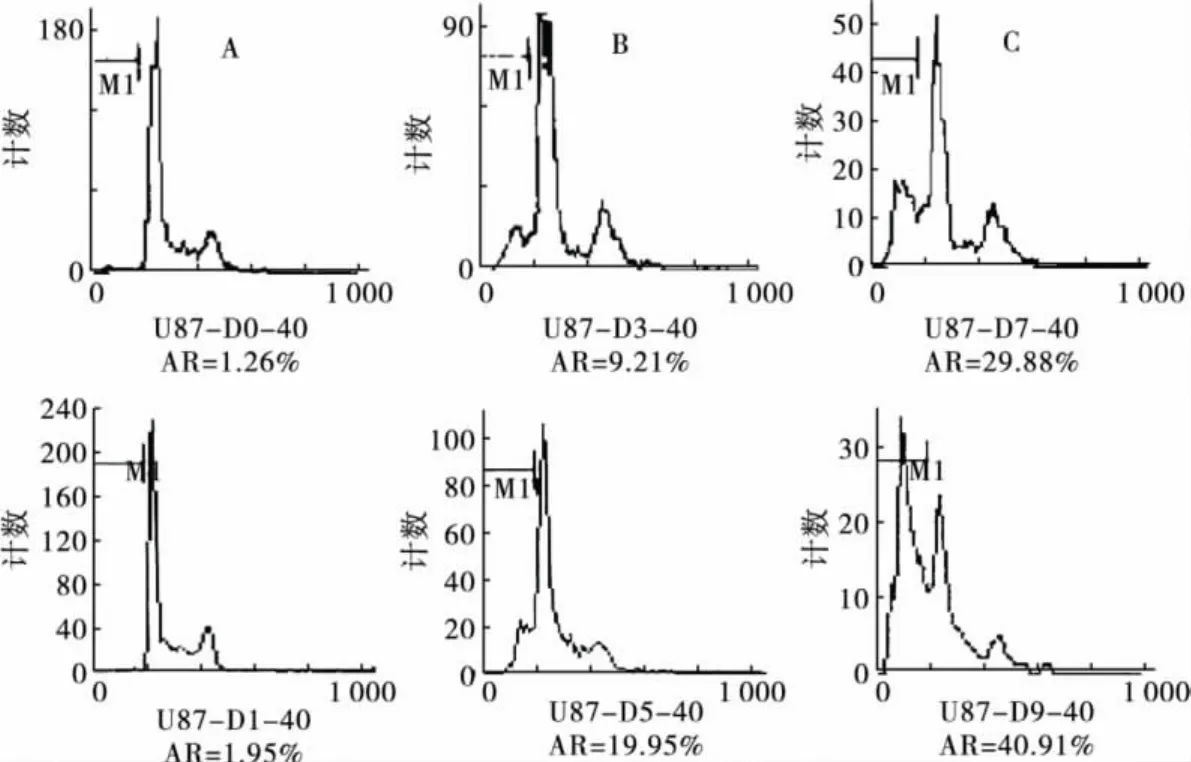
图1 榄香烯诱导U87胶质瘤细胞凋亡的DNA含量直方图
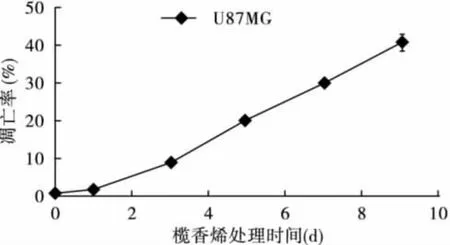
图2 榄香烯对U87胶质瘤细胞的凋亡诱导
2.2 榄香烯抑制U87胶质瘤细胞Raf/MEK/ERK 信号通路 20、40、60、80μg/mL 榄香烯分别处理U87细胞2 h后,磷酸化的ERK和Raf-1蛋白表达呈现渐进性降低,均低于对照组,但非磷酸化的ERK和Raf-1蛋白无明显改变,见图3。
2.3 榄香烯使U87瘤细胞的Bax/Bcl-2比值增高20、40、60、80μg/mL 榄香烯分别处理 U87 细胞48 h后,Bcl-2表达呈现渐进性降低,均低于对照组,但Bax表达无明显改变,见图4。

图3 榄香烯下调U87细胞磷酸化Raf-1和磷酸化ERK蛋白表达水平

图4 榄香烯下调U87细胞Bcl-2蛋白表达水平,使Bax/Bcl-2比值增加
3 讨论
丝裂原活化蛋白激酶(Mitogen-activated protein kinase,MAPK)是细胞内的一类丝氨酸/苏氨酸蛋白激酶,普遍存在于多种生物(包括酵母和哺乳动物细胞),参与介导生长、发育、分裂、分化、死亡以及细胞间功能同步等多种细胞过程[8]。MAPK信号通路主要包括:Extracellular signal-regulated kinases(ERK1/2)、Jun N-terminal kinases(JNK)及 p38MAPK 通路[9]。其中 ERK1/2信号通路(即Raf/MEK/ERK信号通路)调控细胞生长和分化,是将胞外的生长和神经营养信号传到核内的蛋白激酶级联反应中的重要组分[10-11]。而ERK1/2蛋白的下游底物有很多,包括癌基因Bcl-2。
Lyustikman等[12]报道,多数人类胶质瘤中存在Ras蛋白的活性增高,引起其下游Raf/MEK/ERK信号通路的激活。而该通路的持续激活可以导致癌基因(如Bcl-2)的表达上调,最终肿瘤细胞得以“永生”。本研究表明,对照组(榄香烯浓度为0)的p-Raf-1及p-ERK含量最高,说明对照组的Raf-1及ERK蛋白活性最高。推测对照组的Raf/MEK/ERK信号通路的活性最高,具有组成性激活的特征。
线粒体凋亡途径是细胞的重要凋亡途径,该凋亡途径利用线粒体作为核心成分,激活细胞凋亡。Bcl-2家族成员是调控线粒体介导的凋亡过程中的关键调节因子。Bcl-2家族包括促凋亡蛋白(包括 Bax、Bak等)和抗凋亡蛋白(Bcl-2、Bcl-XL、Mcl-1 等)[13]。细胞内 Bcl-2 家族成员中的Bax/Bcl-2的比值增加能诱导线粒体释放细胞色素c(cyt-c),线粒体内的cyt-c释放入细胞质后,与凋亡蛋白激活因子-1(Apaf-1)和Caspase-9的前体组合,形成凋亡小体,导致Caspase-9自身剪切和活化,活化的Caspase-9再酶解Caspase-3前体,从而活化Caspase-3,活化的Caspase-3剪切inhibitor ofcaspase-3-activated Dnase(ICAD),于 是Caspase-3-activated DNase(CAD)被激活,剪切DNA,最终诱导细胞凋亡[14]。本研究结果表明,榄香烯可以使U87细胞的Bax/BcL-2比值增加,启动细胞线粒体凋亡,最终使U87细胞凋亡;从而从侧面验证了Lyustikman等的结论。因此,Raf/MEK/ERK通路的组成性激活对于U87细胞的生存至关重要。
综上所述,本研究证实:①榄香烯呈时间依赖性诱导U87细胞凋亡。②榄香烯呈剂量依赖性地下调人源胶质瘤U87细胞磷酸化的Raf-1和ERK蛋白的表达,提示榄香烯抑制U87细胞的Raf/MEK/ERK信号通路。③榄香烯下调U87细胞中Bcl-2家族成员中的Bcl-2表达,但对Bax的表达无影响;榄香烯使U87细胞Bax/Bcl-2比值增高。
由此推断,榄香烯诱导U87细胞凋亡的机制:抑制U87细胞赖以生存的Raf/MEK/ERK通路,从而下调Raf/MEK/ERK通路下游信号癌基因Bcl-2表达,增加Bax/Bcl-2比值,启动线粒体凋亡程序,最终诱导U87细胞凋亡。
[1]邱虹,韩依轩,阚志生,等.CD105、CD34在人脑胶质瘤中的表达及其临床意义[J].中国临床医学,2007,14(1):40-42.
[2]储德节,郭水根,姚冬娥.榄香烯乳联合GP方案治疗晚期非小细胞肺癌[J].中国临床医学,2010,17(4):491-494.
[3]田力,曹悦鞍,彭朝胜,等.榄香烯乳剂联合化疗治疗晚期非小细胞肺癌的临床观察[J].中国临床医学,2009,16(5):725-727.
[4]徐英辉,董斌,罗其中,等.榄香烯对大鼠胶质瘤C6细胞Bcl-2家族基因及蛋白表达的影响[J].中华医学杂志,2005,24(85):1700-1703.
[5]周洪语,侯菊生,王勇,等.榄香烯诱导神经胶质瘤细胞凋亡作用的剂量和时间依赖性研究[J].中华肿瘤杂志,2006,4(8):270-271.
[6]Yao YQ,Ding X,Xu YH,et al.Anti-tumor effect of beta-elemene in glioblastoma cells depends on p38 MAPK activation[J].Cancer Lett,2008,264(1):127-134.
[7]姚轶群,徐英辉,周洪语,等.ERK在榄香烯抑制大鼠C6胶质瘤细胞增殖中的作用[J].肿瘤,2007,27(10):777-779.
[8]俞华芳,樊晓明,蒋淼,等.P38MAPK抑制剂对小鼠急性水肿型胰腺炎的作用[J].中国临床医学,2008,15(1):82-83.
[9]贾庆哲,葛均波,梁春,等.糖基化终产物对人单核细胞源树突状细胞丝裂原激活蛋白激酶表达的影响[J].中国临床医学,2008,15(1):1-4.
[10]Qi MS,Elion EA.MAP kinase pathways[J].J Cell Sci,2005,118(16):3569-3572.
[11]赵永顺,董斌,吴春明,等.榄香烯阻碍大鼠胶质瘤C6细胞ERK信号通路中Hsp90/Raf-1分子复合体的形成[J].实用药物与临床,2011,14(4):274-276.
[12]Lyustikman Y,Momota H,Pao W,et al.Constitutive activation of Raf-1 induces glioma formation in mice[J].Neoplasia,2008,10(5):501-510.
[13]Zhang R,Banik NL,Ray SK.Combination of all-trans retinoic acid and interferon-gamma suppressed PI3K/Akt survival pathway in glioblastoma T98G cells whereas NF-kappaB survival signaling in glioblastoma U87MG cells for induction of apoptosis[J].Neurochem Res,2007,32(12):2194-2202.
[14]Parone PA,James D,Martinou JC.Mitochondria:regulating the inevitable[J].Biochimie,2002,84:105-111.
