人参皂甙Rg3对兔耳增生性瘢痕的影响
2011-03-27程丽英唐梦遥金蓉张艳孙宝珊施耀明张余光
程丽英 唐梦遥 金蓉 张艳 孙宝珊 施耀明 张余光
人参皂甙Rg3对兔耳增生性瘢痕的影响
程丽英 唐梦遥 金蓉 张艳 孙宝珊 施耀明 张余光
目的研究在创伤早期应用人参皂甙Rg3对兔耳增生性瘢痕形成的影响。方法建立12只新西兰大耳白兔的增生性瘢痕模型。将兔耳创面分为6组:空白对照组(B组),生理盐水注射组(T0组)以及治疗组(T1~T4)。T1~T4各组于术后第2天开始在兔耳创面周围皮肤皮下注射不同浓度Rg3,其中T1组1 mg/mL,T2组2 mg/mL,T3组3 mg/mL,T4组4 mg/mL;每处创面注射剂量为0.1 mL,每日1次。大体观察创面愈合时间和瘢痕增生情况。术后4周在瘢痕处取材,行HE、Masson染色,测量各组的HI指数,计算胶原纤维密度;ELISA法测定VEGF含量;检测各标本Hpr含量。结果T1~T4组HI较B组和T0组低(P<0.05),T1~T4组间HI无差异(P>0.05);T1~T4组VEGF含量较B组和T0组低(P<0.01),T1~T4组VEGF含量无差异(P>0.05);T1~T4组的胶原纤维密度低于B组和T0组(P<0.05),T1~T4组胶原纤维密度无差异(P>0.05);T1~T4组Hpr含量较B组和T0组低(P<0.05),T1~T4组Hpr含量无差异(P>0.05)。结论在增生性瘢痕形成的早期阶段,应用人参皂甙Rg3能减少瘢痕局部新生血管的生成,减少瘢痕组织中胶原的合成,从而减轻增生性瘢痕的形成。为应用人参皂甙Rg3治疗增生性瘢痕提供了理论依据。
人参皂甙Rg3增生性瘢痕血管内皮生长因子羟脯氨酸
增生性瘢痕是创伤治疗的一大难题。增生性瘢痕的产生分为3个阶段:炎症反应阶段、增生性阶段、塑形阶段[1]。其病理机制尚不明确,目前认为增生性瘢痕的产生与以下因素有关:增强的炎症反应,过多的细胞外基质的沉积,局部增强的血管化反应,减弱的细胞凋亡等[3]。增生性瘢痕的治疗方法很多,主要是对增生和塑型阶段的瘢痕进行治疗,但均不能取得满意的效果。我们尝试在增生性瘢痕形成的早期阶段对其进行干预,以预防增生性瘢痕的形成。
20-(R)人参皂甙Rg3是由人参中提取的一种单体成分,简称人参皂甙Rg3,能抑制血管内皮细胞的增殖,减弱新生毛细血管的生成,抑制血管内皮生长因子(VEGF)诱导的血管化作用等,从而能够抑制过强的血管化反应[3];另有报道认为,人参皂甙Rg3对人增生性瘢痕成纤维细胞的增殖具有明显抑制作用,并能够诱导其凋亡[4]。因此,我们推测在增生性瘢痕形成的早期,局部应用人参皂甙Rg3,可能具有预防或减弱增生性瘢痕形成的作用。本研究建立兔耳增生性瘢痕模型,观察人参皂甙Rg3早期局部注射后兔耳创面的愈合情况和瘢痕增生情况,以及瘢痕组织细胞外基质构成的变化,为临床应用人生皂甙Rg3防治瘢痕增生提供实验依据。
1 材料和方法
1.1 实验动物、主要仪器与试剂
健康清洁级新西兰大耳白兔12只(上海交通大学医学院附属第九人民医院动物中心),体质量2.5~3 Kg,兔耳健全,雌雄不限,单笼饲养;人参皂甙Rg3纯品(纯度98.63%,大连富生制药有限公司),用生理盐水配制成浓度为1 mg/mL、2 mg/mL、3 mg/ mL、4 mg/mL的混悬液,现用现配,以漩涡振荡器混匀;Tissue Protein Extraction Reagent(Thermo Scientific,美国);Protease Inhibitor cocktail setⅠ(Calbiochem,美国);BCA protein assay kit(Thermo Scientific,美国);兔VEGF定量EIA试剂盒(RapidBio,美国);酶标仪(Thermo labsystems,美国);离心机(Beckman,美国);荧光显微镜(Nikon,日本);Image-Pro-Plus图像分析软件(Media Cybernnetics,美国);羟脯氨酸测试盒(南京建成生物工程研究所)。
1.2 实验方法
1.2.1 增生性瘢痕动物模型的建立
实验兔饲养1周后,根据Morris等[5]和李荟元等[6]建立的瘢痕动物模型法,麻醉后,严格无菌操作下,分别于兔耳腹侧面近、中、远端水平的内外侧(避开可见血管)各形成1个直径1 cm的创面,每耳6个创面,间隔≥1 cm,建立兔耳增生性瘢痕模型。术中切除兔耳皮肤及软骨膜,保留耳软骨,压迫止血。术后以乙醇和生理盐水清洁创面。
1.2.2 实验分组、标本取材及处理
将12只兔子随机分为6组(n=2)。空白对照组(B组):术后不进行任何处理;生理盐水注射组为(T0组):术后第2天开始在兔耳创面周围皮下注射生理盐水;治疗组:术后第2天开始在兔耳创面周围皮下注射不同浓度人参皂甙Rg3,T1组为1 mg/mL,T2组为2 mg/mL,T3组为3 mg/mL,T4组为4 mg/mL。每处创面注射剂量为0.1mL,每日1次,持续28 d。大体观察创面愈合和瘢痕增生情况。
术后4周,切取瘢痕组织标本,每个标本分为3份,1份标本以4%中性甲醛固定,常规石蜡包埋,沿组织横切面进行切片,行HE染色及masson染色;1份标本称重,-80℃条件下保存,检测VEGF含量;1份标本称重,-80℃条件下保存,检测羟脯氨酸(Hpr)的含量。
1.3 结果检测
1.3.1 大体观察
察创面愈合情况,术后28 d,观察各组增生性瘢痕的硬度、色泽、形态。
1.3.2 镜下观察
常规HE染色:采集标本需包括瘢痕组织周边5 mm的健康皮肤,4%中性甲醛固定24 h,乙醇脱水,石蜡包埋,沿瘢痕凸起最高点纵行切片,HE染色,镜下观察,低倍显微标尺测量,计算瘢痕增生指数HI(HI是用来测量真皮层增生程度的指标)[5,7],HI=瘢痕高度(SH)/健康皮肤高度(DH)。
胶原纤维密度:标本石蜡包埋、Masson染色,胶原纤维呈绿色,每个切片随机选取5个视野,共15个视野,利用Image-ProPlus图像分析软件计算胶原纤维密度[8]。
1.3.3 瘢痕组织VEGF含量测定
将各组织标本称重,根据组织块大小加入适量的Tissue Protein Extraction Reagent和Protease Inhibitor(二者比例为100∶1),将组织块减碎后匀浆、离心(10 000 r/min,30 min),提取样本组织的总蛋白,用Bradford法测定所提样本总蛋白的浓度,双抗夹心ELISA法检测各样本中VEGF含量。步骤如下:于各反应板孔中加入100 μL相应的组织蛋白提取液,37℃温育90 min;洗板,加入100 μL 1× Biotin,37℃温育60 min;洗板,加入100 μL 1× HRP,37℃温育30 min;洗板,每孔加入50 μL显色液A和50 μL显色液B,37℃暗处温育20 min;每孔加入100 μL终止液,轻轻混匀后立刻酶标仪读取OD450值。根据标准曲线及各孔OD450值算出相应标本中VEGF浓度(VEGF在总蛋白中的浓度=相应标本中VEGF浓度/该标本的总蛋白浓度)。
1.3.4 瘢痕组织羟脯氨酸(Hpr)含量测定
将各组标本称重,经水解、调节pH值、蒸馏水稀释、加活性炭混匀离心,测定吸光度,计算羟脯氨酸的含量。
1.5 统计学处理
所得数据用SAS软件包进行单因素方差分析,以“x±s”表示。P<0.05表示差异具有显著性。
2 结果
2.1 大体观察
各组创面均愈合良好,无感染。B组、T0组和T1~T4组的创面愈合时间分别为(18.75±1.42)d、(18.67±1.23)d、(18.17±1.64)d、(18.5±1.45)d、(17.75±1.60)d、(18.25±1.42)d,各组间无显著性差异(P>0.05)。术后4周可见B组和T0组形成的增生性瘢痕最为显著,瘢痕呈圆形,中央“小丘”样凸起,色红、质硬,增生范围不超过创缘;T1~T4组与前两组比较,瘢痕增生程度较轻,色泽明显较浅,表面较平坦,质较软(图1)。
2.2 组织学变化
B组和T0组瘢痕组织真皮层明显增厚,为周边正常真皮层厚度的2~3倍,真皮层可见毛细血管、大量成纤维细胞增殖,胶原纤维多,排列紊乱,致密而粗大,可见旋涡状结构和胶原结节,结构近似增生性瘢痕组织。与B组和T0组相比,T1~T4组真皮层厚度明显较薄,成纤维细胞数量减少,胶原纤维致密度下降,胶原纤维束间有较大的空隙,排列较规则,呈多层水平向排列,新生血管、漩涡结节和胶原结节明显减少(图2)。
2.3 瘢痕组织VEGF含量
T1~T4组的VEGF含量较B组和T0组显著降低(P<0.05),B组与T0组VEGF含量无差异(P<0.05),T1~T4各组之间的VEGF含量无差异(P<0.05)(图3)。
2.4 瘢痕增生指数HI
B组、T0组、T1~T4组HI值分别为2.04±0.08、2.06±0.07、1.76±0.09、1.74±0.06、1.72±0.11和1.72±0.13,B组与T0组的差异无统计学意义(P>0.05),T1~T4组的HI指数较B组及T0组低(P<0.05),T1~T4组之间差异无统计学意义(P>0.05)。
2.5 胶原纤维密度
B组和T0组之间胶原纤维密度无显著性差异(P>0.05),T1~T4组较B组和T0组明显降低(P<0.05),T1~T4组之间胶原纤维密度无显著性差异(P>0.05)(图4)。
2.6 瘢痕组织Hpr的测定
B组与T0组之间无差异(P>0.05),T1~T4组的Hpr值均小于B组和T0组(P<0.05);T1~T4组之间无差异(P>0.05)。

图1 术后4周时兔耳增生性瘢痕大体观察Fig.1Gross observation of each group 4 weeks after operation
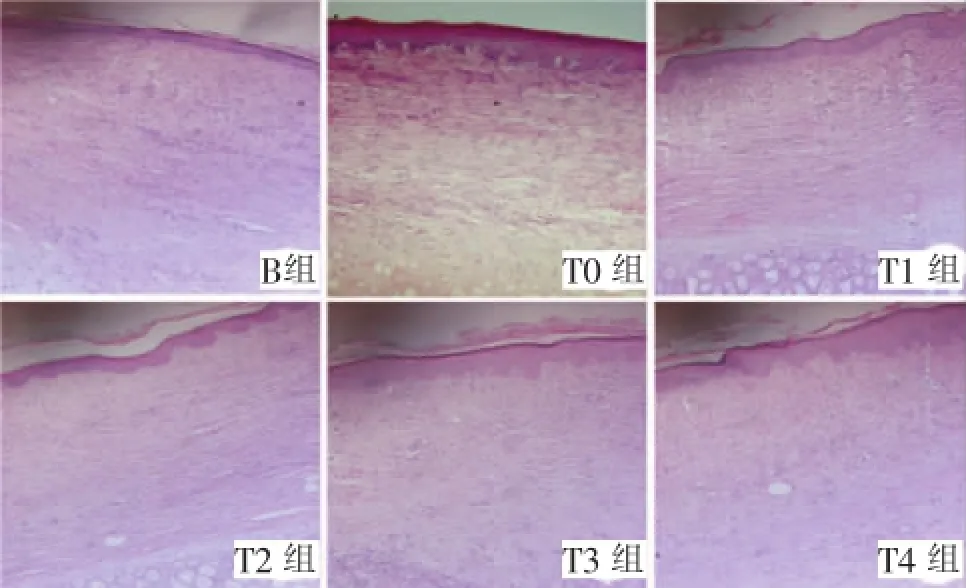
图2 组织学观察(HE,100×)Fig.2Histological observation(HE,100×)
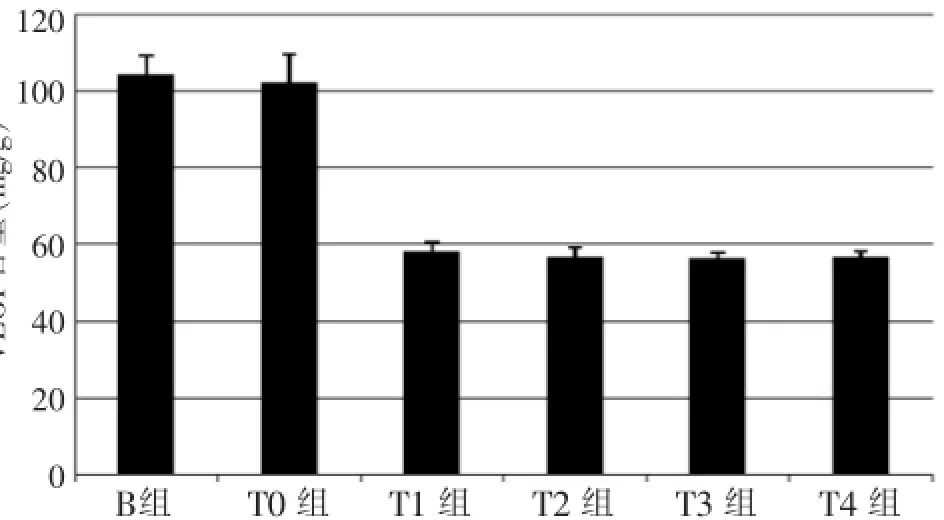
图3 术后4周各组VEGF含量比较Fig.3VEGF content of each group 4 weeks after operation

图4 组织学观察(Masson,400×)Fig.4Histological observation(Masson,400×)
3 讨论
增生性瘢痕的发生机制至今仍未明确,目前认为主要与异常的细胞反应、细胞外生长因子(PDGF、TGF-β和VEGF)的过度表达导致成纤维细胞的过度增殖、局部血管化反应的过度增强、胶原纤维合成的增加及异常沉积等有关。另外,基质金属蛋白酶(MMP)活动性的减弱导致胶原降解减弱,Ⅰ/Ⅲ型胶原蛋白的比例异常,也是增生性瘢痕形成的重要病理机制[1]。目前的治疗方法主要有类固醇激素、抗代谢药物、免疫抑制剂、放射疗法和硅胶膜、手术切除等[9],但均未达到满意的效果。
人参皂甙Rg3是从人参中提取的一种单体成分,近年来国内外学者对其进行了广泛深入的研究,发现人参皂甙Rg3能抑制血管内皮细胞的增殖、减弱新生毛细血管的生成、抑制VEGF诱导的血管化作用,从而可抑制新生血管的过度形成[3];人参皂甙Rg3还具有抗肿瘤作用,能诱导多种肿瘤细胞的凋亡[10-11],且对骨髓、心、肺、肝、肾和神经系统无毒副作用[12]。刘鹤松等[4]发现人参皂甙Rg3对人增生性瘢痕的成纤维细胞增殖有明显的抑制作用,并能够诱导其凋亡。在增生性瘢痕形成的早期阶段应用人参皂甙Rg3,可能具有预防或者减轻瘢痕形成的作用,因此我们应用兔耳增生性瘢痕模型对其进行了研究,从组织病理学、VEGF含量、胶原纤维、羟脯氨酸含量的变化等角度研究人参皂甙Rg3局部应用对增生性瘢痕的作用。
T1~T4组的创面愈合时间与B组、T0组比较,差异无统计学意义,说明局部应用人参皂甙Rg3不会延迟创面愈合。T1~T4组与B组、T0组比较,瘢痕增生程度减轻,色泽明显较浅,表面明显平坦,质较软。
HI是表示瘢痕的增生情况及治疗效果的指标[5],T1~T4组HI指数低于B组和T0组,说明在瘢痕形成早期应用人参皂甙Rg3有效减轻了增生性瘢痕的形成;镜下观察T1~T4组新生血管少于B组和T0组;T1~T4组VEGF含量显著低于B组和T0组,表明早期应用人参皂甙Rg3能抑制兔耳增生性瘢痕中新生血管的形成,从而有望抑制瘢痕形成。Hpr是合成动物胶原蛋白的特有氨基酸,检测其变化可以反映胶原合成情况。本实验结果显示,T1~T4组的Hpr含量低于B组和T0组,以T4组最低。Masson染色结果发现,T1~T4组的胶原纤维较B组和T0组的排列更整齐、更疏松,其胶原纤维密度较B组和T0组低。以上结果均表明,早期应用人参皂甙Rg3能抑制兔耳增生性瘢痕中胶原的合成,改善瘢痕组织细胞外基质构成,使其更接近正常皮肤;T1~T4组间的以上各测量指标差异无统计学意义,说明人参皂甙Rg3抑制瘢痕形成的作用,并未随浓度升高而增加,可能与人参皂甙Rg3饱和溶解度较低有关。
本实验结果初步显示在兔耳瘢痕形成的早期阶段局部应用人参皂甙Rg3,可以减轻增生性瘢痕的形成,推测其可能通过以下途径抑制瘢痕增生:①抑制VEGF诱导的局部新生血管的形成,抑制过强的血管化反应;②直接抑制瘢痕成纤维细胞的生长增殖或诱导其凋亡,从而抑制成纤维细胞增殖,减少胶原的合成和分泌。两者中以抑制VEGF诱导的局部新生血管形成为主要作用机制。
本实验结果仅是一个初步的探索,人参皂甙Rg3真正应用于临床,尚需在剂量、给药途径等多方面进行更为深入的研究。
[1]Wolfram D,Tzankov A,Pülzl P,et al.Hypertrophic scars and keloids -a review of their pathophysiology,risk factors,and therapeutic management[J].Dermatol Surg,2009,35(2):171-181.
[2]Van der Veer WM,Bloemen MC,Ulrich MM,et al.Potential cellular and molecular causes of hypertrophic scar formation[J]. Burns,2009,35(1):15-29.
[3]Yue PY,Wong DY,Wu PK,et al.The angiosuppressive effects of 20(R)-ginsenoside Rg3[J].Biochem Pharmacol,2006,72(4):437-445.
[4]刘鹤松,赵自然,兰珊珊,等.人参皂苷Rg3对人成纤维细胞增殖和凋亡影响的实验研究[J].中国实验诊断学,2010,14(11):1697-1700.
[5]Morris DE,Wu L,Zhao LL,et al.Acute and chronic animal models for excessive dermal scarring:quantitative studies[J].Plast Reconstr Surg,1997,100(3):674-681.
[6]李荟元,刘建波,夏炜,等.建立增生性瘢痕动物实验模型的建立与应用[J].第四军医大学学报,1998,19(6):655-657.
[7]Tandara AA,Mustoe TA.The role of the epidermis in the control of scarring:evidence for mechanism of action for silicone gel[J]. Plast Reconstr Aesthet Surg,2008,61(10):1219-1225.
[8]De Carvalho Pde T,da Silva IS,Reis FA,et al.In?uence of ingaalp laser(660 nm)on the healing of skin wounds in diabetic rats[J]. Acta Cir Bras,2010,25(1):71-79.
[9]Kelemen O,Kolla L.Current methods of treatment and prevention of pathologic scars[J].Magy Seb,2007,60(2):63-70.
[10]Xu TM,Xin Y,Cui MH,et al.Inhibitory effect of ginsenoside Rg3 combined with cyclophosphamide on growth and angiogenesis of ovarian cancer[J].Chin Med J(Engl),2007,120(7):584-588.
[11]Shinkai K,Akedo H,Mukai M,et al.Inhibition of in vitro tumor cell invasion by ginsenoside Rg3[J].Cancer Res,1996,87(4):357-362.
[12]许天敏,崔满华,谷丽萍,等.人参皂苷Rg3对卵巢癌生长抑制作用的实验研究[J].中国实用妇科与产科杂志,2007,23(2):108.
Effets of Ginsenoside Rg3 on the Hypertrophic Scar of Rabbit Ears
CHENG Liying,TANG Mengyao,JIN Rong, ZHANG Yan,SUN Baoshan,SHI Yaoming,ZHANG Yuguang.Department of Plastic and Reconstructive Surgery,Shanghai Ninth People′s Hospital,Shanghai Jiaotong University School of Medicine,Shanghai 200011,China.Corresponding author: ZHANG Yuguang(E-mail:zhangyg16@126.com).
ObjectiveTo investigate the effets of Ginsenoside Rg3 on the hypertrophic scar of rabbit ears in the early phase of scarring.MethodsThe rabbit ear model was established on the 12 New Zealand white rabbits.The rabbits were divided into 6 groups(n=2):group B(control group),group T0(only NS),group T1(GS-Rg3 1 mg/mL),group T2(GSRg3 2 mg/mL),group T3(GS-Rg3 3 mg/mL),group T4(GS-Rg3 4 mg/mL).0.1 mL GS-Rg3 with different concentration were injected at wound in each group from 1 day after operation.The wounds healing times and hypertrophic scar were observed.Scar samples were harvested 28 days after operation.The calculation of HI index and collagen density by HE, Masson staining,VEGF content was detected by ELISA and Hpr content was also detected.ResultsThe expression of VEGF,HI index,collagen density and the Hpr content were significantly lower in group T1-T4 compared with group B and group T0(P<0.05).There were no significantly differences between group T1-T4.ConclusionTopical injection of ginsenoside Rg3 in the early phase of trauma can inhibit the activity of angiogenesis and the formation of collagen in a rabbit ear model,thus reduced hypertrophic scar formation.The findings of this study may have clinical implications on the management of human hypertryphic scars.
Ginsenoside Rg3;Hypertrophic scar;VEGF;Hpr
R619+.6
A
1673-0364(2011)02-0096-04
2011年1月22日;
2011年3月15日)
10.3969/j.issn.1673-0364.2011.02.009
200011上海市上海交通大学医学院附属第九人民医院整复外科。
张余光(E-mail:zhangyg16@126.com)。
