成人慢性ITP患者外周血NKT细胞的检测
2011-06-13王菊梅郑昭璟马拥军胡英萍徐瑞龙
王菊梅,郑昭璟,马拥军,胡英萍,徐瑞龙,3
(1.衢化医院 检验科,浙江 衢州 324004;2.金华市中心医院 检验科,浙江 金华 321000;3.温州医学院 检验医学院,浙江 温州 325035)
特发性血小板减少性紫癜(idiopathic thrombocytopenic purpura,ITP)是一种以1型T细胞反应为主的自身免疫性疾病,以外周血血小板(PLT)计数持续减少为特征。ITP患者体内存在活化的PLT抗原特异性自身反应性T细胞,能识别自体PLT抗原并诱导B细胞产生自身抗体,与PLT结合从而导致网状内皮细胞系统(reticular-endot-helial system,RES),尤其是脾脏破坏PLT是PLT减少的主要原因[1-3]。
自然杀伤T(natural killer T,NKT)细胞是机体内存在的一类具有免疫调节功能的T细胞亚群,以表达恒定的T细胞受体(T-cell receptor,TCR)Vα24链和Vβ11链为特征[4]。NKT细胞数量和功能的变化与多种人类自身免疫性疾病的发病有关,但相关机制仍未充分阐明[5]。本研究对慢性ITP患者外周血NKT数量进行分析,初步探讨其在成人慢性ITP中的意义。
1 资料和方法
1.1 研究对象 本研究共收集金华市中心医院慢性ITP患者68例,选取年龄、性别匹配的同期健康体检者38例作为对照组(见表1)。慢性ITP的诊断标准参见文献[6],即PLT数<50×109/L并持续6个月以上;骨髓巨核细胞数量正常或增多,无任何病态造血形态学表现;除外任何继发的免疫性或非免疫性可以引起PLT减少的其他疾病。所有患者和健康志愿者在标本采集前2周内均未进行激素治疗或其他可以影响PLT代谢的药物。所有慢性ITP患者均处于活动期。临床上一般将PLT计数小于20×109/L作为预防性PLT输注以降低临床出血风险的标准。因此,我们根据患者PLT计数的多少,将慢性ITP患者按照PLT计数分为两组:即PLT<20×109/L组(30例)和>20×109/L组(38例),以研究调节性T细胞在慢性ITP发病中可能发生的作用。

表1 慢性ITP患者与健康对照组一般资料比较
1.2 仪器和试剂 流式细胞仪为Beckman-Coulter Epics XL,流式试剂:CD3-PE-Cy5、Flow-check、IgG1-FITC、IgG2a-PE、Vα24-FITC、Vβ11-PE(Beckman-Coulter,USA);血细胞分析仪为Sysmex XE-2100及配套试剂;Lympho-Prep密度梯度分离液(Cat#1114545,Axis-Schield,Norway)。
1.3 外周血单个核细胞的分离 慢性ITP组和健康对照组均静脉穿刺采集EDTA-K2抗凝血6 mL以等量0.9%氯化钠溶液稀释后置于6 mL Lympho-Prep密度梯度分离液置水平离心机以离力(RCF)约800 g室温离心20 min;以毛细滴管吸取介于分离液和血浆层之间的单个核细胞转移至另外一根试管内,加入等量0.9%氯化钠溶液300 g室温继续离心10 min,去上清,以pH 7.4磷酸盐缓冲液(PBS)洗涤细胞,重复3次;最后以pH 7.4 PBS重悬细胞并调节细胞浓度为5×106/mL(PBMNC)待用。
1.4 TCRvα24+vβ11+NKT的检测 采用三色流式细胞术(FCM)进行NKT细胞的检测。取两根12 mm×75 mm流式试管分别标记同型对照和测试管;吸取10μL CD3-PE-Cy5至试管底部,在同型对照管中加入IgG1-FITC(PN IM0639U)和IgG2a-PE(PN A09141)各20μL,在测试管中加入Vα24-FITC(PN IM1589)和Vβ11-PE(PN IM2290)各20μL;每管中均加入100μL的PBMNC,漩涡振荡混匀后避光、室温孵育15 min;每管中加入pH 7.4 PBS 2 mL混匀;置水平离心机350 g室温离心5 min;弃上清,加0.5 mL PBS重悬细胞、待测。见图1-2。
应用Flow-check进行光路和流路校正以确保仪器正常运行。利用ADC Expo32软件进行数据获取和分析。以SSC/FSC结合SSC/CD3设门圈定CD3+细胞分析其中Vα24+Vβ11+占CD3+的百分比即为NKT细胞的水平。每个测试至少检测100000个CD3+细胞。
1.5 统计学处理方法 采用SPSS 16.0和GraphPad Prism 4.0软件进行数据的统计分析。两组比较采用独立样本t检验;多组比较采用单因素方差分析(One-way ANOVA),方差齐性两两比较采用LSD法,方差不齐两两比较采用Donnett T3法;非参数检验采用Pearson卡方;相关分析采用线性回归法完成。
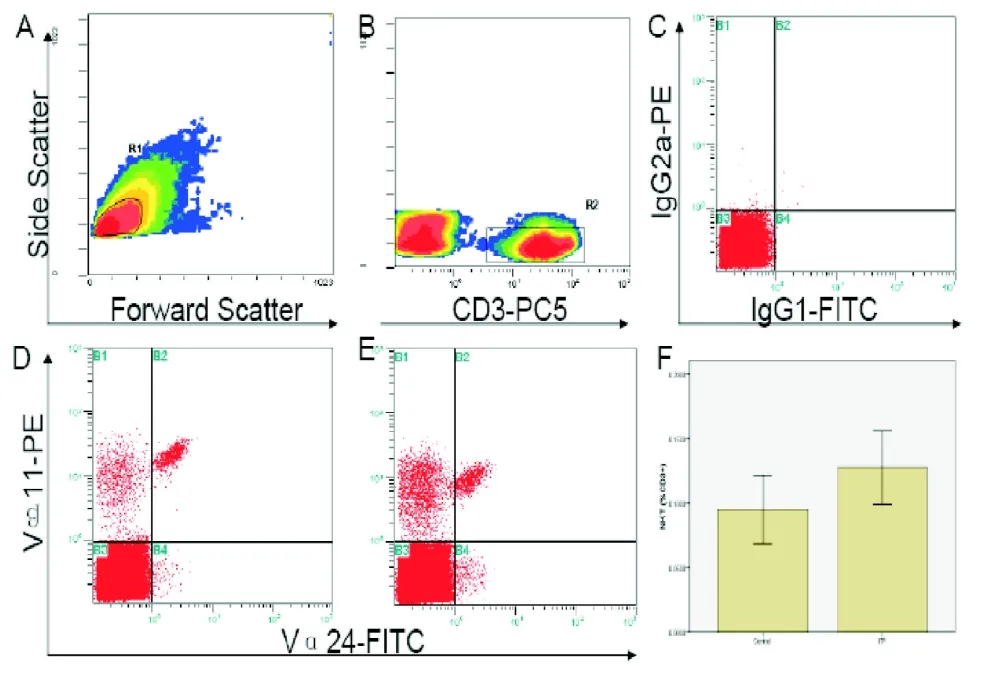
图1 流式细胞术分析成人慢性ITP和健康对照组PBMNCs中的NKT细胞。分别以前向(FSC)/侧向(SSC)光散射信号(A)和SSC/CD3(B)设门分析CD3+细胞TCRVα24和TCRVβ11的表达。以同型对照设定CD3+细胞表达TCRVα24和TCRVβ11的阈值(C)。成人慢性ITP患者(D)和健康对照组(E)PBMNCs中NKT细胞的数量以NKT细胞(CD3+Vα24+Vβ11+)占 CD3+的百分比表示并进行比较(F)。
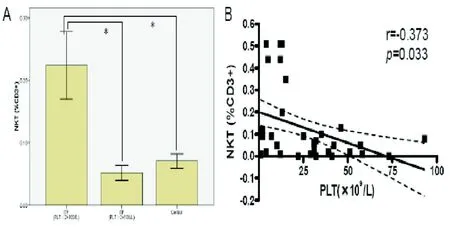
图2 PLT计数<20×109/L、>20×109/L的慢性成人ITP患者及健康对照组外周血NKT细胞数量的比较(A);慢性成人ITP患者外周血NKT细胞数量与PLT计数的线性回归分析曲线(实线)和95%可信区间(点状线),r=-0.373;P=0.033(B)。
2 结果
2.1 ITP患者和健康对照外周血NKT细胞水平 慢性ITP组PBMNCs中NKT细胞的比例为0.13%±0.03%,高于对照组的0.07%±0.01%,但差异无统计学意义(P>0.05)(见图1)。但PLT计数<20×109/L的慢性ITP患者组NKT为0.22%±0.05%,显著高于健康对照组的0.07%±0.01%(P<0.05)和PLT计数>20×109/L的慢性ITP患者组的0.05%±0.01%(P<0.05),而后两组间NKT细胞水平的差异无统计学意义(P>0.05)。
2.2 ITP患者外周血NKT细胞与PLT计数的关系 慢性ITP和对照组间NKT细胞的分布差异无统计学意义,但PLT计数<20×109/L的慢性ITP组中NKT细胞水平显著高于另外两组。慢性ITP组外周血NKT细胞水平与血小板计数间的关系的直线回归分析结果:慢性ITP患者外周血PLT计数与NKT细胞水平间存在负相关,相关系数r=-0.373,P=0.033(见图 2)。
3 讨论
ITP的发病机制是因机体失去对自身PLT抗原的外周耐受,自体免疫细胞识别自身PLT抗原、产生自身反应性T细胞和自身抗体,从而导致PLT的异常破坏,外周血PLT计数持续减少。目前认为NKT和Tregs细胞是机体维持外周耐受最为重要的两种免疫调节细胞。Johansson等[7]发现ITP患者外周血NKT细胞的增殖潜力比健康对照组显著减低、NKT细胞减少,而且这种增殖潜力的降低在激素治疗后变得更加显著,因此推测NKT细胞在ITP发病机制中发挥作用。活化的NKT细胞能通过IL-2依赖机制调节Tregs细胞的功能,而Tregs细胞能通过细胞接触依赖机制抑制NKT细胞的增殖、细胞因子分泌和细胞毒活性[8]。Johannson等[9]在1例女性ITP患者中发现外周血中出现NKT细胞的显著增高,并且这种增加的NKT细胞能够抑制自体CD4+细胞的体外增殖活性,推测NKT细胞在ITP患者中具有保护作用。他们的这一观点得到Ho等[10]结果的支持。Ho等发现活化的NKT细胞抑制CD8+细胞的体外增殖,并且发现CD8+NKT细胞通过杀伤抗原提呈细胞的机制限制T细胞的活化。本研究发现:与对照组比较,ITP患者外周血NKT细胞数量较高但差异无统计学意义。进一步分析得知,ITP患者外周血NKT细胞数量依PLT数量减少程度的不同而有显著差异,即PLT数量<20×109/L的慢性ITP患者组NKT细胞数量显著高于健康对照组和PLT计数>20×109/L的慢性ITP患者组的NKT数量,而后两者间的差异仍无统计学意义。本研究还发现ITP患者外周血NKT细胞与PLT间在数量上存在负相关关系(r=-0.373,P=0.033),这进一步支持NKT细胞在ITP中发挥作用的观点。
[1]Cines DB, Blanchette VS. Immune thrombocytopenic purpura[J].N Engl J Med,2002,346(13):995-1008.
[2]Yang R, Han ZC. Pathogenesis and management of chronic idiopathic thrombocytopenic purpura: an update[J].Int J Hematol,2000,71(1):18-24.
[3]Zhou B, Zhao H, Yang RC, et al. Multi-dysfunctional pathophysiology in ITP[J]. Crit Rev Oncol Hematol,2005,54(2):107-116.
[4]Kronenberg M, Gapin L. The unconventional lifestyle of NKT cells[J]. Nat Rev Immunol,2002,2(8):557-568
[5]Wilson BS, Delovitch TL. Janus-like role of regulatory iNKT cells in autoimmune disease and tumour immunity[J]. Nat Rev Immunol,2003,3(3):211-222.
[6]Zhang L, Li H, Zhao H, et al. Hepatitis C virus-related adult chronic idiopathic thrombocytopenic purpura:experience from a single Chinese center[J]. Eur J Haematol,2003,70(3):196-197.
[7]Johansson U, Macey MG, Kenny D, et al.a-Galactosylceramide-driven expansion of human natural killer T cells is inhibited by prednisolone treatment[J]. Br J Haematol, 2004,125(3):400-404
[8]Cava AL, Kaer LV, Shi FD. CD4+CD25+Tregs and NKT cells:regulators regulating regulators[J]. Trends Immunol,2006,27(7):322-327.
[9]Johansson U, Macey MG, Kenny D,et al. The role of natural killer T (NKT) cells in immune thrombocytopenia: is strong in vitro NKT cell activity related to the development of remission?[J]. Br J Haematol,2005,129(3):561-565.
[10]Ho LP, Urban BC, Jones L, et al. CD4-CD8alphaalpha subset of CD1d-restricted NKT cells controls T cell expansion[J]. J Immunol,2004,172(12):7350-7358.
[11]Jimenez MM, Guedon MJA , Martin LM, et al. Measurement of reticulated platelets by simple flow cytometry:An indirect thrombocytopoietic marker[J]. Eur J Intern Med, 2006,17(8):541-544.
