Pax-8基因敲除小鼠心脏中NR4A1基因表达上调
2011-06-13黄晓燕高瞻周希梁万前陈锡文陈通克杨德业温州医学院附属第一医院心内科温州医学院心血管生物和基因研究所浙江温州35000温州医学院实验动物中心浙江温州35035
黄晓燕,高瞻,周希,梁万前,陈锡文,陈通克,杨德业(.温州医学院附属第一医院 心内科,温州医学院 心血管生物和基因研究所,浙江 温州35000;.温州医学院 实验动物中心,浙江 温州 35035)
先天性心脏病-室间隔缺损(ventricular septum defect,VSD)是常见的心血管疾病,但我们对其致病因素及发病机制却仍知之甚少。骨形态形成蛋白受体IA(bone morphogenetic protein receptor type 1A,又名ALK3)在心脏发育及室间隔形成中发挥重要作用[1-2]。已有心脏特异性ALK3基因敲除的小鼠模型培育成功[3]。ALK3基因敲除纯合子小鼠胚胎发育皆终止于中期,并伴室间隔缺损、心内膜垫和肌小梁发育不全[4]、心肌细胞凋亡增加[5]。在ALK3基因缺失造成心脏发育异常的具体通路的实验研究中,杨德业教授的团队发现转录因子paired box gene 8(Pax-8)在ALK3基因敲除的纯合子小鼠胚胎心脏中下调了7.1倍[6-8]。Pax-8参与心脏的正常发育,并与心肌细胞的凋亡有关[9],Pax-8表达下调时细胞凋亡显著增加,细胞增殖活性下降[10]。
为了探讨Pax-8基因下调后引起细胞凋亡增多的机制,基因芯片和荧光实时定量PCR技术被应用于筛选Pax-8基因敲除小鼠差异表达的下游基因。
1 材料和方法
1.1 实验动物及分组 Pax-8基因敲除小鼠模型由德国Peter Gruss和Ahmed Mansouri教授惠赠。Pax-8基因敲除小鼠纯合子(Pax-8 KO-/-)为实验组,Pax-8基因敲除小鼠杂合子(Pax-8 KO+/-)和野生型(Pax-8 KO+/+)为对照组。纯合子和杂合子小鼠由雌性Pax-8 KO+/-小鼠与雄性Pax-8 KO+/-小鼠交配所得。
1.2方法
1.2.1 Pax-8基因敲除小鼠的基因型鉴定:实验小鼠基因型由PCR法鉴定。引物为5’-GGATGTGGAA TGTGTGCGAGG-3’、5’-GCTAAGAGAAGGTGGATGAGAG-3’,和5’-GATGCTGCCAGTCTCGTAG-3’。PCR条件:94 ℃预变性5 min,94 ℃变性15 s,60 ℃退火15 s,72 ℃延伸30 s,经过10个循环后,再94 ℃变性15 s,57 ℃退火15 s,72 ℃延伸30 s,经过25个循环后,72 ℃延伸5 min。每组扩增产物取5μL,用含Gold View的1.5%琼脂糖凝胶电泳,用凝胶成像分析系统(quantity one)摄像分析。
1.2.2 芯片杂交:取Pax-8 KO-/-组与Pax-8 KO+/-组出生第1天(P0)小鼠各3只,心脏组织总RNA由TRIzol法常规提取,经紫外吸收测定和变性琼脂糖凝胶电泳鉴定RNA质量。按上海生物芯片有限公司试剂盒说明书操作,反转录标记cDNA探针并纯化。Cy3-dUTP标记Pax-8 KO-/-cDNA,Cy5-dUTP标记Pax-8 KO+/-cDNA,将含31802个小鼠基因的Mouse OneArrayTMWhole Genome DNA microarray芯片(购自台湾华联芯片)与探针杂交(按台湾华联芯片说明书操作)。结果采用Axon公司的Gene Pix4100扫描,Gene PixPro4.0软件分析Cy3和Cy5两种荧光信号的强度和比值。用管家基因进行Cy3和Cy5均衡。判断基因差异表达的标准为:①Cy3和Cy5信号比值>2.0为表达上调,<0.5为表达下调,0.5~2.0为不存在显著表达差异。②Cy3和Cy5信号比值其中之一必须>200或其中之一<800及Cy5/Cy3在0.1~10之间,作为判断基因差异表达的标准。
1.2.3 半定量RT-PCR:Pax-8 KO-/-组、Pax-8 KO+/-组和Pax-8 KO+/+组各取P0小鼠3只,心脏组织总RNA由TRIzol法提取。经紫外吸收测定和变性琼脂糖凝胶电泳鉴定RNA质量后,取2μg总RNA进行逆转录反应(按RevertAidTM First Strand cDNA Synthesis Kit RT试剂盒说明书操作)。每组各取0.3μg cDNA分别进行PCR扩增NR4A1和GAPDH片段。NR4A1上游引物为5’-ATGCGATTCTGCAGCTCTTCC-3’,下游引物为5’-GGGTGGTATTGTCGTAGTAGAAGG-3’,GAPDH上游引物为5’-AGGTCGGTGTGAACGGATTTG-3’,下游引物为5’-TGTAGACCATGTAGTTGAGGTCA-3’(均由上海英骏生物技术有限公司合成)。管家基因GAPDH作为内参照标化NR4A1 mRNA表达。NR4A1反应条件如下:94 ℃预变性5 min后,94 ℃变性30 s,56.4℃退火30 s,72 ℃延伸1 min。GAPDH反应条件如下: 94 ℃预变性5 min后,94 ℃变性30 s,54.6℃退火30 s,72 ℃延伸1 min。分别当24、28、32、36个循环时中止反应,取5μL PCR产物用含Gold View的1.5%琼脂糖凝胶电泳,用凝胶成像分析系统(quantity one)摄像分析。
1.2.4 荧光实时定量RT-PCR:Pax-8 KO-/-组、Pax-8 KO+/-组和Pax-8 KO+/+组各取P0小鼠3只,如上述方法获得cDNA后,用NR4A1实时定量RT-PCR引物(由上海英骏生物技术有限公司合成)进行荧光定量PCR检测。NR4A1引物序列为上游:5’-TGTTG ATGTTCCCGCCTTTG-3’,下游:5’-ATGCGATTCTGCAGC TCTTCC-3’(由上海英骏生物技术有限公司合成),采用Beta-actin作为内部参照。用ABI 7500 FAST型荧光定量PCR仪检测,实验重复3次。通过比较ΔCt的方法进行NR4A1表达的定量分析,NR4A1的相对表达量用2-ΔCt表示。Ct为每个反应管内的荧光信号到达设定的阈值时所经历的循环数,ΔCt为NR4A1 Ct值与内参Beta-actin Ct值之差。
1.3 统计学处理方法 采用SPSS 11.5.0统计软件进行处理,实验数据经过方差齐性检验,以±s表示,两组间均数比较采用t检验,检验水准α=0.01。
2 结果
2.1 PCR法鉴定Pax-8基因敲除小鼠基因型 Pax-8 KO-/-表现为约370 bp的单一条带,Pax-8 KO+/+表现为约390 bp的单一条带,Pax-8 KO+/-表现为390 bp和370 bp双条带(见图1)。

图1 PCR法鉴定Pax-8基因敲除小鼠的基因型
2.2 Pax-8基因敲除小鼠中差异表达的基因 通过基因芯片对31802个已知基因进行分析,发现与Pax-8 KO+/-组相比,在Pax-8 KO-/-组中25个基因表达下调,另外17个基因表达上调,其中涉及细胞周期、直接参与代谢、参与细胞信号转导及核转录因子的基因,部分差异表达的基因见表1。

表1 利用基因芯片获得Pax-8 KO-/-的部分差异表达基因
2.3 半定量RT-PCR法验证基因芯片筛查结果 针对基因芯片筛选出的上调和下调的基因的引物做PCR扩增,比较不同的扩增周期不同基因的PCR产物量。结果发现NR4A1的PCR产物在第28个PCR循环周期开始,Pax-8 KO-/-组明显多于Pax-8 KO+/-组和Pax-8 KO+/+组。说明NR4A1基因在Pax-8 KO-/-小鼠中表达上调(见图2)。

图2 在P0的Pax-8 KO-/-小鼠,Pax-8 KO+/-小鼠和Pax-8 KO+/+小鼠心脏中NR4A1和GAPDH基因在不同的PCR扩增周期的产量比较

图3 NR4A1基因定量RT-PCR结果
2.4 荧光定量RT-PCR结果 NR4A1在Pax-8 KO-/-组比Pax-8 KO+/-组和Pax-8 KO+/+组分别上调(1.53±0.08)倍和(4.80±0.35)倍(均P<0.01),而作为内部对照的Beta-actin基因水平在两组间差异无统计学意义(P>0.05)(见图3)。
3 讨论
NR4A1,又称为Nur77、TR3、NGFI-B等,是一种转录因子,属于核受体超家族一员,从氨基端到羧基端,一共有4个结构域组成(见图4)。由于目前没有发现NR4A1的配体,故他们又被称为孤儿核受体。
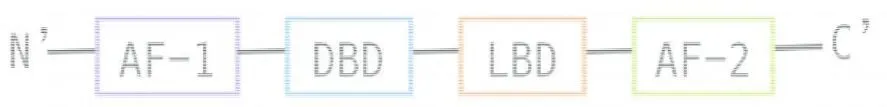
图4 NR4A1简图
无论在以细胞增殖为主的肿瘤细胞中[11-12],还是在以细胞凋亡为主的生物过程中[13-14],都可以找到NR4A1高表达的证据,表明其在增殖和凋亡上存在双重作用。目前研究表明,NR4A1在增殖和凋亡中的作用主要取决于细胞受到的分子信号:当细胞受到促进生长分裂的分子信号如Erk2等刺激时,NR4A1可作为转录因子,调节各种促进细胞增殖的基因表达[15];当细胞受到促进细胞凋亡的分子信号如JNK[16]等刺激时,NR4A1通过磷酸化,与RXR(retinoid X receptor)形成二聚体,从细胞核内转移至线粒体,与Bcl-2蛋白结合。NR4A1能与Bcl-2的第三和第四个同源结构域-BH3、BH4之间的环结构结合,从而使BH3暴露,使Bcl-2从保护凋亡转为促进凋亡,触发细胞色素C释放,激活细胞凋亡[17]。
值得注意的是,在Pax-8基因敲除小鼠心脏中,同时存在较正常高表达的NR4A1与Bcl-2-like 14(Bcl2l14)基因[18]。而后者的激活形态只含有BH3一个结构域,能够显著促进凋亡。
在整个室间隔形成的过程中,包括在房室心内膜垫、间隔、流出道、肌小梁和乳头肌的发生中,细胞凋亡都扮演着关键角色[19-21]。在Pax-8基因敲除小鼠心脏中,可能存在由NR4A1介导的,通过Bcl2l14执行的细胞凋亡增加。使得在心脏室间隔发育过程中,细胞凋亡过度,室间隔形成缓慢甚至室间隔缺损——这是我们从本研究中得出的推测,然而需要确证这种假设还需要进行NR4A1细胞内定位,NR4A1干扰后观察Bcl2l14表达变化等实验。
致谢:此课题的完成得到德国Peter Gruss及Ahmed Mansouri教授的支持和帮助,尤其是惠赠实验动物,特此表示感谢!
[1]Schlange T, Andree B, Arnold H, et al. BMP2 is required for early heart development during a distinct time period[J].Mech Dev, 2000, 91(1-2):259-270.
[2]Mishina Y, Suzuki A, Ueno N, et al. BMPR encodes a type I bone morphogenetic protein receptor that is essential for gastrulation during mouse embrvogenesis[J]. Genes Dev,1995,9(24):3027-3037.
[3]Fukushipe S, Ikoda J.Trapping of mammalian promoters by Cre-lox site-specific Recombination[J]. DNA Res, 1996,3(2):73-80.
[4]Gaussin V, Behringer RR, Schneider MD, et al. Endocardial cushion and myocardial defects after cardiac myocyte-specific conditional deletion of the bone morphogenetic protein receptor ALK3[J]. Proc Natl Acad Sci USA, 2002, 99(5):2878-2883.
[5]杨德业,宋后燕,张怀勤,等.室间隔缺损ALK3下游相关基因的初步研究[J]. 生物工程学报,2003,19(3):267-271.
[6]来丹丹,章佳颖,杨德业,等.ALK3基因在心肌细胞凋亡中的角色研究[J].解放军医学杂志,2009,34(2):179-182.
[7]杨德业,宋后燕,张怀勤,等. 心肌组织Pax8基因的研究[J]. 中华儿科杂志,2003,41(10):770-772.
[8]Yang DY, Zhang J, Chen C, et al. BMPR IA Downstream Genes Related to VSD[J]. Pediatr Res,2008,63(6):602-606.
[9]章佳颖,来丹丹,杨德业,等.Pax-8基因在胚胎心脏发育中的角色研究[J].中国病理生理杂志,2009,25(7):1292-1297.
[10]高瞻,来丹丹,张敏,等. Pax-8基因在大鼠心肌细胞凋亡中的作用[J]. 解放军医学杂志,2009, 34(9):1082-1084.
[11]Holla VR, Mann JR, Shi Q, et al. Prostaglandin E2 regulates the nuclear receptor NR4A2 in colorectal cancer[J]. J Biol Chem,2006,281(5):2676-2682.
[12]Maddika S, Booy EP, Johar D, et al. Cancer-specific toxicity of apoptin is independent of death receptors but involves the loss of mitochondrial membrane potential and the release of mitochondrial cell-death mediators by a Nur77-dependent pathway[J]. J Cell Sci,2005,118(Pt 19):4485-4493.
[13]Liu ZG, Smith SW, McLaughlin KA, et al. Apoptotic signals delivered through the T-cell receptor of a T-cell hybrid require the immediate-early gene nur77[J]. Nature,1994,367(6460):281-284.
[14]Woronicz JD, Calnan B, Ngo V, et al. Requirement for the orphan steroid receptor Nur77 in apoptosis of T-cell hybridomas[J]. Nature,1994,367(6460):277-281.
[15]Castro-Obregon S, Rao RV, del Rio G, et al. Alternative,nonapoptotic programmed cell death: mediation by arrestin 2,ERK2,and Nur77[J]. J Biol Chem, 2004,279(17):17543-17553.
[16]Kolluri SK, Bruey-Sedano N, Cao X, et al. Mitogenic effect of orphan receptor TR3 and its regulation by MEKK1 in lung cancer cells[J]. Mol Cell Biol, 2003, 23(23):8651-8667.
[17]Lin B, Kolluri SK, Lin F, et al. Conversion of Bcl-2 from protector to killer by interaction with nuclear orphan receptor Nur77/TR3[J]. Cell,2004,116(4):527-540.
[18]高瞻,来丹丹,黄晓燕,等.Pax-8 基因敲除小鼠心脏中Bcl2l14基因表达上调[J].中国病理生理杂志,2010, 26(4):640-644.
[19]Watanabe M,Choudhry A,Berlan M,et al. Developmental remodeling and shortening of the cardiac outflow tract involves myocyte programmed cell death[J]. Development,1998,125(19):3809-3820.
[20]Abdelwahid E,Pelliniemi LJ,Niinikoski H,et al. Apoptosis in the pattern formation of the ventricular wall during mouse heart organogenesis[J]. Anat Rec,1999,256(2):208-217.
[21]Kajstura J,Mansukhani M,Cheng W,et al. Programmed cell death and expression of the protooncogene bcl-2 in myocytes during postnatal maturation of the heart[J]. Exp Cell Res,1995,219(1):110-121.
