中药对肾小球硬化大鼠MMP-9、TIMP-1及TGF-β1mRNA表达的影响
2011-06-11倪晨王贵均王倩赖小平
倪晨 王贵均 王倩 赖小平
肾小球硬化(glomerulosclerosis,GS)是肾小球疾病发展至终末期,肾功能衰竭的主要病理改变。其中细胞外基质(ECM)降解减少、过度积聚,是GS的重要发病机制[1,2]。在ECM降解调控系统中发挥重要作用的是基质金属蛋白酶MMP和基质金属蛋白酶抑制物TIMP[3](MMPs-TIMPs)系统,随着TIMP-1表达增强,MMP-9降解作用减弱,MMP-9/TIMP-1的比值失调,最终形成肾小球硬化。此外,细胞因子在GS的形成过程中也起着非常关键的作用,其中转化生长因子[4]TGF-β1的调控作用尤为重要。TGF-β1既能促进ECM合成增加,又能抑制ECM的降解,最终导致ECM聚积,形成肾小球硬化。本研究基于肾络癥积理论,采用祛瘀化痰、散结消癥的治疗方法,配伍川芎、鳖甲、海藻[6-8],考察祛瘀化痰、散结消癥中药复方对肾小球硬化大鼠肾功能的作用。
1 材料与方法
1.1 仪器
超净工作台(苏净集团苏州安泰空气技术有限公司),CO2恒温培养箱(美国harris公司),倒置显微镜(日本Nikon公司),酶联免疫检测仪(BIORAD smartspec 3000型),电子精密天平(上海精密科学仪器有限公司),荧光定量PCR仪(ABI 7300)、Effendorf 冷冻离心机。
1.2 试药
川芎、鳖甲、海藻,购自康美药业股份有限公司。经广州中医药大学中药学院中药鉴定教研室鉴定后使用。称取川芎、鳖甲、海藻各20 g,分别置于1000 ml圆底烧瓶中,以10倍量水回流提取两次,每次1.5小时,滤过,洗涤滤渣,合并两次过滤液和洗涤液,浓缩至1.5 g·ml-1、1.0 g·ml-1、0.5 g·ml-1,分别为高、中、低浓度药液,置于4℃备用。
盐酸阿霉素,浙江海正药业股份有限公司,批号:09015,临用前用生理盐水配制为1 mg·ml-1;福辛普利钠片,施贵宝制药有限公司,批号:H20090262,粉碎后用蒸馏水配制成0.33 g·ml-1的溶液。MMP-9酶联免疫吸附法检测试剂盒、TIMP-1酶联免疫吸附法检测试剂盒(美国RB公司)、First Strand cDNA Synthesis Kit(Fermentas公司)。
1.3 动物分组、造模与给药
SD大鼠,60只,雌雄各半,180~220 g,由广州中医药大学实验动物中心提供(粤检证字2009A028)。
随机分为空白对照组、模型组、福辛普利钠组、高、中、低浓度中药组等6组,每组10只。各组动物腹腔注射2%戊巴比妥钠30 mg·kg-1麻醉,摘取左肾[5],空白对照组假手术。
各组动物手术后7天,尾静脉注射阿霉素5 mg·kg-1,20天后再给阿霉素3 mg·kg-1造模,空白对照组注射等体积生理盐水。
各组于第2次注射阿霉素后1天,按1 ml·100g-1·d-1灌胃,空白对照组及模型组给同体积蒸馏水,福辛普利钠组给福辛普利钠,各中药组给相应浓度药液,共给药8周。
1.4 24小时尿蛋白定量检测
各组于第2、4、6、8周结束时收集24小时尿液,溴甲酚氯仿法测定24小时尿蛋白定量。
1.5 MMP-9、TIMP-1检测
各组动物于末次给药1小时后,断头取血,常规方法取血清,另开腹腔取肾脏。
MMP-9的检测:取上述各组血清,按 MMP-9 ELISA试剂盒要求操作,培养板各孔加100 μl Assay Diluent RD1-34,每孔加100 μl标准品、样品,孵育2小时,弃去上清,400 μl Buffer洗液·孔-1,清洗4次,加MMP-9二抗孵育1小时,弃去上清,400 μl Buffer洗液·孔-1,清洗4次。每孔加显色液200 μl,避光室温孵育30 分钟,加终止液终止反应,用酶标仪检测450 nm处的吸光度OD值。
TIMP-1的检测:取上述各组血清,按酶联免疫吸附法(ELISA)试剂盒要求操作,将TIMP-1 McAb分别滴加在培养板孔内,100 μl·孔-1,4℃过夜后弃去上清,用0.05%(V/V)Tween-20PBS(PBST)洗板3次,每次3分钟;拍干后加含15%小牛血清的PBS,200 μl·孔-1,4℃过夜后弃去上清,PBST洗涤3次,每次3分钟。将标准品、样品加于包被孔内,37℃孵育1小时,PBST洗板5次,拍干后加HRP-抗TIMP-1二抗100 μl·孔-1,37℃孵育30分钟,PBST洗板5次,彻底拍干后加入TMB显色剂,50 μl·孔-1,37℃孵育15分钟,加2 mol H2SO4 50 μl·孔-1终止反应,用酶标仪检测450 nm处的吸光度OD值。
1.6 实时荧光定量PCR检测细胞TGF-β1mRNA
1.6.1 总RNA提取
取100 mg肾脏组织,按试剂盒要求操作,加入TRIzol反复吹打裂解细胞,用氯仿、异丙醇、75%乙醇分离、纯化 RNA,最后用DEPC水溶解,紫外分光光度法检测总RNA浓度及纯度,置于-20℃备用。
1.6.2 逆转录反应
反应体系为20 μl,各组分终浓度分别为dNTP 1 mmol·L-1、Oligo(dT)18引物2.5 nmol·L-1、M-MlV逆转录酶10 U·μl-1、总RNA样品0.2 ng~200 ng,DEPC水加至20 μl;逆转录反应参数为70℃孵育30分钟,冰上放置2分钟,37℃孵育5分钟,42℃孵育60分钟,70℃孵育10分钟,所得产物cDNA用于实时荧光定量PCR。
1.6.3 实时荧光定量PCR
所用的目的基因引物及内参照GAPDH引物均委托 invitrogen 公司合成。引物序列:TGF-β1上游引物5’-tacagggctttcgcttcagt-3’,下游引物5’-gttggtatccagg gctctcc-3’,产物长度 209 bp;GAPDH上游引物5’-ctcccattcctccacctttg-3’,下游引物5’-ccaccaccctgttgctgtag-3’,产物长度 110 bp。反应体系为20 μl:2 μl cDNA,1 μl SYBR Green I 荧光染料,1 mmol dNTP,1μmol·L-1上、下游引物,5U·μl-1Taq酶,DEPC水加至20 μl,混匀。PCR反应条件:95℃预变性5分钟,95℃变性45秒,56℃退火45秒,72℃延伸20秒,热循环40次,72℃延伸5分钟。
1.6.4 实时荧光定量PCR数据分析方法
按照2-△△Ct相对定量方法分析,目的基因和参照基因扩增效率都接近100%,具有一致性。△Ct=Ct(目的基因)-Ct(内参基因),△△Ct=△Ct(处理组)-△Ct(空白对照组),取100倍2-△△Ct数值进行比较。
1.7 统计学方法
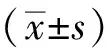
2 结果
2.1 各组大鼠24小时尿蛋白定量结果
各中药组均能减少肾小球硬化大鼠24小时尿蛋白(P< 0.05),见表1。
2.2 各组大鼠MMP-9、TIMP-1表达的比较
各中药组均能有效上调MMP-9的表达,下调TIMP-1的表达,提高MMP-9/ TIMP-1的比值(P< 0.05),其中中剂量组效果最为显著(P< 0.01),见表2。
2.3 各组大鼠TGF-β1 mRNA表达的比较
各中药组均能抑制肾小球硬化大鼠TGF-β1mRNA的表达(P< 0.01);其中以中剂量组效果最显著,见表3,图1。
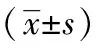
表1 各组大鼠24小时尿蛋白定量比较
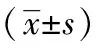
表2 各组大鼠MMP-9、TIMP-1表达的比较
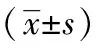
表3 各组大鼠TGF-β1mRNA表达的比较

图1 各组大鼠TGF-β1mRNA表达的比较
3 讨论
细胞外基质ECM的降解过程中发挥重要作用的是MMPs-TIMPs系统,其中,MMP-9可降解ECM中主要成分,减少ECM沉积,而TIMP-1可抑制MMP-9的降解作用,因此,MMP-9表达降低或TIMP-1表达增高,均可使MMP-9/TIMP-1的比值失调,从而加速肾小球硬化的形成。转化生长因子TGF-β1在肾小球硬化的形成过程中也起着非常关键的作用,TGF-β1既能促进ECM合成增加,同时又抑制ECM的降解,最终导致ECM聚积,形成肾小球硬化。因此,本研究观察各药物组对肾小球硬化大鼠MMP-9、TIMP-1、TGF-β1mRNA的表达及MMP-9/TIMP-1比值的调节,评价各组中药对ECM降解调控系统的影响。
中国古代医籍中没有“肾小球硬化”的表述,但根据其发展过程中的临床表现及发病特点,该病可归属于 “水肿”、“虚劳”、“肾劳”、“癃闭”等病症范畴。该病络气郁滞[9],瘀血痰湿凝滞肾络而致“肾络癥积”,肾脏组织的病理改变,如细胞外基质积聚、血管拌闭塞、球囊粘连、局灶或节段性肾小球硬化等,都可归属于“肾络癥积”的范畴。
本实验采用单侧肾切除加注射阿霉素造模法,建立肾小球硬化大鼠模型,实验表现为蛋白尿和肾功能低下。实验选取福辛普利钠作为肾脏保护的阳性对照组,福辛普利钠属于血管紧张素转换酶抑制剂,通过抑制血管紧张素Ⅱ的生成、阻断肾素—血管紧张素—醛固酮系统作用,及抑制缓激肽降解、增强缓激肽效应;同时可以减少尿蛋白排泄等,拮抗肾小球硬化及肾间质纤维化而延缓肾损害进展。通过川芎、鳖甲、海藻相互配伍,针对肾络之“痰、瘀、癥积”,在祛瘀、化痰的同时,配伍散结消癥之品以增强消癥化积之力,以期“痰瘀同治、癥结并消”。实验结果提示该复方能减少肾小球硬化大鼠24小时尿蛋白(P<0.01),抑制TIMP-1的表达(P< 0.05),上调MMP-9活性(P< 0.05);中剂量组可同时下调TGF-β1mRNA表达(P< 0.01);可能通过对ECM系统的调控,产生对肾小球硬化大鼠肾功能的保护作用。 综上所述,“肾络癥积”理论指导下的祛瘀化痰、散结消癥中药复方,为中医药临床治疗肾小球硬化,提供新的思路,但仍需进一步研究。
[1] Klahr S,Morrissey JJ. The role of vasoactive compounds, growth factors and cytokines in the progression of renal disease[J]. Kidney Int,2000,75(S):7-14.
[2] 彭爽,曹文富. 中药防治肾纤维化的实验研究进展[J]. 中国药房,2010,21(7):666-668.
[3] 雷凤英,覃远汉,裴娟,等. 基质金属蛋白酶及金属蛋白酶组织抑制因子-1在肾小球硬化大鼠中的表达和意义[J]. 实用儿科临床杂志, 2007,22(23):1812-1813.
[4] Ostendorf T,Kunter U,van Roeyen C,et al. The effects of platelet-derived growth factor antagonism in experimental glomerulo-nephritis are independent of the transforming growth factor-beta system[J]. J Am Soc Nephrol,2002,13(3):658-667.
[5] 段晓虹,董竞成,何立群,等.补肾活血方对肾小球硬化大鼠的细胞外基质状态的影响[J]. 中国中西医结合杂志,2010,30(11):1197-1200.
[6] 杜联,殷丽平,杨彦,等. 川芎嗪联合贝那普利对GK大鼠肾间质MCP-1和TGF-β1表达干预的实验研究[J]. 泸州医学院学报,2009,32(5):479-481.
[7] 范焕芳,陈志强,张雪娟,等. 鳖甲煎丸对人肾小球系膜细胞增殖及细胞外基质表达的影响[J]. 中成药,2007,29(2):183-186.
[8] 薄守波,鞠建伟,李建远,等.褐藻多糖硫酸酯对人肾小球系膜细胞增殖及纤连蛋白与转化生长因子分泌的影响[J]. 中华肾脏病杂志, 2006,22(10):638-639.
[9] 王永钧,张敏鸥. 痰瘀互结与肾内微型癥积[J]. 中国中西医结合肾病杂志,2003,4(1):1-3.
