万古霉素单用及联合利福平或磷霉素对耐甲氧西林金黄色葡萄球菌防耐药突变浓度的研究
2011-06-09朱玉林李家斌
梅 清,喻 婷,朱玉林,程 君,2,3,叶 英,2,3,李家斌,2,3
(1安徽医科大学第一附属医院感染科,2安徽省细菌耐药监测中心,3安徽医科大学细菌耐药研究所,安徽合肥 230022)
万古霉素是治疗耐甲氧西林金黄色葡萄球菌(methicillin-resistant staphylococcus aureus,MRSA)感染的首选药物,但随着万古霉素的广泛应用,其最小抑菌浓度(MIC)逐年上升,形成“MIC漂移”现象[1]。万古霉素中介(VISA)、异质性万古霉素中介(hVISA)以及万古霉素耐药(VRSA)的金黄色葡萄球菌也在美国、日本等多个国家被陆续报道[2]。目前预防MRSA菌株进一步突变,保护万古霉素抗感染活性已成为临床医务工作者的当务之急。
耐药突变选择窗(mutant selection window,MSW)理论是近年来提出的一个遏制抗菌药物耐药的新策略[3]。抗菌药物浓度位于野生敏感株MIC和防耐药突变浓度(mutant prevention concentration,MPC)之间时,耐药突变体就会被选择性富集扩增。当药物浓度高于MPC时,这种富集则被抑制。但是由于药物安全性问题,临床上单独应用一种抗菌药物,要获得血浆或组织中药物浓度长时间位于MPC以上是很困难的。本研究通过测定万古霉素单用及分别与利福平、磷霉素联合使用对10株MRSA临床分离株的防耐药突变浓度的变化,在体外初步探讨两种不同作用机制的抗菌药物联合应用防止耐药突变体的产生的影响,以指导临床合理用药。
1 材料与方法
1.1菌株来源与鉴定安徽省细菌耐药监测中心2009~2010年收集的临床标本。从中选取10株对万古霉素、利福平敏感,同时对磷霉素的MIC≤16.0 mg·L-1的MRSA临床分离株。MRSA的鉴定参照文献[4]的方法,所有菌株均扩增出甲氧西林耐药基因(mecA)和具有金黄色葡萄球菌种特异性的耐热核酸酶基因(nuc)。
1.2培养基与仪器M-H培养基购自英国Oxiod公司。恒温振荡培养箱(国胜仪器厂,江苏);细菌比浊仪(Oxiod,英国);32R低温离心机(Hettich,德国);多点接种仪(AQS Manufacturing公司,英国)。
1.3抗菌药物及试剂万古霉素 (VAN,批号:130360-200301纯度:100%)和磷霉素 (FOS,批号:130350-200001纯度:99%)均购自中国药品生物制品检定所。利福平(RFP,批号:13292-46-1,250 mg/瓶,纯度:97%)和6-磷酸葡萄糖(500 mg/瓶,纯度:98% ~100%)均购自Sigma公司 。
1.4最低抑菌浓度(MIC)测定采用琼脂平板倍比稀释法,结果按美国临床实验室标准化委员会CLSI2010年标准[5]判读。磷霉素采用琼脂稀释法进行MIC,测定时按照CLSI要求每个琼脂平板加入终浓度为25 mg·L-1的6-磷酸葡萄糖。
1.5防耐药突变浓度(MPC)的测定[6]
1.5.1含单药琼脂平板的配制采用琼脂平板倍比稀释法测定抗菌药物对10株MRSA分离株的MPC。以各单药MIC为基准,倍比稀释7个浓度配置琼脂平板。药物终浓度分别为各菌株的1×MIC、2×MIC……64×MIC。每个浓度配制4个平板。在测定磷霉素的MPC时,每个琼脂平板均加入终浓度为25 mg·L-1的6-磷酸葡萄糖。
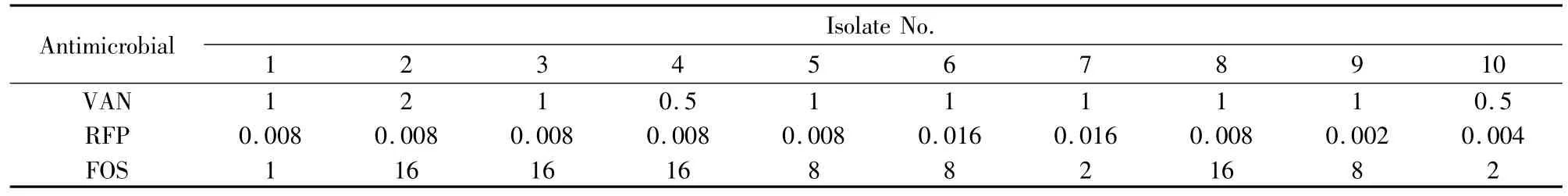
Tab 1 MICs of 3 antimicrobial agents against 10 strains of MRSA(mg·L-1)
1.5.2含两药琼脂平板的配制以VAN的MIC、MPC为基准,采用倍比稀释法配制含两药的琼脂平板,具体方法:分别精密量取1 ml不同MIC倍数浓度的VAN+1 ml浓度为4.0 mg·L-1的RFP 或1 ml浓度为48.0 mg·L-1的FOS(均为常规用药后平均血浆药物浓度[7])+18 ml M-H琼脂,在90 mm平皿中混匀,配制成一系列不同浓度的含两药琼脂平板,每个浓度配制4个平板。
1.5.3MPC以及耐药频率的测定从新鲜过夜培养的细菌平板上挑取单个菌落接种于20 ml MH肉汤中37℃震荡过夜培养,3 000 r·min-1离心后弃上清液,细菌再悬浮于200 ml的新鲜MH肉汤中,震荡培养6 h,离心后将菌液浓度调整为3×1010CFU·ml-1。取 100 μl菌液放在 90 mm 直径含不同浓度药物的MH琼脂平板上,用L形棒涂布均匀,每个浓度4个平板,使每个药物浓度的细菌总接种量为1.2×1010CFU。35℃培养72 h,以无细菌生长的最低药物浓度为MPC。每次试验均对接种菌液稀释后进行平板菌落计数,以确定接种细菌量在1010以上。对接近MPC药物浓度筛选出来菌株接种于不含药物的琼脂平板上,传代2次后再接种于原筛选药物浓度的平板上,以确定其为耐药突变体。耐药频率的计算按照文献[8]:将不同药物浓度平板上的菌落数除以接种的菌落数。以上实验重复3次,取其平均值。
1.6统计学分析数据分析采用SPSS11.0统计软件对各组数据进行非参数检验。
2 结果
2.1抗菌药物对MRSA的MIC值VAN、RFP和FOS对10株MRSA的MIC值见Tab 1。
2.2抗菌药物单用及联合使用对MRSA的MPC和SI值VAN单用及分别与RFP和FOS联合使用,对10株MRSA的MPC和选择指数(SI=MPC/MIC)见Tab 2。RFP和FOS单用对10株MRSA的MPC分别为 >1 024 mg·L-1和128 ~1 024 mg·L-1。

Tab 2 MPC(mg·L-1)and SI for vancomycin alone and in combination with rifampicin and fosfomycin respectively against 10 strains of MRSA
2.3耐药频率VAN单用以及分别RFP及FOS联合使用对10株MRSA的耐药频率见Tab 3。

Tab 3 Drug-resistant frequencies of vancomycin alone and in combination with rifampicin and fosfomycin respectively against 10 strains of MRSA
3 讨论
MRSA是引起医院感染的重要致病菌,具有多重耐药性,治疗困难,病死率高,是目前临床治疗的难题[9]。万古霉素一直被认为是MRSA感染的标准治疗,但有报道称其对MRSA引起的下呼吸道院内感染治疗失败率高达40%以上[10]。MSW理论[3]认为:抗菌药物治疗失败和耐药菌株的产生可能与临床药物剂量落在耐药突变选择窗内有关,即只杀灭敏感细菌,而菌群中少数自发耐药突变体则被选择性富集。当药物浓度高于MPC时,病原菌必须同时发生两次或更多次耐药突变才能生长,这样耐药突变体出现的可能性将极小。因此MPC可作为一项指标来评价抗菌药物的抗菌活性、反映药物抑制耐药突变选择的能力。胡晖等[11]测定了122株MRSA临床分离株对万古霉素的MPC,结果显示其MPC90值为22.4 mg·L-1。这与本研究中10株MRSA对万古霉素的MPC为16~64 mg·L-1的结果接近。结合药代动力学参数看,万古霉素常规剂量使用后血浆峰浓度Cmax为 25~40 mg·L-1,略高于MPC值,但是由于万古霉素组织穿透性弱,在肺、骨等组织中分布的药物浓度远低于血浆浓度[12],往往使感染部位的药物浓度恰好落在MSW之内,若要增大给药剂量,却可能产生严重的毒副作用,所以在这种情况下万古霉素单独使用限制耐药突变体富集的能力并不理想。
MSW理论提供了一种限制耐药突变体产生的方法[3]:选择不同作用机制的抗菌药物联合应用从而关闭或缩小MSW,达到防止细菌耐药产生同时不增加不良反应的目的。李朝霞等[6]报道在琼脂平板实验中,万古霉素与左氧氟沙星联合使用可以使左氧氟沙星单药对金黄色葡萄球菌ATCC29213的MSW缩小2~4倍,使万古霉素单药对金黄色葡萄球菌ATCC29213的MSW缩小4~8倍。Firso等[13]运用体外药效学模型,成功地证明了莫西沙星+多西环素在防止金黄色葡萄球菌发生耐药方面具有协同作用。近几年耐甲氧西林葡萄球菌的耐药性监测显示万古霉素、利福平以及磷霉素对MRSA仍保持较高的敏感率[14]。本研究将万古霉素与利福平、磷霉素联合使用,SI较其单用分别下降2~16倍和4~32倍,再次证实了不同作用机制的抗菌药物联合使用可以降低MPC,缩小MSW,减少耐药菌的生成。这是因为细菌通过单步变异产生耐药菌的概率为10-7,如果联合用药,细菌必须通过一步变异同时获得对两种药物的耐药,理论上其发生率仅为10-14,而人体感染部位的细菌数量可达到1010CFU却远低于1014CFU,因此很难发生自发耐药变异。
本试验发现万古霉素与磷霉素联合缩小MRSA耐药突变窗的能力强于万古霉素与利福平的联合方案(P<0.01)。这可能与磷霉素和利福平各自限制耐药突变体富集的能力有关。虽然利福平对10株MRSA的 MIC≤0.016 mg·L-1,MPC 却高到无法测出(>1 024 mg·L-1),而磷霉素的MPC则为128~1 024 mg·L-1,其MSW较利福平窄的多。因此,各单药的MSW越窄,联合使用后MPC降低的幅度越大。这一特征与聂大平等[15]对铜绿假单胞菌防耐药突变浓度的研究得出的结论一致。
从耐药频率看,万古霉素分别与利福平、磷霉素联用,较单用时耐药频率均有明显下降(P<0.01)。也就是说,虽然联合用药时低浓度万古霉素(如1×MIC、2×MIC)琼脂平板上仍然有耐药突变体的产生,但其数量大幅降低,这从另一角度也反映出联合用药较单独用药更能防止耐药突变体的富集。
万古霉素分别与其他抗菌药物联合治疗MRSA感染的方案早有报道,但以往的研究大部分基于传统的MIC治疗策略[16]。本研究依据遏制抗菌药物耐药的新理论,对万古霉素分别联合利福平和磷霉素在防耐药突变浓度方面进行了初步的探讨,结果表明这两种联合方案能够有效的防止耐药突变体的富集,为临床合理利用现有抗菌药物治疗MRSA感染,防止耐药菌的产生提供了理论依据。由于体内药物浓度处于动态变化中,受到的影响因素也较多,因此联合用药时药代动力学相关参数与耐药突变体富集的关系还需要在体内试验中得到进一步的研究。
[1]Steinkraus G,White R,Friedrich L.Vancomycin MIC creep in non-vancomycin-intermediate Staphylococcus aureus(VISA),vancomycin-susceptible clinicalmethicillin-resistantS.aureus(MRSA)blood isolates from 2001 -05[J].J Antimicrob Chemother,2007,60(4):788 -94.
[2]Appelbaum P C.Reduced glycopeptide susceptibility in methicillin-resistant Staphylococcus aureus(MRSA)[J].Int J Antimicrob Agents,2007,30(5):398 -408.
[3]Zhao X,Drlica K.Restricting the selection of antibiotic-resistant mutants:a general strategy derived from fluoroquinolone studies[J].Clin Infect Dis,2001,33(Suppl 3):147 -56.
[4]阳志强,郭兆彪,宋亚军,等.用双重聚合酶链快速鉴别葡萄球菌及其甲氧西林耐药性[J].中华医院感染学杂志,2003,13(10):916-8.
[4]Yang Z Q,Guo Z B,Song Y J,et al.Rapid identification of Staphylococcus and its resistance against methicillin using duplex polymerase chain reaction[J].Chin J Nosocomiol,2003,13(10):916-8.
[5]Clinical and Laboratory Standards Institute/NCCLS.Performance standards for antimicrobial susceptibility testing;twentieth informational supplement[S].CLSI Document,2010,30(1):1 -153.
[6]李朝霞,刘又宁,王 睿,等.左氧氟沙星联合万古霉素缩小金黄色葡萄球菌耐药突变选择窗的初步研究[J].中国临床药理学与治疗学,2007,12(8):911 -4.
[6]Li Z X,Liu Y N,Wang R,et al.Preliminary study for narrowing mutant selection window of Staphylococcus aureus by combination of levofloxacin and vancomycinin vitro[J].Chin J Clin Pharmacol Ther,2007,12(8):911 -4.
[7]Kucers A,Scrowe S,Grayson M L,et al.The use of antibiotics:a clinical review of antibacterial,antifungal,and antiviral drugs[M].5th ed.Boston,Mass:Butterworth-Heinemann,1997:676-92.
[8]Zhanel G G,Mayer M,Laing N,et al.Mutant prevention concentrations of levofloxacin,ciprofloxacin alone and in combination with azithromycin,ceftazidime,colistin(polymyxin E),meropenem,piperacillin-tazobactam,and tobramycin against Pseudomonas aeruginosa[J].Antimicrob,Agents Chemother,2006,50(6):2228-30.
[9]黄妮妮,刘 洁.耐甲氧西林金黄色葡萄球菌感染流行病学调查[J].中华医院感染学杂志,2005,15(1):47 -8.
[9]Huang N N,Liu J.MRSA infection:an epidemiology survey[J].Chin J Nosocomiol,2005,15(1):47 -8.
[10]Moise P A,Schentag J J.Vancomycin treatment failures in Staphylococcus aureus lower respiratory tract infections[J].Int J Antimicrob Agents,2000,16(Suppl1):S31 -4.
[11]胡 晖,唐 清.万古霉素和利奈唑胺对耐甲氧西林金黄色葡萄球菌防耐药变异浓度的测定[J].实用预防医学,2010,17(2):374-6.
[11]Hui H,Tang Q.Research on mutant prevention concentration of vancomycin and linezolid against methicillin-resistant staphylococcus aureus[J].Pract Prevent Med,2010,17(2):374 -6.
[12]Rybak M J.The pharmacokinetic and pharmacodynamic properties of vancomycin[J].Clin Infect Dis,2006,42(Suppl.1):S35 -9.
[13]Firsov A A,Vost rov S N,Lubenko I Y,et al.Prevention of the selection of resistant Staphylococcus aureus by moxifloxacin plus doxycycline in anin vitrodynamic model:an additive effect of the combination[J].Int J Antimicrob Agents,2004,23(5):451 -6.
[14]任 南,文细毛,吴安华.全国医院感染监控网对医院内金黄色葡萄球菌感染及耐药性监测报告[J].中国医学工程杂志,2007,15(5):425 -7.
[14]Ren N,Wen X M,Wu A H.Study on surveillance of drug resistance of Staphylococcus aureus in hospital infection in national monitoring net of hospital infection[J].Chin Med Engin,2007,15(5):425-7.
[15]聂大平,董 枫,石宏宴.左氧氟沙星、环丙沙星单用和联合其他抗菌药物对铜绿假单胞茵防突变浓度的研究[J].中国感染控制杂志,2007,6(6):397 -400.
[15]Nie D P,Dong F,Shi H Y.Study on mutant prevention concentrations of levofloxacin,cipronoxacin alone and in combination with the other antimicrobial agents against Pseudomonas aeruginosa[J].Chin J Infect Control,2007,6(6):397 -400.
[16]李勇红,白玉兰,楮云卓.抗菌药物联合应用对MRSA体外抗菌活性研究[J].中国药理学通报,2007,23(3):418-9.
[16]Li Y H,Bai Y L,Chu Y Z.Study on the antibacterial activity of combined antibacterial agents against MRSAin vitro[J].Chin Pharmacol Bull,2007,23(3):418 -9.
