脊髓损伤动物模型的运动功能评价
2011-06-09金建波李华南张国福
顾 兵,金建波,李华南,张国福
(1.江西科技师范学院药学院,江西 南昌 330013;2.江西中医学院药学院,江西 南昌 330006)
脊髓损伤(spinal cord injury,SCI)是由于椎体的移位或碎骨片突出于椎管内造成脊髓或马尾神经不同程度的损伤,出现与损伤节段相应的各种运动、感觉和括约肌功能障碍、肌张力异常以及病理反射等改变。国内外已经建立了脊髓挫伤、压迫损伤、横断损伤、缺血损伤、牵张损伤和化学损伤等多种SCI动物模型,并且开展了部分神经保护药物的药效学筛选[1]。但在实际研究中发现,动物模型与临床SCI仍有很大区别,需要建立一套完整的、客观的运动功能评价系统,这对进一步探讨SCI发生发展机制和损伤后的修复治疗显得尤为重要[2]。现有的SCI动物模型的运动功能评价方法可大致分为开放场地试验(open field test),非开放性场地试验(non-open field test)和联合行为学评分法(combined behavioral score)3类,具体分类如Fig 1所示。本文就各种SCI动物模型的运动功能评价方法及其优缺点作系统综述,方便研究者根据实验治疗学的需要选用合适的模型及其评价方法。
1 Tarlov法(Tarlov test)
1953年Tarlov等首次描述开放场地试验,并应用于动物脊髓压迫损伤后的运动功能评价,内容有关节活动度,能否行走、跑步等。其特点是对灵长类动物较为可靠,且与脊髓损伤程度、神经功能恢复及轴突残存数量等的相关性较好,但对啮齿类动物一致性较差[3]。由于观察者存在主观随意性,在不同实验环境下重复性不高。随后许多学者对Tarlov法进行了诸多改良,并将此法应用于大鼠后肢功能评价。Kazanci等[4]采用Tarlov法评价家兔脊髓缺血损伤后的运动功能,表明美西律具有明显改善神经功能和缓解组织病理损伤的作用,但与甲泼尼龙(强大的抗氧化剂)比较无统计学差异。Liang等[5]探讨川芎嗪和去铁胺治疗大鼠脊髓缺血损伤的联合效应,结果治疗组Tarlov评分明显高于对照组,且截瘫发生率与形态学改变存在相关性。改良的Tarlov法虽然较为简单,但评分跨度大,容易呈跳跃性分布,较难判别啮齿类动物SCI程度上的差异,也难以揭示神经功能恢复的整个过程。因此,Tarlov法仅作为啮齿类动物SCI程度的初步筛选,适合与其他行为学方法结合使用。Akdemir等[6]采用改良后的Tarlov法分级标准和斜板试验,评价经SJA6017(一种钙蛋白酶抑制剂)治疗后的SCI大鼠后肢功能的改善状况,提示抑制钙蛋白酶诱导的细胞凋亡可能是一种可行的SCI治疗策略。
2 BBB法(Basso-Beattie-Bresnahan test)
1995年Basso等以Tarlov法的开放场地试验为基础提出一种新的神经运动功能评价方法(简称BBB法)。该法分级较细致,几乎包括了SCI后大鼠后肢恢复过程中所有行为学变化,且与脊髓损伤的程度高度相符。该法是目前许多研究者较为推崇的一种方法。主要是将动物置于环形封闭金属壳内,两个观察者对侧站立观察后肢运动功能变化,观察期为5 min,期间观察者依照评分标准进行评分。根据评分结果,可以把SCI分为瘫痪、早期恢复、中期恢复和最后恢复4个阶段。Basso等认为该法专门用于评价大鼠SCI后后肢运动功能恢复情况,尤其是低位胸段脊髓挫伤后运动功能评价。其次,评分结果具有灵活性,可用于探讨运动功能恢复机制。由于记分呈渐进性排列,能够反映早期、中期及晚期的行为变化,揭示SCI恢复的全过程。Lankhorst等在此基础上又增加了数据的输入、储存和分析,方便了数据间相互比较。Li等[7]改良了BBB法,并应用于小鼠SCI模型的运动功能评价。与斜板试验相比较更具敏感性,本法变异系数更小。Pinzon等[8]报道米诺环素治疗并未引起SCI大鼠行为学或组织病理学的改变,呼吁临床脊髓挫伤之后使用米诺环素治疗尚需要作进一步细致的研究。Takeda等[9]报道利用米诺环素治疗大鼠脊髓缺血损伤,而后借助BBB法评判大鼠后肢运动功能。结果发现治疗组动物BBB评分和正常神经元数量明显高于对照组。BBB法用于评价前后肢运动功能时,需要采用双盲、双人独立观察记录,这样评分结果更具有客观性。因评分细节较多,对于初学者不易掌握。BBB法仅适用于轻、中度损伤,而对重型损伤的评判敏感性不高。
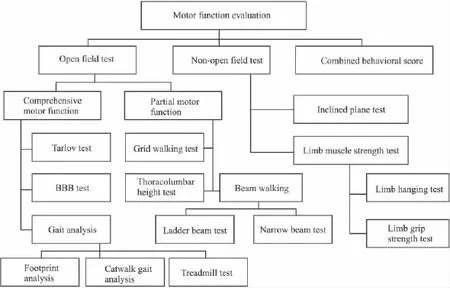
Fig 1 Schematic classification of motor function evaluation methods of animal models for spinal cord injury
3 步态分析(gait analysis)
de Medinaceli等最早于1982年建立了脚印分析(footprint analysis)方法,并将其应用于大鼠神经运动功能评估,后经Metz等[10]进行诸多改良。该法是将试验动物爪子涂以不同颜色的墨汁,并让其在木杆上行走,以跨步距离、爪子负重以及爪子活动角度为指标进行分析。但由于动物跨步距离和爪子活动角度难以精确测量,可靠性较差。Jia等[11]报道传统中药疏血通能明显促进脊髓血液循环,减少继发性损伤,保护缺血区神经元。采用Tarlov评分法和脚印分析法证实疏血通能促进损伤脊髓的运动功能恢复。CatWalk分析系统是继BBB法之后,学术界广为推崇的一种研究动物步态的自动评价体系。一般重大的原创性的实验治疗学结果,建议采用CatWalk步态分析法证实。该法能够提供大量不同运动功能的分析数据,包括着地时间、悬空时间、步长、左右脚间距、步序等[12]。与BBB法相比,CatWalk步态分析法克服了因动物快速运动而难以作出准确评估的缺陷,适合前后肢协调性评价[13]。其次,该法也大大减少了人为因素的影响,使得评价结果的可靠性大大提高。Salazar等[14]采用Catwalk步态分析和BBB法观察小鼠脊髓挫伤后30 d,移植人类神经干细胞的治疗效果。结果显示小鼠运动功能在移植后d 2就得到明显改善。
跑台试验(treadmill test)是在Catwalk装置的基础上进行的又一次改进。主要是把透明跑道转换成一条可运转的跑步带,以便更有利于步态分析。据国外的文献报道有Digit步态系统和Treadscan步态系统两种。该试验可用于动物肢体协调性及水平或倾斜步态力学分析,适合对小型啮齿类动物的研究。其次,步态参数与跑步带的速率呈相关性,便于进行不同阶段神经运动功能的评估。此法不再需要对试验动物前后肢涂墨汁,弥补了脚印分析的缺陷。因此,跑台试验被广泛应用于大脑感觉运动皮质损伤和SCI后的神经再生研究,其不足是需要购置昂贵的带高速摄像机的跑步机以及配套的数据采集分析软件。Li等[15]报道激活Nogo-66受体可以促进成年中枢神经系统损伤后的轴突生长,跑台试验、改良BBB法、斜板试验和倾斜网格爬行评分均明显提高。
4 网格爬行(grid walking)
爬网格试验是检测动物脑或脊髓损伤后是否精确控制后爪放置能力的一种评价方法,适用于猫、鼠等小型动物。根据网格放置角度不同,可分为水平网格试验和倾斜网格试验[16]。该方法是将试验动物置于水平或倾斜的网格上(两杆之间距离2.5 cm),以训练动物在网格上方寻找食物与水,记录在此过程中大鼠后爪失足落空次数,发出脚步声次数以及通过这段距离的时间等行为学数据。缺点是网格线太细,对后肢失足不易评价。要求训练者把握评价的每个细节,以便准确判别损伤与非损伤行为学变化。人为因素影响较大,耗时耗力,并且费用高。动物行走速度过快时不易观察。之后,Prakriya等建立了一套网格爬行试验自动分析系统,首先用于评价T12-T13脊髓背侧横断损伤后的行为学改变。对于行为学判断更为精确化,尤其是判别脚步声的持续性。具有操作简便,耗时短,可比性高等优点。但是,细小的行为变化,如轻微失足,仍较难检测。此外,由于一维感觉模式的局限,难以区分左右后肢的脚步声。Xu等[17]联合应用神经干细胞移植和NgR免疫接种来改善成年大鼠SCI后的运动功能,网格爬行试验的指标和BBB评分明显好于单个药物的治疗效果。
5 平衡木行走(beam walking)
平衡木行走可分为阶梯平衡木(ladder beam test)和狭窄平衡木(narrow beam test)两种试验。前者用来评价动物控制前后爪的放置能力,方法是将动物置于阶梯平衡杠杆上,记录前后肢滑落杠杆的次数,由DV视频采集数据。Cummings等[18]制作了改良的阶梯平衡木装置及其评分系统,并用于评价T9脊髓挫伤小鼠的后肢功能。最为关键的是,水平阶梯平衡木行走试验能辨别在开放场地试验中脚步频率相等的小鼠。该法的特点是受试对象训练时间短,参数评估准确,试验过程便于重复观察。其次,有利于辨别小鼠BBB评分中第5~7点和大鼠BBB评分中第9~13点的行为变化。但与BBB法不同的是,该法主要评价感觉运动皮层损伤或SCI,尤其是高位颈部SCI引起的前后肢功能障碍[19]。另外,该法可对某些区域功能恢复能力加以辨别,如负重行走。Fiore等[20]将阶梯装置倾斜至40°建立倾斜阶梯平衡木试验分析小鼠失足指标。小鼠中等程度的脊髓挫伤采用神经甾体脱氢表雄酮治疗后,运动行为障碍减轻,而且行为学结果与神经病理学改变呈一定相关性。1975年Hicks等建立狭长平衡木装置评价大鼠SCI后身体平衡能力,失足次数等指标,适用于SCI模型及颅脑感觉运动皮层损伤的行为学评估。根据试验要求,通常将平衡木分为3种规格:1.2 cm、2.3 cm矩形平衡木和2.5 cm直径的圆柱形平衡木。Kunkel-Bagden等认为狭窄平衡木试验可定量评估SCI大鼠的运动功能。郭丽萍等采用改良的狭窄平衡木试验评价大鼠颅脑损伤后的协调肌肉运动以及保持平衡的能力,并将损伤程度量化测试。缺点是平衡木越狭窄,试验动物的失足次数越多,导致评估结果可靠性降低。Merkler等[21]报道在采用Nogo-A(一种髓鞘相关轴突生长抑制剂)抗体中和抑制性抗原的抑制作用研究中,狭窄平衡木试验、BBB评分及爬网格试验评分结果都有明显提高。
6 胸腰高度试验(thoracolumbar height test)
胸腰高度试验是通过监控设备观察大鼠通过透明跑道走廊时胸腰椎高度,借此分析大鼠后肢是部分负重还是全部负重。van de Meent等[22]将SCI后大鼠分别置于3个不同类型的环境中,分别采用胸腰高度试验、BBB评分和Catwalk步态分析、网格试验评价其行为学改变。结果表明SCI大鼠在富裕环境中进行训练达到一定阈值,运动功能会得到明显改善,但运动功能恢复不会再随强度增加而增加。缺点是不适用于轻型或极重型SCI模型的行为学评估,只能作为行为学评价的一种辅助手段。
7 斜板试验(inclined plane test)
斜板试验装置主要由2个直角夹板构成,通过铰链将夹板相互连接。斜板侧面设有角度板,便于调整角度。方法是将实验动物置于一斜板上,通过调整斜板角度获取动物SCI后在斜板上维持5 s的最大角度值。斜板试验的设备制作简单,方法简便,重复性好,无创伤性,且与SCI程度相关性高,比较适用于轻中度SCI模型。1998年Yonemori等将斜板试验进行了技术上的改造。具体是将大鼠置于水平斜板上(0°),然后逐渐升至30°作为起始角度,随后以2度/秒的速度增大,直到动物从斜板上滑落,记录最大角度值。Han等[23]报道实验性SCI大鼠给予降血脂药物辛伐他丁后,斜板试验角度以及BBB评分均明显提高,认为这种神经保护功效可能与上调BDNF和GDNF的表达有关。国内学者通过斜板试验与Tarlov法相结合的方法,观察中药龟板对大鼠SCI后后肢功能恢复情况。为使该法更具可靠性,通常把整个实验过程分为预实验和正式实验两个阶段。预实验的目的是使试验动物适应环境,避免在正式实验中出现恐惧神态而影响评估结果。斜板试验缺点是难以揭示大鼠神经功能的细微改变,如爪的位置,尾的下垂或上翘,从而影响运动功能的整体评价。宋焕瑾等通过对银杏叶提取物治疗大鼠SCI后下肢运动功能恢复程度进行观察,结果斜板试验和BBB法检测值与脊髓损伤程度有明显相关性。认为多种行为学相结合的评价方式可弥补了单一评定方法的不足,有效地提高了评分的准确性及敏感性。
8 肢体肌力试验(limb muscle strength test)
肢体肌力试验根据实验装置的不同,可分为肢体悬挂试验(limb hanging test)和肢体握力试验(limb grip strength test)。前者可用于前后肢功能的评价,尤其是颈段SCI后前肢肌肉功能评估。Diener等建立的肢体悬挂试验,其装置由15 cm长,2 mm直径的木棒构成。试验时将动物前爪轻放于一悬挂木棒上,通过检测动物紧握木棒的能力及时间来评价肢体肌力。与Tarlov法相比较,对于中度至轻重度损伤的动物模型,其评价结果准确性更高。缺点是对轻度或极重度损伤敏感性低,须与其他行为学方法结合使用。肢体握力试验的方法是通过试验动物紧握连有握力表的套圈,以握力表中读数衡量动物运动肌力恢复情况。Anderson等[24]指出肢体握力试验具有方便,可定量分析的特点,适用于颈段SCI模型的前肢运动功能评价,但不适用于重度损伤模型。Aguilar等[25]采用改良的肢体握力试验评价小鼠C5双侧SCI后前肢的运动功能。
9 联合评分法(combined behavioral score)
Gale等[26]在Tarlov法与斜板法相结合的基础上增加感觉、反射等一些指标建立了联合评分法(CBS),内容包括后肢运动、斜板试验、伸趾、回缩反应、热板试验和游泳等7项。各项数值代表SCI后神经功能丧失的百分比。CBS法能较为准确地综合评定SCI大鼠运动、感觉等多方面神经功能。缺点是所需设备较复杂、人为因素较多而不利于推广。此后Kerasidis等对CBS评分标准进行修正,删减了其中的“正常行走:0分”选项,将“后肢能负重,会步行1次或2次”改为“后肢能负重,会步行数次”,从而减少人为因素,提高了评分的可靠性。von Euler等在不同程度的脊髓压迫损伤模型上证实,采用CBS法和BBB法评价的运动功能结果与组织形态学改变有很好的相关性。Hara等[27]报道盐酸法舒地尔(异喹啉磺胺衍生物)治疗大鼠T3脊髓压迫损伤的疗效。研究中采用改良的CBS评价SCI动物的运动功能,结果药物组的行为学指标明显好于甲强龙对照组。国内学者研究了手术减压对大鼠慢性SCI的作用及相关机制,CBS结果表明手术减压治疗可促进脊髓运动神经元合成乙酰胆碱转移酶,改善动物运动功能。
临床SCI往往是多种类型的损伤相互并存,单纯某一类型的损伤并不多见。不同的脊髓损伤动物模型复制出不同类型的解剖结构损伤以及相应的行为学改变,以至于任何一种动物模型都不可能完全模拟临床SCI的特征。目前临床SCI神经运动功能的评价仍然沿用美国脊髓损伤学会/国际脊髓学会分级标准。内容包括神经系统检查的评价、辅助检查的评价(指影像学和电生理学检查)和日常生活能力的评价3个部分。神经系统检查的必检部分有神经损伤水平、感觉平面、运动平面、损伤程度评分、骶部残存、部分保留区、完全或不完全损伤和四肢瘫或截瘫。但是,这套分级标准仍存在局限性,如功能独立性评定不能完全反映损伤患者的恢复情况等。Chafetz等[28]报道如何提高运动感觉评分的精确性,指出不论医生在SCI领域的经验如何,接受正式的标准化培训是至关重要的。因此,理想的动物模型运动功能评价方法必须紧密结合临床实际SCI评价标准,首先受试对象个体影响小,能较好地对不同阶段的神经行为学改变作出准确判断;其次要求评价装置成本低廉,使用简便,实验耗时短。
[1]顾 兵,张 政,李华南,等.脊髓损伤动物模型的复制及其实验治疗学应用[J].中国药理学通报,2009,25(12):1559-63.
[1]Gu B,Zhang Z,Li H N,et al.Duplication of animal models for spinal cord injury and its application in experimental therapeutics[J].Chin Pharmacol Bull,2009,25(12):1559 -63.
[2]Li X F,Dai L Y.Three-dimensional finite element model of the cervical spinal cord:preliminary results of injury mechanism analysis[J].Spine,2009,34(11):1140 -7.
[3]Fehlings M G,Tator C H.The relationships among the severity of spinal cord injury,residual neurological function,axon counts,and counts of retrogradely labeled neurons after experimental spinal cord injury[J].Exp Neurol,1995,132(2):220 -8.
[4]Kazanci A,Seckin H,Karadeniz U,et al.Comparison of the effect of mexiletine and methylprednisolone on neural function and histopathological damage after transient spinal cord ischemia in rabbits[J].Turk Neurosurg,2010,20(1):43 -9.
[5]Liang Y,Yang Q H,Yu X D,et al.Additive effect of tetramethylpyrazine and deferoxamine in the treatment of spinal cord injury caused by aortic cross-clamping in rats[J].Spinal Cord,2011,49(2):302-6.
[6]Akdemir O,Uankale M,Karaolan A,et al.Therapeutic efficacy of SJA6017,a calpain inhibitor,in rat spinal cord injury[J].J Clin Neurosci,2008,15(10):1130 -6.
[7]Li Y,Oskouian R J,Day Y J,et al.Optimization of a mouse locomotor rating system to evaluate compression-induced spinal cord injury:correlation of locomotor and morphological injury indices[J].J Neurosurg Spine,2006,4(2):165-73.
[8]Pinzon A,Marcillo A,Quintana A,et al.A re-assessment of minocycline as a neuroprotective agent in a rat spinal cord contusion model[J].Brain Res,2008,1243:146 -51.
[9]Takeda M,Kawaguchi M,Kumatoriya T,et al.Effects of minocycline on hind-limb motor function and gray and white matter injury after spinal cord ischemia in rats[J].Spine(Phila Pa1976),2011,[Epub ahead of print].
[10]Metz G A,Merkler D,Dietz V,et al.Efficient testing of motor function in spinal cord injured rats[J].Brain Res,2000,883(2):165-77.
[11]Jia L Y,Yao A H,Kuang F,et al.Beneficial effect of the traditional chinese drug shu-xue-tong on recovery of spinal cord injury in the rat[J].Evid Based Complement Alternat Med,2011,pii:862197.Epub 2010 Sep 8.
[12]Sedý J,Urdzíková L,Jendelová P,Syková E.Methods for behavioral testing of spinal cord injured rats[J].Neurosci Biobehav Rev,2008,32(3):550-80.
[13]Hamers F P,Koopmans G C,Joosten E A.Catwalk-assisted gait analysisin the assessment of spinal cord injury[J].J Neurotrauma,2006,23(3-4):537-48.
[14]Salazar D L,Uchida N,Hamers F P,et al.Human neural stem cells differentiate and promote locomotor recovery in an early chronic spinal cord injury NOD-scid mouse model[J].PLoS One,2010,5(8):e12272.
[15]Li S X,Kim J E,Budel S,et al.Transgenic inhibition of Nogo-66 receptor function allows axonal sprouting and improved locomotion after spinal injury[J].Mol Cell Neurosci,2005,29(1):26 -39.
[16]Steward O,Sharp K,Yee K M,et al.A re-assessment of the effects of a Nogo-66 receptor antagonist on regenerative growth of axons and locomotor recovery after spinal cord injury in mice[J].Exp Neurol,2008,209(2):446 -8.
[17]Xu C J,Xu L,Huang L D,et al.Combined NgR vaccination and neural stem cell transplantation promote functional recovery after spinal cord injury in adult rats[J].Neuropathol Appl Neurobiol,2011,37(2):135-55.
[18]Cummings B J,Engesser-Cesar C,Cadena G,et al.Adaptation of a ladder beam walking task to assess locomotor recovery in mice following spinal cord injury[J].Behav Brain Res,2007,177(2):232-41.
[19]Soblosky J S,Song J H,Dinh D H.Graded unilateral cervical spinal cord injury in the rat:evaluation of forelimb recovery and histological effects[J].Behav Brain Res,2001,119(1):1 -13.
[20]Fiore C,Inman D M,Hirose S,et al.Treatment with the neurosteroid dehydroepiandrosterone promotes recovery of motor behavior after moderate contusive spinal cord injury in the mouse[J].J Neuronsci Res,2004,75(3):391 -400.
[21]Merkler D,Metz G A,Raineteau O,et al.Locomotor recovery in spinal cord-injured rats treated with an antibody neutralizing the myelin-associated neurite growth inhibitor Nogo-A[J].J Neurosci,2001,21(10):3665-73.
[22]Van Meeteren N L,Eggers R,Lankhorst A J,et al.Locomotor recovery after spinal cord contusion injury in rats is improved by spontaneous exercise[J].J Neurotrauma,2003,20(10):1029-37.
[23]Han X,Yang N,Xu Y,et al.Simvastatin treatment improves functional recovery after experimental spinal cord injury by upregulating the expression of BDNF and GDNF[J].Neurosci Lett,2011,487(3):255-9.
[24]Anderson K D,Abdul M,Steward O.Quantitative assessment of deficits and recovery of forelimb motor function after cervical spinal cord injury in mice[J].Exp Neurol,2004,190(1):184 -91.
[25]Aguilar R M,Steward O.A bilateral cervical contusion injury model in mice:assessment of gripping strength as a measure of forelimb motor function[J].Exp Neurol,2010,221(1):38 -53.
[26]Gale K,Kerasidis H,Wrathall JR.Spinal cord contusion in the rat:behavioral analysis of functional neurologic impairment[J].Exp Neurol,1985,88(1):123 -34.
[27]Hara M,Takayasu M,Watanabe K,et al.Protein kinase inhibition by fasudil hydrochloride promotes neurological recovery after spinal cord injury in rats[J].J Neurosurg,2000,93(1Suppl):94-101.
[28]Chafetz R S,Vogel L C,Betz R R,et al.International standards for neurological classification of spinal cord injury:training effect on accurate classification[J].J Spinal Cord Med,2008,31(5):538-42.
