骨癌痛大鼠鞘内注射U0126的抗痛觉过敏作用
2011-06-09李彩芳杨建平王丽娜胡计嬅刘思兰
李彩芳,杨建平,王丽娜,刘 磊,胡计嬅,刘思兰
(苏州大学附属第一医院麻醉科,江苏苏州 215006)
2002年第10届世界疼痛学会将疼痛列为心率、血压、体温和呼吸后的第五大生命体征。疼痛,尤其是慢性疼痛,正越来越严重的影响着患者的生活质量。在所有慢性疼痛患者中,最急需治疗的是癌痛患者,因此,对癌痛的治疗及产生机制的研究越来越重要。细胞外信号调节激酶(extracellular signal-regulate kinase,ERK)是 MAPK家族中的一员,介导多种信号的胞内转导,已在不同的疼痛模型中发现磷酸化ERK表达增加,用其上游激酶MEK的阻滞剂能减轻模型大鼠的痛敏表现,提示其活性的变化与伤害性刺激的传递及神经敏感化有关[1-2]。本研究拟观察鞘内注射丝裂原激活蛋白激酶激酶(MEK)阻滞剂U0126对骨癌痛(bone cancer pain,BCP)大鼠痛行为和脊髓背角磷酸化CREB(pCREB)表达的影响,探讨ERK-CREB通路在骨癌痛中的作用。
1 材料与方法
1.1实验动物成年♀Sprague-Dawley大鼠,体质量150~180 g,由苏州大学医学院实验动物中心提供。许可证号SYXK(苏)2007-0035。动物在适应环境1周后开始实验。实验室光照时间08:00~20:00,温度控制在(18~22)℃,湿度40% ~60%。单笼饲养,自由饮水摄食。所有实验均在光照期间完成。
1.2主要药品和仪器U0126(Sigma公司,USA);兔抗pCREB抗体、免疫组化试剂盒(Santa Cruz公司,USA)。Von-Frey毛针触痛觉检测仪 (BME-403,中国医学科学院生物工程研究所);Walker256细胞为本实验室冻存;溶媒为5%二甲亚砜(DMSO)。
1.3方法
1.3.1建造大鼠骨癌痛模型按照本实验室方法[3]建立大鼠骨癌痛动物模型,大鼠胫骨干骺端打孔向骨髓腔缓慢注入Walker256细胞悬液制作成功。术后分笼饲养。室温维持20~25℃,自然照明,自由饮水和摄食。假模型组以相同容量Hanks液代替细胞悬液。
1.3.2大鼠脊髓蛛网膜下腔置管骨癌痛模型术后 2 d,大鼠用水合氯醛(350 mg·kg-1,ip)麻醉后,根据杨建平等[4]的方法并加以改进,进行蛛网膜下腔置管,采用L3~4法。大鼠单笼饲养。出现下肢跛行瘫痪、局部感染、活动异常、导管脱落等异常的大鼠及其数据摒弃不用。
1.4第一部分分组和观察指标
1.4.1分组40只大鼠,随机均分为5组(n=8):Ⅰ组在大鼠胫骨注Hanks液制作为假模型组,单次鞘内注射10 μg U0126,组Ⅱ、Ⅲ、Ⅳ和Ⅴ在大鼠胫骨注肿瘤细胞制作骨癌痛动物模型10 d后分别鞘内注射 5% 二甲亚砜(DMSO)10 μl和 U0126 0.1、1、10 μg(均溶于 10 μl 5%DMSO)。
1.4.2行为学测定造模术前及术后1、3、5、7、9 d测定大鼠双侧后肢机械性缩足阈值(mechanical withdrawal threshold,MWT)。每天早、中、晚测3次,取平均值。鞘内给药后 1、3、6、9、24 h测定大鼠术侧后肢的机械性缩爪阈值。机械性痛敏采用Chaplan等[5]的方法测定50%缩足阈值,大鼠适应环境30 min后用一系列von Frey毛针触痛觉检测仪刺激双侧后肢足底中部,如大鼠在刺激时或移开von Frey纤维丝时出现快速缩足或舔足反应为阳性反应,每次间隔30 s,以15 g为上限。用天平和有机玻璃自制成大鼠后肢负重测量仪,取两后肢负重差(weight bearing different,WBD),左右分别测量3次,两次实验之间至少间隔5 min,取平均值[6]。
1.5第二部分分组和观察指标
1.5.1分组25只大鼠,随机平分为5组(n=5):T1、T2和T3组在制作大鼠骨癌痛动物模型10 d后,鞘内注射 U0126 10 μg 后 1、6、24 h 处死大鼠取材,M组为模型对照组,鞘内注射5%DMSO 10 μl后6 h处死大鼠,另5只在大鼠胫骨注Hanks液制作为假模型大鼠作为空白对照组(S组),鞘内注射5%DMSO 10 μl后6 h 处死取材。
1.5.2免疫组织化学采用免疫组织化学方法测定术侧脊髓背角pCREB免疫反应阳性神经元数量。大鼠腹腔注射水合氯醛400 mg·kg-1深麻醉后,经主动脉灌注生理盐水100 ml,4%多聚甲醛400 ml继续灌注,取L4-5脊髓,在丙酮中后固定3 h。采用KEDEE KD-Ⅱ型冰冻切片机(浙江金华)将脊髓制成30 μm 切片,将切片收集在0.01·mol·L-1PBS中,破膜剂Triton×100破膜5 min,3%过氧化氢25 min,漂洗后5%正常羊血清室温孵育,再漂洗后滴加兔抗pCREB(1∶400)(Santa Cruz公司,美国),4℃孵育24 h后,PBS冲洗,滴加生物素标记的羊抗兔IgG,37℃孵育2 h后PBS冲洗,滴加辣根酶标记链霉卵白素,37℃孵育2 h后PBS冲洗,DAB显色,贴片,乙醇梯度脱水,二甲苯透明,中性树胶封片,光镜下观察。阴性对照实验中,用PBS代替一抗或二抗。进行pCREB阳性神经元计数。
1.6统计学处理计量资料以±s表示,采用SPSS13.0统计软件处理,组内比较采用配对t检验,组间比较采用单因素方差分析。
2 结果
2.1 MWT测定骨癌痛组(Ⅱ,Ⅲ,Ⅳ,Ⅴ)术后7 d及以后MWT较假模型组(Ⅰ)明显下降。Ⅰ组大鼠鞘内注射U0126 10 μg后对MWT没有影响。Ⅳ组在用药后6 h、Ⅴ组用药后3、6 h和9 h与Ⅱ组MWT比较有明显差异,提示鞘内注射U0126 10 μg后可减轻骨癌痛所致的机械性痛敏,作用可持续至用药后9 h。见Fig 1。

Fig 1 Changes of MWT in different time points before and after model made(±s,n=8)
2.2WBD测定Ⅰ组大鼠鞘内注射U0126 10 μg后对WBD没有影响。骨癌痛组(Ⅱ,Ⅲ,Ⅳ,Ⅴ)术后7 d及以后WBD较假模型组明显增高。Ⅱ组鞘内注射5%二甲亚砜10 μl后WBD无变化,Ⅲ组、Ⅳ组、Ⅴ组鞘内应用不同剂量U0126后3、6 h和9 h较用药前时点的WBD减小,差别有统计学意义。用药后24 h后与用药前时点的WBD比较无统计学意义。见Fig 2。
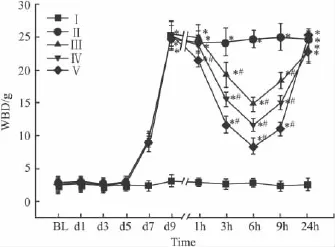
Fig 2 Changes of WBD in different time points before and after model made(±s,n=8)
2.3形态学免疫组化染色可见模型组大鼠与假模型组比较,脊髓背角内pCREB免疫阳性神经元增多,且多为双侧全层分布,多数pCREB阳性神经元位于背角浅层。鞘内注射10 μg U0126可以减少脊髓背角pCREB表达,于用药后6 h表现最为明显。见 Fig 3、4。

Fig 3 Changes in the positive cell numbers of pCREB in dorsal horn of the spinal cord in rats(±s,n=5)
3 讨论
本实验中,将腹水细胞传代培养的Walker256癌细胞种植于同系的SD大鼠后肢胫骨上端骨髓腔以建立骨转移性癌痛模型,造模术后7 d开始患侧出现MWT进行性降低和WBD进行性增高,呈现明显的机械性痛觉过敏和机械性痛觉超敏,提示模型制作成功。
以往的研究中,在不同的疼痛模型(辣椒素、完全氟氏佐剂致炎、内脏痛、电刺激等)均发现ERK通路参与了中枢敏感化的形成和发展[2-3,6-8]。U0126是一种常用的MAPKK(有丝分裂素激活蛋白激酶激酶)抑制剂,它可以通透细胞,与MEK非竞争结合,抑制活化酶的催化活力,从而阻止ERK1/2(即p44/42 MAPK)的磷酸化和激活。有研究证实,在炎性痛和病理性痛大鼠模型,鞘内注射MEK特异性阻滞剂U0126到背根神经节神经元能够抑制背根神经节神经元细胞体ERK的磷酸化[7-8]。在本研究中,根据文献[7]选择3种不同剂量U0126及其溶剂5%DMSO对大鼠进行鞘内注射,发现5%DMSO对大鼠痛行为没有影响,10 μg U0126可以明显降低MWT,鞘内注射不同剂量U0126后对WBD的影响也有显著性意义,由此可以看出,鞘内注射较大剂量MEK特异性阻滞剂U0126可以明显减轻大鼠的痛行为,由此也可证实ERK通路参与了骨癌痛。
ERK可以转位进入核内磷酸化转录因子CREB,调节目的基因的表达[9],从而在痛觉敏化中发挥作用。其机制可能在于ERK被激活后从胞质移位到核内,激活Rsk2,接着将Ser133中的转录因子CREB磷酸化,CREB磷酸化后与DNA上启动子区域中的cAMP反应元件位点结合,进而启动基因转录[10]。CREB作为一种核内转录因子,参与多种生物分子基因表达的调控,其中的如c-fos、内啡肽、NK-1受体、COX-2、BDNF等的表达在各种伤害性刺激引起的脊髓神经元长时程可塑性变化中发挥重要作用[11-13]。本研究的免疫组化结果显示,骨癌痛组大鼠脊髓背角pCREB表达较假模型组增多,鞘内注射U0126能明显抑制模型组大鼠脊髓pCREB表达的增多,这种作用在用药后6 h最为明显,可以推测CREB可能参与介导了骨癌痛。
本研究中,骨癌痛组大鼠鞘内注射U0126后机械痛敏得到缓解,pCREB表达也明显减少,但仍较假模型组高,这可能是由于其他机制如脊髓胶质细胞的活化[14]等也参与了骨癌痛的形成有关。
综上所述,ERK及其下游的CREB可能参与介导了大鼠骨癌痛的形成与维持。

Fig 4 Different expression of pCREB in the dorsal horn of spinal cord in rats
[1]Rygh L J,Tjolsen A,Hole K,et al.Cellular memory in spinal nociceptive circuitry[J].Scand J Psychol,2002,43:153 -9.
[2]Ji R R,Woolf C J.Neuronal plasticity and signal transduction in nociceptive neurons:implications for the initiation and maintenance of pathological pain[J].Neurobio Dis,2001,8:1 -10.
[3]姚 明,杨建平,王丽娜,等.腹水传代与体外培养Walker 256癌细胞系建立大鼠骨癌痛模型的可行性[J].中华医学杂志,2008,88(13):880 -4.
[3]Yao M,Yang J P,Wang L N,et al.Feasibility of establishment of rat model of bone cancer pain by using Walker 256 cells culturedin vitroorin vivo[J].Nat Med J China,2008,88(13):880 -4.
[4]杨建平,蒋 豪,吴 珏.大鼠蛛网膜下腔埋管并长期留置操作的改进[J].中华麻醉学杂志,1993,13(2):110 -2.
[4]Yang J P,Jiang H,Wu J.Improvement of burying and detaining tube for long time in rat subarachnoid space[J].Chin J Anesthesiol,1993,13(2):110.
[5]Ji R R,Befort K,Brenner G J,et al.ERK MAP kinase activation in superficial spinal cord neurons induces prodynorphin and NK-1 upregulation and contributes to persistent inflammatory pain hypersensitivity[J].Neurosci,2002,22(2):478 -85.
[6]Zhu C Z,Hsieh G,Ei-Kouhen O,et al.Role of central and peripheral mGluR5 receptors in post-operative pain in rats[J].Pain,2005,114(1-2):195 -202.
[7]Seino D,Tokunaga A,Tachibana T,et al.The role of ERK signaling and the P2X receptor on mechanical pain evoked by movement of inflamed knee joint[J].Pain,2006,123:193 -203.
[8]Ji R R.Mitogen-activated protein kinases as potential targets for pain killers[J].Curr Opin Investig Drugs,2004,5(1):71 - 5.
[9]Hoeger-Bement M K,Sluka K A.Phosphorylation of CREB and mechanical hyperalgesia is reversed by blockade of the cAMP pathway in a time-dependent manner after repeated intramuscular acid injections[J].Neurosci,2003,23:5437 -45.
[10]Lonze B E,Ginty D D.Function and regulation of CREB family transcription factors in thenervous system [J].Neuron,2002,35(4):605-23.
[11]White D M,Walker S,Brenneman D E,Gozes I.CREB contributes to the increased neurite outgrowth of sensory neurons induced by vasoactive intestinal polypeptide and activity dependent neurotrophic factor[J].Brain Res,2000,868(1):31 -8.
[12]Miletic G,Pankratz M T,Miletic V.Increases in the phosphorylation of cyclic AMP response element binding[rotein(CREB)and decreases in the content of calcineyrin accompany thermal hyperalgesia following chronic constriction injury in rats[J].Pain,2002,99(3):493-500.
[13]Milligan E D,Twining C,Chacur M,et al.Spinal glia and proinflammatory cytokines mediate mirror-image neuropathic pain in rats[J].J Neurosci,2003,23(3):1026 -40.
[14]唐元章,申 文,刘 苏,等.抑制小胶质细胞激活对骨癌痛小鼠疼痛维持的影响[J].中国药理学通报,2009,25(1):104-8.
[14]Tang Y Z,Shen W,Liu S,et al.Inhibition of microglia activation affected the maintenance of cancer pain in a murine model[J].Chin Pharmacol Bull,2009,25(1):104 -8
