革皮氏海参皂苷抑制血管新生作用
2011-06-09薛长湖王玉明王静凤
赵 芹,薛长湖,张 珣,董 平,王玉明,王静凤
(中国海洋大学食品科学与工程学院,山东青岛 266003)
血管新生(angiogenesis)是指从已存在的微血管床上芽生出新的以毛细血管为主的血管系统的过程[1]。它在人体正常发育和许多疾病的发生发展中发挥重要作用,尤其与肿瘤的形成及转移关系密切。新生血管能使肿瘤组织及时获得各种营养及排出废物,促进其自身的分裂与增殖,并为肿瘤细胞向周围组织转移提供了通路。因此,如能抑制肿瘤细胞诱导的新生血管的形成,将阻断肿瘤细胞的供养和排泄通路,抑制其无休止的生长,同时亦能降低其向周围组织转移的可能性[2]。近年来,探讨肿瘤新生血管形成机制已成为目前肿瘤研究领域的又一个重要课题。
革皮氏海参(Pearsonothuria graeffei)归属楯手目(Aspidochirotida)海参科(Holothuriidae)革皮氏海参属(Pearsonothuria),是一种皂苷含量高的低值海参,可作为海参皂苷的良好来源。海参皂苷是海参体壁中重要的活性成分之一,具有多种生物活性如对肿瘤细胞[3]的细胞毒作用、保护肝损伤[4]、免疫调节[5]和抗真菌活性[6],而其明显的抗肿瘤作用也得到了广泛的研究和认可[7-9]。本实验利用从革皮氏海参中经大孔树脂、反复正反相硅胶柱层析、高效液相分离得到的三萜皂苷holothurin A1(HA)和24-dehydroechinoside A(DA)为研究对象,比较研究了HA和DA的抗血管新生作用并初步探讨其构效关系,为深入挖掘海参皂苷的药用价值,推动革皮氏海参高值化加工利用和深度开发提供理论依据。
1 材料与方法
1.1材料革皮海参皂苷单体HA和DA,由中国海洋大学食品科学与人类健康实验室董平博士提供。采用电喷雾-质谱、红外光谱、核磁共振谱等光谱和化学手段鉴定其结构,测得其化学结构式分别为C54H87O27SNa和C54H85O26SNa,相对分子量分别为1 222和1 204。刚受精未孵化的鸡蛋,购于青岛奥特养殖场。人脐静脉内皮细胞株HUVEC,购自上海午立生物技术有限公司;人肝癌细胞HepG2,购自山东省医学科学院基础研究所。
1.2药品RPMI 1640培养基、F-12K培养基和新生牛血清,购自美国Gibco公司;胎牛血清购自美国Hyclone公司;胰蛋白酶和MTT,购自美国 Amresco公司;Matrigel,购自美国BD公司。吖啶橙(AO)和溴乙锭(EB),购自美国Sigma公司。
1.3仪器CO2培养箱(BJ5060UV),德国Heraeus公司产品;超净工作台(DL-CJ-1N),北京东联哈尔仪器制造有限公司产品;倒置显微镜系统(IX51),正置显微镜系统(BX41),日本Olympus公司产品;酶标仪(680型),日本BIO-RAD公司产品。
1.4实验方法
1.4.1细胞培养HUVEC细胞和HepG2细胞,分别培养于含体积分数为10%胎牛血清的F-12K培养基和含10%新生牛血清的RPMI 1640培养基,其中均含1×105U·L-1青霉素和 1 ×105μg·L-1硫酸链霉素。于37℃、5%CO2孵箱中常规传代贴壁培养。以0.25%的胰酶消化传代,取对数生长状态的细胞进行实验。
1.4.2对HUVEC细胞增殖活性的影响取对数生长期的HUVEC细胞,经胰酶消化,以F-12K完全培养基配成密度为8×107·L-1的细胞悬液,每孔100 μl接种于96孔板内。24 h后,弃培养基,分别加入含不同浓度HA和DA的完全培养基,每孔200 μl,每个浓度4个复孔。HA的浓度分别为0、0.82、1.64、2.45、3.27、4.09、4.91 和 5.73 μmol·L-1,DA的浓度分别为 0、0.83、1.66、2.49、3.32、4.15、4.99和 5.81 μmol·L-1,分别培养 6、12、24 和 48 h。于实验结束前4 h加MTT(终浓度0.5 g·L-1),继续培养4 h后,吸弃培养基,加入酸化异丙醇200 μl/孔,吹打至蓝色结晶完全溶解,于酶标仪570 nm处测定吸光度(A)值。以样品组A值/对照组A值×100%表示细胞增殖活性。
1.4.3对HUVEC细胞形态学的影响取对数生长期的HUVEC细胞,调整细胞浓度为8×107·L-1,接种于96孔培养板内,贴壁24 h后,分别加入含 HA、DA(浓度均为 2.45、4.90 μmol·L-1)的完全培养液,对照组加入等体积的完全培养液,200 μl/孔,分别于12、24 h倒置显微镜观察,拍照。
1.4.4对HUVEC细胞凋亡形态的影响取对数生长期的HUVEC细胞,调整细胞密度至2.5×108·L-1,接种于6孔培养板内,每孔2 ml。培养24 h后,弃培养液,分别加入含HA、DA(浓度均为2.45、4.90 μmol·L-1)的完全培养液,对照组加入等体积的完全培养液。作用6、12 h后收集细胞,PBS洗涤2 次。取AO(100 mg·L-1)和EB(100 mg·L-1)等体积混匀制成AO-EB荧光染液。将细胞稀释至109·L-1,每100 μl细胞加入4 μl AO-EB 荧光染液,作用30 s,涂片后,荧光显微镜下观察、拍照。
一个是前面提到的分税制问题,再有一个就是中央与地方的职能究竟该怎么样进行定位?我们经常讲财权和事权相匹配,“做多少事拿多少钱”,这应该是合理的。但是现在存在中央与地方政府责任划分不甚清晰,事权和财权划分不合理,以及中央与地方的转移支付不规范的问题。很多转移支付都是专项转移支付而不是一般性的,不是根据这个特定地区的财政经济、公共事业的发展差异来进行公共事业的均等化方式来分配的。
1.4.5对HUVEC细胞体外小管形成的影响将Matrigel用无血清培养基按1∶4稀释后加入96孔板内,每孔50 μl,于37℃聚合1h。取对数生长期的HUVEC细胞,用胰酶消化,PBS洗涤,重悬在含有2%胎牛血清的F-12K培养基中,调整细胞密度,按1×104个/孔加入96孔板。分别加入含 HA、DA(浓度均为 2.45、4.90 μmol·L-1)的 F-12K 培养基(含有2%胎牛血清),对照组加入F-12K培养基(含有2%胎牛血清)。培养24、96 h后,采用倒置显微镜观察、照像。
1.4.6对HepG2细胞同HUVEC细胞间黏附的影响取对数生长期的HUVEC细胞,调整细胞密度为 2 ×108·L-1,接种于 96 孔板中,100 μl/孔,24 h后细胞长成单层。使用前吸出旧培养基,使用前用PBS洗涤1~2次。HepG2细胞经HA和DA预处理后,用无血清培养基调整细胞密度为2×108·L-1,加入长有HUVEC细胞单层的96孔培养板中,100 μl/孔。37℃,5%CO2孵育 90 min后,用 PBS洗2遍,加入MTT,继续培养4 h。吸弃培养基,每孔加入200 μl酸化异丙醇,吹打至蓝色结晶完全溶解,用酶标仪测OD570值,计算黏附率。

1.4.7对鸡胚尿囊膜(chicken chorioallantoic membrane,CAM)血管生长的影响挑选同一批刚受精未孵化的鸡蛋,用新洁尔灭洁净外壳后,移入37℃孵箱中孵化。种蛋钝端呈45°角向上,每隔2 h翻蛋1次。孵化至d 9,在种蛋的钝端轻轻开窗揭去外壳和外壳膜,露出气室。加入少量Hanks液轻轻吹打使内壳膜与尿囊膜分离,仔细揭去内壳膜后暴露出尿囊膜。用打孔器打出直径1 cm的圆滤纸片,灭菌后在Hanks液中浸泡30 min。将滤纸片放于CAM上血管较稀疏的位置,分别在滤纸片上加入20 μl Hanks液稀释的HA和DA溶液(浓度均为14.32、28.69 μmol·L-1),对照组加入等体积的 Hanks液。用无菌封口膜封口,造成假气室。37℃孵箱中孵育24 h后移去封口膜和滤纸,在尿囊膜上滴加2.5%的戊二醛,室温下固定30 min。用眼科剪以滤纸为中心剪下尿囊膜,解剖镜下观察血管生长情况并拍照。
1.4.8统计学分析实验结果用±s表示。采用SPSS11.0软件进行单因素方差分析,并采用LSD进行两两比较。
2 结果
2.1对HUVEC细胞增殖活性的影响如Fig 1中所示,HA、DA可抑制HUVEC细胞的增殖活性,在48 h内呈现时间和剂量依赖效应。HA在24、48 h的 IC50值分别为 5.60 μmol·L-1和 4.80 μmol·L-1;DA 在24 和48 h 的 IC50值分别为 4.88 μmol·L-1和 3.82 μmol·L-1。表明 HA 和 DA 均可抑制内皮细胞的增殖活性。其中,DA活性强于HA。
形态学观察显示对照组的HUVEC细胞呈现良好的贴壁性,细胞呈铺路石状生长,细胞间隙紧密、轮廓清楚,折光性好,细胞生长旺盛。细胞经HA和DA处理后,细胞形态发生明显变化:作用12 h后,低剂量组细胞变圆,细胞膜边缘模糊,贴壁性丧失;经过24 h作用后,细胞核明显固缩,部分细胞的细胞膜开始穿孔,整个细胞立体结构丧失,或者呈扁平状贴在底面,或者脱落、漂浮在培养基中。表明HA和DA能够诱导内皮细胞骨架损伤,降低其贴壁黏附能力。

Fig 1 Effects of HA and DA on the proliferation activities of HUVEC cells
2.2对HUVEC细胞凋亡的形态学观察结果如Fig 2所示。对照组HUVEC细胞的细胞核边缘光滑,核质分布均匀,呈均匀的绿色荧光,表明对照组细胞处于良好的生长状态。加入HA和DA作用12、24 h后,低剂量组开始出现明显的核固缩,出现橙黄色致密浓染,表明细胞进入了凋亡阶段;高剂量组大量细胞核呈橙色固缩状,表明进入了晚期凋亡阶段的细胞明显增多。各剂量组无均匀的红色细胞核,表明HA和DA不会引起HUVEC细胞的坏死。说明HA和DA能诱导血管内皮细胞的凋亡,抑制内皮细胞的增殖。

Fig 2 The apoptosis of HUVEC cells induced by HA and DA
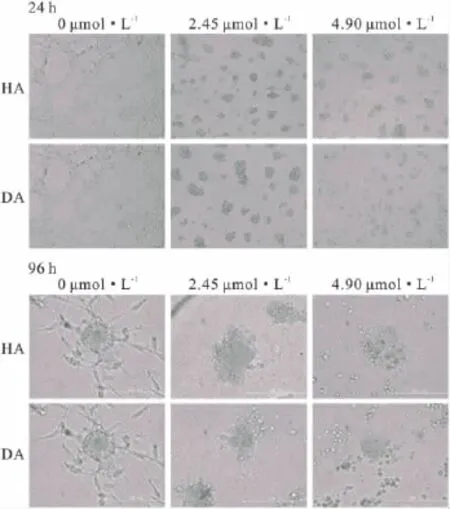
Fig 3 The effects of HA and DA on the tube formation ability of HUVEC cells
2.4对HepG2和HUVEC细胞间黏附的影响结果如Tab 1所示。与对照组相比,HA和DA细胞同HUVEC细胞间的黏附率明显降低。作用24 h后,HA和DA高剂量组细胞同HUVEC细胞间的黏附率分别下降到31.6%(P<0.01)和30.8%(P<0.01),且呈现明显的时间和剂量依赖效应。说明HA和DA可降低HepG2细胞同HUVEC间的黏附能力,其中,DA活性强于HA。

Tab 1 The effects of HA and DA on the adhesion ability of HepG2 cells and HUVEC cells
2.5对鸡胚绒毛尿囊膜血管生长的影响结果如Fig 4所示。对照组的鸡胚绒毛尿囊膜上的血管生长发育旺盛,产生大量的新生血管,血管分支多且清晰。HA和DA作用后,从主血管处长出的分支血管明显减少,分支血管长度减小,并伴有轻微的溶血现象。说明HA和DA明显抑制了鸡胚尿囊膜上的血管发育,具有抑制血管新生的活性。

Fig 4 The effects of HA and DA on the angiogenesis of CAM
3 讨论
肿瘤细胞的恶性生物学行为主要表现在无限性生长和向周围组织浸润转移[2],而新生血管形成是肿瘤增殖及血行播散的关键。因此,如能抑制新生血管的形成将是肿瘤治疗的有效途径。已有研究表明,针对目前肿瘤临床治疗中所采用的新辅助化疗的方法,可通过抑制新生血管的形成,以降低实体肿瘤的分期,使大的实体瘤退缩[10],使一些原不能手术切除的肿瘤转化为能手术切除,同时抑制转移灶的形成[11]。本实验表明HA和DA均可诱导血管内皮细胞凋亡,抑制内皮细胞小管形成能力,降低血管内皮细胞与肿瘤细胞间的黏附能力,抑制鸡胚尿囊膜上的新生血管发育,具有明显的抗血管新生作用。
肿瘤新生血管形成过程涉及ECM的降解、血管内皮细胞增殖、细胞外基质活化、内皮细胞向肿瘤组织内的迁移、新生血管管腔的形成、毛细血管环出现和血管壁形成等一系列精细而复杂的细胞和分子机制[12]。此过程受到多种促血管生成因子(如VEGF)、抑血管生成因子和相关基因的调控[13]。易杨华等从我国特有的一种海参中分离纯化得到硫酸化海参皂苷philinopside A,药理研究结果表明它能抑制内皮细胞HMEC-1的增殖和管腔形成,抑制内皮细胞的迁移和兔眼角膜和鸡胚尿囊膜新生血管生成,其作用机制与其抑制受体酪氨酸蛋白激酶(receptor tyrosine kinases,RTKs)蛋白的表达相关[14]。Tian等[15]研究发现,一种海参硫酸化皂苷PE具有抑制血管新生和肿瘤的生长的活性,其机制可能在于抑制KDR的磷酸化。PE还对KDR的下游信号有抑制作用,可与 KDR的胞外域结合,阻止其与VEGF的相互作用。本实验中所用HA和DA在结构上同属硫酸化海参皂苷,提示其抗血管新生的活性可能与RTKs以及VEGF/VEGFR信号通路相关,其详细的作用机制尚需进一步研究。
海参皂苷作为一类很有前景的抗肿瘤先导化合物[16-19],在化学结构上归属于羊毛甾烷型三萜皂苷,苷元一般为18(20)内酯环称为海参烷型(holostane),偶有18(16)位内酯环或无内酯环结构,称为非海参烷型(nonholostane)。本实验所用样品HA和DA均是海参烷型三萜皂苷,其糖链结构完全相似,苷元部分结构分别为3β,12α,17α,22β–四羟基–9(11)–烯–海参烷和3β,12α,17α–三羟基–22(25)–环氧–9(11)– 烯–海参烷[20]。实验结果显示DA抑制血管新生的能力强于HA,说明苷元在侧链上C-22的羟基取代降低了皂苷抑制肿瘤血管新生的能力,位于侧链的24(25)位的双键可促进皂苷抑制肿瘤血管新生的能力。
综上所述,革皮氏海参皂苷HA和DA均能明显地抑制血管新生,其抑制血管新生的活性与结构上的差异有关。
[1]周立江,殷东风.中医药抗肿瘤血管生成实验研究进展[J].辽宁医学杂志,2008,22(5):257-9.
[1]Zhou L J,Yin D F.Advance of research on anti-angiogenesis activity of traditional Chinese Medicine[J].Med J Liaoning,2008,22(5):257-9.
[2]Peter C,Rakesh K J.Angiogenesis in cancer and other diseases[J].Nature,2000,407(6801):249 -57.
[3]Jun O J,Valeria V S,Sung W S,et al.Differential effects of triterpene glycosides,frondoside A and cucumarioside A2-2 isolated from sea cucumbers on caspase activation and apoptosis of human leukemia cells[J].FEBS Lett,2009,583(4):697 -702.
[4]Norio I,Yasuhiro M,Tetsuya T,et al.Metallothionein induction and hepatoprotection by echinoside A and sakuraso-saponin[J].Phytother Res,1998,11(2):132 -5.
[5]王静凤,傅 佳,王玉明,等.革皮氏海参皂苷对小鼠免疫功能的调节作用[J].中国海洋大学学报:自然科学版,2010,40(2):28-32.
[5]Wang J F,Fu J,Wang Y M,et al.Effects of Saponins of Pearsonothuria graeffei on immune regulation in mice[J].Period Ocean Univ China,2010,40(2):28 -32.
[6]张诗龙,李 玲,易杨华,等.子安辐肛参皂苷lecanoroside A和C的抗真菌和抗肿瘤活性[J].中国药理学通报,2010,26(6):839-40.
[6]Zhang S L,Li L,Yi Y H,et al.Studies on antifungal and antitumor activities of lecanoroside A and C fromActinopyga lecanora[J].Chin Pharmacol Bull,2010,26(6):839 -40.
[7]Maier M S,Roccatagliata A J,Kuriss A,et al.Two new cytotoxic and virucidal trisulfated triterpene glycosides from the Antarctic sea cucumber Staurocucumis liouvillei[J].J Nat Prod,2001,64(6):732-6.
[8]王晓华,李 玲,易杨华,等.花刺参中两个新的三萜皂苷[J].中国天然药物,2006,4(3):176 -80.
[8]Wang X H,Li L,Yi Y H,et al.Two new triterpene glycosides from sea cucumber Stichopus variegatus Semper[J].Chin J Nat Med,2006,4(3):176-80.
[9]巫 军,易杨华,吴厚铭,等.黑乳海参皂苷nobiliside A的体外抗真菌及抗肿瘤活性[J].中国药理学通报,2007,23(1):139-40.
[9]Wu J,Yi Y H,Wu H M,et al.Studies on thein vitroantifungal and antitumor activities of nobiliside A from the sea cucumber Holothuria nobilis Selenka[J].Chin Pharmacol Bull,2007,23(1):139-40.
[10]Kuerer H M,Newman L A,Fornage B D,et al.Role of axillary lymph node dissection after tumor downstaging with induction chemotherapy for locally advanced breast cancer[J].Ann Surg Oncol,1998,5(8):673 - 80.
[11]李晴宇,王 刚.地非三唑抑制血管新生作用的研究[J].中国现代应用药学,2007,24(8):688 -91.
[11]Li Q Y,Wang G.Antiangiogenesis Effect of DL111-ITin vivoandin vitro[J].Chin J Mod Appl Pharm,2007,24(8):688 -91.
[12]刘文峰,徐 光,何 跃,等.肿瘤微转移的机制与检测[J].西南军医,2010,12(4):735 -7.
[12]Liu W F,Xu G,He Y,et al.The mechanisms and detection of tumour micrometastasis[J].J Mil Surg Southwest China,2010,12(4):735-7.
[13]Kirsch M,Schackert G,Black P M.Angiogenesis,metastasis,and endogenous inhibition[J].J Neuro-Oncol,2000,50(1 - 2):173-80.
[14]Tong Y,Zhang X,Tian F,et al.Philinopside A,a novel marinederived compound possessing dual anti-angiogenic and anti-tumor effects[J].Int J Cancer,2005,114(6):843 -53.
[15]Tian F,Zhang X,Tong Y,et al.P E,a new sulfated saponin from sea cucumber,exhibits anti-angiogenic and anti-tumor activitiesin vitroandin vivo[J].Cancer Biol Ther,2005,4(8):874 -82.
[16]姜 健,杨宝灵,邰 阳.海参资源及其生物活性物质的研究[J].生物技术通讯,2004,15(5):537 -9.
[16]Jiang J,Yang B L,Tai Y.Studies on resources and bioactive substances of sea cucumber[J].Lett Biotechnol,2004,15(5):537-9.
[17]邹峥嵘,易杨华,姚新生,等.二色桌片参皂苷 intercedenside A的抗真菌和抗肿瘤活性[J].中国药理学通报,2005,21(6):761-2.
[17]Zou Z R,Yi Y H,Yao X S,et al.Studies on the antifungal and antitumor activities of the intercedenside A from Mensamaria intercedens Lampert[J].Chin Pharmacol Bull,2005,21(6):761 -2.
[18]张佳佳.黑乳海参皂苷nobiliside B及单乙酰化物体外抗肿瘤活性研究[J].中国海洋药物,2009,28(1):41 -3.
[18]Zhang J J.Antitumor effects of nobiliside B from sea cucumber Holothuria nobilis and its acetoxy compounds[J].Chin J Marine Drugs,2009,28(1):41 -3.
[19]樊廷俊,袁文鹏,丛日山,等.仿刺参水溶性海参皂苷的分离纯化及其抑瘤活性研究[J].药学学报,2009,44(1):25 -31.
[19]Fan T J,Yuan W P,Cong R S,et al.Studies on the purification of water-soluble holothurian glycosides from Apostichopus japonicus and their tumor suppressing activity[J].Acta Pharm Sin,2009,44(1):25-31.
[20]董 平.革皮氏海参(Pearsonothria graeffei)皂苷化合物的分离鉴定、结构修饰及活性研究[D].青岛:中国海洋大学,2008.
[20]Dong P.Studies on the isolation,identification,structure-modification and bioactivities of triterpene glycosides in Pearsonothria graeffei[D].Qingdao:Ocean University of China,2008.
