外源性血栓粒径对大鼠脑血栓损伤的影响
2011-06-09张恒艾时丽丽陈柏年于晓彦杜冠华
张恒艾,高 梅,时丽丽,陈柏年,于晓彦,杜冠华
(中国医学科学院·北京协和医学院药物研究所,国家药物筛选中心北京 100050)
中风是目前导致人类死亡的主要原因之一,脑缺血一直是医学研究的热点[1]。缺血性中风占中风的87%,而血栓栓塞是引起缺血性中风的重要原因,因此,大鼠血栓栓塞性中风模型是研究缺血性中风比较理想的动物模型。国内外文献报道,脑内注射栓子可导致栓塞性中风,多种人工制备的栓子如同种异体血栓、凝血酶、银质微球、胆固醇结晶和聚乙烯微球等不同材质的栓子用于制备栓塞性中风动物模型,对于栓子的大小和注入量的多少也有报道[2-5],但对于栓塞的大小目前还缺乏统一,关于栓子粒径与大鼠脑损伤的相关性也未见报道。
同种异体血液自发性形成的血栓制备动物脑缺血模型具有明显的优势,并有报道指出,tPA可使自发形成的血栓造成的栓塞迅速再灌,但不能使采用凝血酶制备的栓子形成的栓塞迅速再灌[6]。因此,为了制备适合于评价药物作用的脑缺血动物模型,本文采用自发形成的3种不同粒径同种异体血栓经颈外动脉注射方法制备脑缺血模型,并研究血栓粒径对大鼠脑损伤的影响。
1 材料与方法
1.1动物模型与分组♂SD大鼠52只,体质量250~300 g,购自北京维通利华实验动物技术有限公司。控制室温23℃ ~25℃,自由进食和饮水,适应3 d后进行实验。随机分成正常组(normal,n=10),假手术组(sham,n=10),大粒径模型组(D=150~178 μm,Group L,n=11),中粒径模型组(D=74~124 μm,Group M,n=12)和小粒径模型组(D=48 ~74 μm,Group S,n=9)。
1.2仪器普通倒置显微镜(型号XDS-1B,重庆光学仪器厂),SR-6N立体定位仪(Narishige),激光多普勒血流仪(Laser Doppler Flowmetry,LDF)系统,正置显微镜(COIC XSZ-HS3,重庆光学仪器厂),照相机(型号Cannon E05 450D,日本佳能公司)。
1.3血栓制备参考Kaneko等的方法略加改进,10 ml血液取自2只同种同批次SD大鼠,37℃自然干燥,用研钵研碎后经80目(178 μm),100目(150 μm),120 目(124 μm),200 目(74 μm)和 300 目(48 μm)细胞筛过筛,得到3个直径在150~178 μm,74~124 μm 和 48 ~74 μm 范围粒径的血栓,应用时15 mg血栓加0.5 ml生理盐水配制成浓度为30 g·L-1混悬液。普通倒置显微镜拍照(Fig 1)。
1.4模型的制备动物以水合氯醛(0.4 mg·g-1,ip)麻醉,钝性分离右侧颈总动脉(common carotid artery,CCA)、颈内动脉(internal carotid artery,ICA)和颈外动脉(external carotid artery,ECA)近心端,并于近心端游离一段颈外动脉约0.5 cm。将颈外动脉游离端拉至与颈内动脉成一条直线,并在颈外动脉处剪口,1ml注射器逆行注入30g·L-1血栓生理盐水混悬液0.5 ml后,立即结扎颈外动脉,同时开放颈总动脉夹,使血栓通过颈内动脉进入颅内至大脑各动脉,造成多灶性血栓栓塞性中风模型。栓塞过程中动物保持麻醉状态,用普通台灯(100 W)照射,术后用电热毯,以保持动物体温在37℃。假手术组颈外动脉注射生理盐水,正常组不进行任何手术操作。
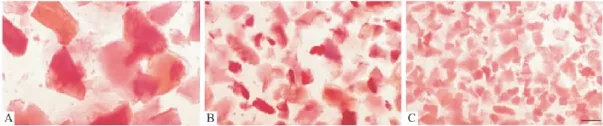
Fig 1 Suspension of homologues blood emboli in normal saline
1.5脑血流检测采用多普勒血流仪动态监测大鼠的局部脑血流,分别测定假手术组和3种粒径模型组大鼠注入生理盐水和血栓后相对脑血流变化,每组测4只大鼠。方法如下,用10%水合氯醛(0.4 mg·g-1,ip)麻醉大鼠,将大鼠固定在定位仪上,剪开头顶部皮肤,酒精棉擦拭,暴露出前囟。以前囟为坐标原点,选取前囟后1 mm,右侧2 mm为测定点,定位并固定好探头座。稳定LDF读数后记录10 min内血流值,以其平均值作为脑血流的基础值。每只大鼠的脑血流以血栓注入后测得值占脑血流基础值的百分率即相对脑血流(relative regional cerebral blood flow,rCBF)表示,连续监测60 min,选取血栓注入完毕后 0、10、20、30、40、50 和 60 min 血流值做统计。
1.6神经行为学检查分别于动物手术24 h后采用Bederson’s评分标准[7]进行评分。提鼠尾离开地面约1尺,观察两前肢状况;将大鼠置于水平地面,推动其双肩,观察两侧抵抗力有无差异;大鼠置于地面,观察其行走情况。采用五级评分法(0~4分),分数越高,说明其神经行为损伤越严重。①行为完全正常者,记0分;② 提起鼠尾离开地面,手术对侧前肢内旋、内收者,记1分;③ 大鼠至地面,用手挤压两侧检查其抗力,手术对侧抗力下降者,记2分;④大鼠至地面,观察其行走,围绕手术对侧转圈者,记3分;⑤ 损伤极其严重,已无法自主活动者,记4分。
1.7HE染色手术后24 h,动物以水合氯醛(0.4 mg·g-1,ip)麻醉,4%多聚甲醛经心灌流固定,取出脑组织,经石蜡包埋,4 μm厚切片进行HE染色,显微镜下拍照观察。
1.8数据处理各个时间点相对脑血流组间比较和神经行为学评分的组间比较采用SPSS10.0软件的one-way ANOVA进行分析,数据以±s表示。
2 结果
2.1血栓粒径对大鼠局部脑血流的影响激光多普勒血流仪的原理是动态监测微血管中红细胞的行为特征,主要反映微血管的功能状况。假手术组大鼠大脑皮层的rCBF基本保持稳定,模型组大鼠注入3种粒径血栓后rCBF迅速降低,分别使rCBF降到 14.4%、29.9%和 22.0%,与假手术组相比,具有统计学意义(P<0.05),随着时间的延长,rCBF逐步升高,10 min时,rCBF分别升高到 16.2%(P<0.05),38.3%和 49.6%,60 min 时,rCBF 分别升高到37.7%,40.2%和60.2%(Fig 2)。表明脑血流的降低程度与血栓粒径基本呈正相关。
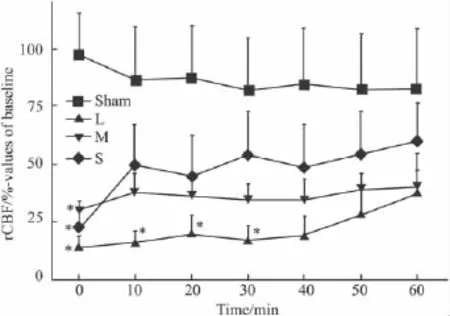
Fig 2 Changes of rCBF after injection of different sizes of blood emboli for 1 h in rats(±s,n=4)
2.2血栓粒径对大鼠神经行为学评分的影响术后24 h神经行为学评分发现,与假手术组和正常组相比,3个粒径血栓均能造成大鼠明显的神经行为学障碍,模型组大鼠的神经行为学评分(2.55±0.69),升高(Tab 1,P<0.05)。大粒径组大鼠神经行为学评分高于中粒径组(1.75±1.14)和小粒径组(1.67 ±0.87)(P<0.05),中粒径组和小粒径组相比差异无显著性。
Tab 1 Neurological deficit scores of rats with injection of different size of homologues blood emboli at 24 h(±s,n=9~12)

Tab 1 Neurological deficit scores of rats with injection of different size of homologues blood emboli at 24 h(±s,n=9~12)
**P <0.01 vs sham;#P <0.05 vs group L
Group Neurological deficit scores Normal 0 Sham 0 L 2.5455 ±0.2180**M 1.7857 ±0.2759**#S 1.7000 ±0.2494**#
2.3血栓粒径对大鼠皮层神经元损伤的影响HE染色发现,正常组及假手术组大鼠皮层组织结构致密,神经细胞分层清晰,无肿胀,核深染。颈外动脉注入3种粒径血栓混悬液均能够引起大鼠弥漫的,散在的皮层损伤,大粒径组和中粒径大鼠梗死区皮层组织结构疏松呈网筛状,神经细胞数目减少,排列无规则,神经元脱失严重,神经细胞肿胀明显,小粒径组大鼠梗死区皮层神经元发生明显缺血性改变,神经细胞核固缩明显。见Fig 4。
3 讨论
血栓栓塞模型优势在于极好的模拟人类脑血栓栓塞性中风的发生发展,对于溶栓药物的开发具有重要的意义。近30年来科研工作者不断的尝试脑内注射不同栓子观察对动物脑损伤的影响(Tab 2),但关于栓子粒径大小对脑损伤影响的比较研究并不多。我们知道,血栓注入脑内经过不同直径大小的血管,引起不同脑区血流阻断,进而引发不同部位脑区梗死和动物行为学障碍。
本实验选取3种粒径的同种异体血栓,大粒径(150 ~178 μm),中粒径(74 ~ 124 μm)和小粒径(48~74 μm),以大鼠能承受的较大的溶剂体积(0.5 ml)和血栓质量(15 mg)制备大鼠血栓栓塞中风模型,观察血栓粒径对大鼠脑血流,神经行为学及脑皮质组织结构的影响,为制备稳定、可靠的脑血栓栓塞性中风模型提供依据。
外源性血栓通过颈内动脉进入脑内血管造成弥散性血管栓塞,使脑血流降低,神经组织缺血缺氧,内环境紊乱进而引起神经组织损伤。Henninger等[8]认为,相对脑血流降到45%并维持10 min,则预示血栓栓塞性中风模型制备成功。本实验结果显示,颈内动脉注入3种粒径血栓后均使相对脑血流降到30%以下,10 min后,大粒径组和中粒径组仍保持在45%以下,而小粒径组恢复到50%。可以认为,3种粒径血栓均可引起血栓栓塞性脑梗死,且脑血流降低程度与血栓粒径大小呈正相关关系。
神经行为学评分发现,3种粒径血栓均能引起大鼠神经行为学障碍,且神经行为学评分升高程度与血栓粒径大小呈正相关。HE染色也提示,血栓栓塞性中风大鼠脑病理损伤程度与血栓粒径大小有一定的相关性。

Fig 4 Paraffin sections stained with HE showed brain cortex damage after injection of thrombli for 24 h.
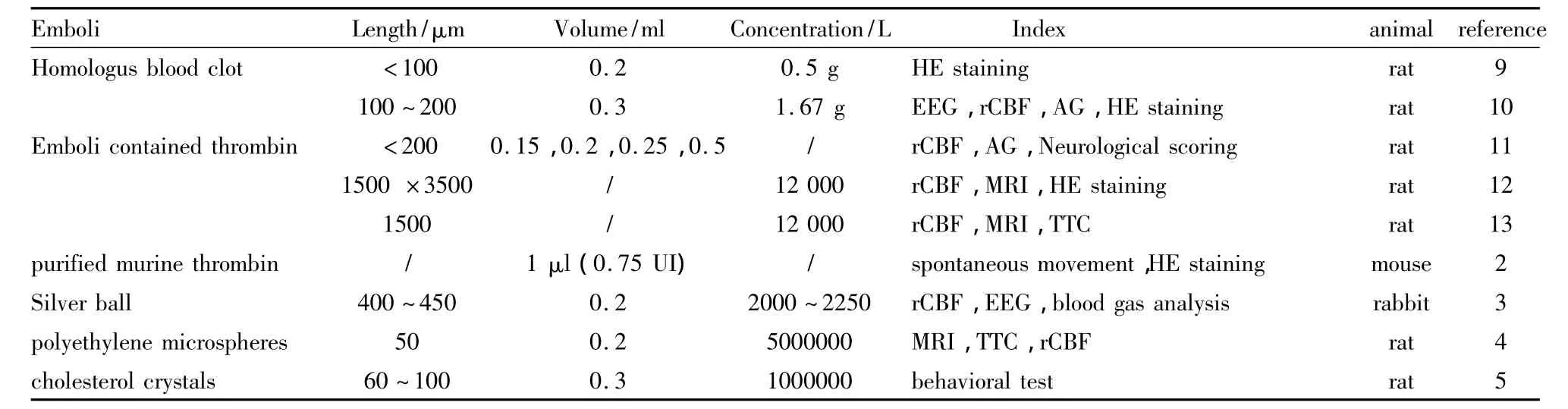
Tab 2 Characteristic of emboli used in making thromboembolic model
综上所述,颈外动脉注射3种粒径血栓均能引起大鼠脑血流降低,神经行为学障碍及大脑皮层病理性损伤,其改变程度与粒径大小基本呈正相关。不同的脑血流降低程度和神经行为学障碍提示血栓粒径对大鼠脑梗死情况如梗死面积可能有密切的关系,在下一步实验中可通过MRI或TTC染色等方法,观察不同粒径血栓对大鼠不同脑区梗死面积的影响,以便进一步稳定的脑血栓栓塞性中风模型,为脑血栓栓塞性中风防治提供可靠的研究平台。
[1]侯 唏,梁 枫,李爱剑,等.银杏叶提取物联合依达拉奉对气虚血瘀型脑缺血/再灌注大鼠血液学的影响[J].中国药理学通报,2010,26(8):1049-53.
[1]Hou X,Liang F,Li A J,et al.Effects of EGb combined with ED on hematology in cerebral ischemia reperfusion injury in rats with Qi deficiency and blood stasis[J].Chin Pharmacol Bull,2010,26(8):1049-53.
[2]Orset C,Macrez R,Young A R,et al.Mouse model of in situ thromboembolic stroke and reperfusion[J].Stroke,2007,38(10):2771-8.
[3]Molnár L,Hegedüs K,Fekete I.A new model for inducing transient cerebral ischemia and subsequent reperfusion in rabbits without craniectomy[J].Stroke,1988,19(10):1262-6.
[4]Mayzel-Oreg O,Omae T,Kazemi M,et al.Microsphere-induced embolic stroke:an MRI study[J].Magn Reson Med,2004,51(6):1232-8.
[5]Rapp J H,Pan X M,Neumann M,et al.Microemboli composed of cholesterol crystals disrupt the blood-brain barrier and reduce cognition[J].Stroke,2008,39(8):2354-61.
[6]Niessen F,Hilger T,Hoehn M,Hossmann K A.Differences in clot preparation determine outcome of recombinant tissue plasminogen activator treatment in experimental thromboembolic stroke[J].Stroke,2003,34(8):2019-24.
[7]Bederson J B,Pitts L H,Tsuji M,et al.Rat middle cerebral artery occlusion:evaluation of the model and development of a neurologic examination[J].Stroke,1986,17(3):472-6.
[8]Henninger N,Bouley J,Br˚atane B T,et al.Laser doppler flowmetry predicts occlusion but not tPA-mediated reperfusion success after rat embolic stroke[J].Exp Neuro,2009,215(2):290-7.
[9]Kudo M,Aoyama A,Ichimori S,Fukunaga N.An animal model of cerebral infarction:homologous blood clot emboli in rats[J].Stroke,1982,13(4):505-8.
[10]Kaneko D,Nakamura N,Ogawa T.Cerebral infarction in rats using homologous blood emboli:Development of a new experimental model[J].Stroke,1985,16(1):76-84.
[11]Overgaard K,Sereghy T,Boysen G,et al.A rat model of reproducible cerebral infarction using thrombotic blood clot emboli[J].J Cereb Blood Flow Metab,1992,12(3):484-90.
[12]Busch E,Krüger K,Hossmann K A.Improved model of thromboembolic stroke and rt-PA induced reperfusion in the rat[J].Brain Res,1997,778(1):16-24.
[13]Krueger K,Busch E.Protocol of a thromboembolic stroke model in the rat review of the experimental procedure and comparison of models[J].Invest Radiol,2002,37(11):600-8.
