大鼠实验性脑外伤后核因子κB活化与细胞凋亡的关系研究
2011-06-08孙江红郭相杰
孙江红 郭相杰
(1 山西省高级人民法院证据技术中心,山西 太原 030024;2 山西医科大学法医学院病理教研室,山西 太原 030001)
脑外伤(traumatic brain injury,TBI)是法医实践中最常见的暴力死亡因素,脑外伤会引起一系列的病理、生理、生化方面的改变,如蛛网膜下腔出血、颅内血肿、脑水肿、脑循环障碍等,造成脑的二次损伤和多次损伤。脑外伤的发生发展、损伤形成的机制、损伤程度的分析以及预后判断一直受到法医工作者的重视,其中损伤程度的判定成为判定案件性质及量刑的主要依据[1,2]。
目前对脑外伤细胞水平的研究多集中在脑外伤后神经元细胞的凋亡。近年来一系列尸检脑组织标本及的脑外伤动物模型研究证实,TBI后细胞凋亡参与了继发性脑损伤的发展过程,细胞凋亡与脑外伤密切相关。许多研究表明,继发性神经元死亡有10%~50%是神经元凋亡引起的。神经元凋亡生在创伤灶的中心部位外,主要出现在伤灶4周的缺血、缺氧区,即所谓迟发性神经元死亡[2-5]。
脑外伤后还涉及一系列细胞因子的变化,包括肿瘤坏死因子α(tumor necrosis factor α,TNF-α)、核因子κB (neucler factorκB,NF-κB)、白细胞介素6(interleukin-6,IL-6)等,这些细胞因子的相互作用在很大程度上决定了损伤的发展及严重程度。NF-κB是近年发现的最重要的转录因子之一,正常情况下胞浆内与抑制蛋白(IκB)结合而呈非活性状态。当细胞受到各种刺激原如紫外辐射、细胞因子(如TNF-α、IL-1)、损伤时,NF-κB与IκB解离并进入细胞核内,与特定的启动子结合,从而调控各种基因的表达,如细胞因子、炎性因子、黏附分子等。NF-κB在炎症发生时复杂的细胞因子网络中起着中心调节作用。脑外伤后NF-κB的激活及其调节,正是近年来的研究热点之一[6-8]。
由此可见,脑外伤后细胞凋亡的发生及NF-κB活化是决定脑外伤损伤程度的两个重要因素。本研究以实验性脑外伤大鼠为模型,对外伤后不同时间的凋亡发生及NF-κB的活化进行检测,考察二者的关系,同时对NF-κB活化进行干预,以明确NF-κB与凋亡发生的关系,从而对脑损伤程度的鉴定提供一定的参考依据。
1 材料与方法
1.1 材料
将72只Wistar大鼠随机分成24个小组,每组3只,其中8组作为对照组8组,8组作为实验组,8组作为PDTC(Pyrrolidine dithocarbamate)组,PDTC(Sigma)预先按100mg/kg体质量腹腔注射。实验组及PDTC组大鼠制造脑外伤模型[2]。对照组制造假损伤,仅切开头皮、右顶部开骨窗,不致脑外伤。
各组动物分别在脑外伤后0h、1h、6h、12h、24h、48h、72h、168h断头,取出整脑,沿挫伤灶中央作冠状切面取材(包括未损伤的左侧脑组织),前半部分脑组织用液氮冷冻后放人-70℃冰箱保存备用,后半部分脑组织固定于4%多聚甲醛0.1mol/L PBS溶液中24h,用石蜡包埋。
1.2 方法
1.2.1 TUNEL 鉴定细胞凋亡
应用TUNEL试剂盒(Roche)原位标记凋亡细胞,按说明书操作,对以挫伤灶为中心60°脑域内TUNEL阳性细胞进行图像分析,以计算凋亡细胞的比例。
1.2.2 凝胶电泳迁移率变迁分析(Electrophoretic mobility shift assay,EMSA)鉴定NF-κB的活化
收集脑组织,抽提核蛋白,按说明书加入20~50 fmol的32P 标记(30000~50000cpm)的NF-κB特异寡核苷酸探针(5AGTTGAGGGGA CTTTCCCAGGC3),混匀后室温下孵育10min,SDS PAGE电泳,电泳毕凝胶转移至滤纸上,覆X线片暗房中曝光72h,显影后作图像分析。
1.2.3 统计学处理
所有数据均以均数±标准差(χ—±s)表示,采用SPSS13.0统计软件包对所得数据进行t检验和单因素方差分析,取P<0.05表示统计结果具有显著性差异。
2 结 果
2.1 脑外伤引起细胞凋亡
结果显示,实验组在脑外伤24h后损伤脑域内出现明显的细胞凋亡,到48h到达峰值,然后逐渐回落,与对照组相比,24h、48h、72h、168h均有显著差异(P<0.05);对照组一直未出现明显的细胞凋亡(图1)。
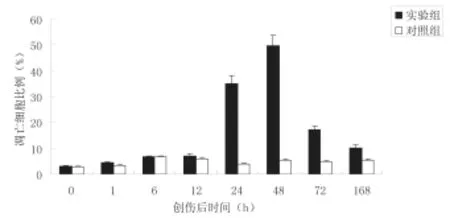
图1 大鼠实验性脑外伤后不同时间神经凋亡细胞的比例 (±s, n=3)
2.2 脑外伤引起NF-κB的活化
结果显示,创伤组在脑外伤1h后NF-κB开始活化,到24h到达峰值,然后逐渐回落;同时,对照组NF-κB活性也出现了升高-降低的动态变化,但幅度较小。实验组与对照相比,1h、6h、12h、24h、48h、72h均有显著差异(P<0.05)(图2)。

图2 大鼠实验性脑外伤后不同时间NF-κB的活性 (±s,n=3)A:EMSA显示24h NF-κB活化情况;B:直方图
2.3 PDTC 可加剧脑外伤引起的细胞凋亡
PDTC是NF-κB特异抑制剂,结果显示,在PDTC应用组,凋亡细胞比例明显增加,PDTC组与未加PDTC组相比,24h、48h、72h、168h均有显著差异(P<0.05);同时,PDTC组凋亡的发生亦随时间发生了“升高-降低”的变化
3 讨 论
本研究结果显示,在急性脑外伤后,大鼠受伤脑域内随时间出现了大量的凋亡细胞,但随着时间进一步发展,凋亡细胞比例又逐渐下降,造成这一现象的原因可能是多方面的,比如有一部分凋亡细胞最终坏死崩解,或者一部分早期的凋亡细胞其凋亡被逆转。这些结果提示我们,凋亡可以作为脑损伤程度判定的一个因素。在法医实践中,可以运用TUNEL法对尸检脑组织鉴定凋亡细胞的比例,从而增加脑损伤判定以及损伤时间推测的依据,目前实际上已经开展了这方面的工作[9]。
本研究还显示,NF-κB的活化出现在脑损伤的早期,并且NF-κB特异抑制剂PDTC可以增加凋亡细胞的比例,说明在脑损伤过程中,NF-κB具有保护细胞免于凋亡的功能。综合考虑NF-κB活化程度与细胞凋亡的比例,可为判断脑损伤时间提供很多有益的信息。但同时其他研究显示,在脑损伤所致的脑水肿、炎症过程中,NF-κB起到关键的促进作用[10],因此可以说在脑外伤后,NF-κB的活化是一把“双刃剑”。这就提示我们,在法医实践中,应慎重对待NF-κB活化这一指标,应进一步对NF-κB所调控的细胞因子进行鉴定,才能够全面地判定脑损伤的程度和时间。
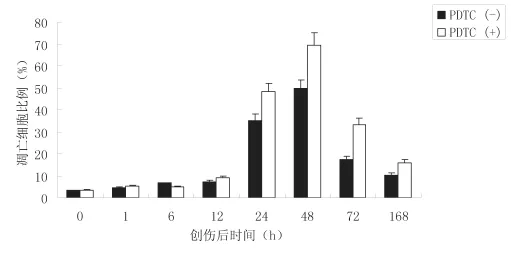
图3 PDTC可增加脑外伤后的细胞凋亡(±s, n=3)
[1] Dressler J,Hanisch U,Kunlish E,et al.Neuronal and glial apoptosis in human traumatic brain injury [J].Int J Legal Med 2007,121(5):365-375.
[2] 陈克家,李卫,王志刚.大鼠脑组织损伤后局部细胞免疫与神经元凋亡的关系[J].南方医科大学学报,2009,29(3):497-499.
[3] Newcomb JK,Zhao X,Pike BR,et al.Temporal profile of apoptoticlike changes in neurons and astrocytes following controlled cortical impact injury in the rat [J].Exp Neurol,1999,158(1):76-88.
[4] Raghupathi R,Graham DI,Mcintosh TK.Apoptosis after traumatic brain injury [J].J Neurotrauma,2000,17(10):927–938.
[5] Raghupathi R.Cell death mechanisms following traumatic brain injury[J].Brain Pathol,2004,14(2):215–222.
[6] 张延波,陈溪萍,陶陆阳,等.大鼠脑外伤后溶酶体酶Cathepsin-B和D的表达[J].法医学杂志,2006,22(6):404-410.
[7] 肖国民,危静.大鼠脑损伤后核因子κB 与肿瘤坏死因子α的表达[J].浙江医学,2005,27(1):27-29.
[8] Hang CH,Shi JX,Li JS,et al. Expressions of intestinal NF-kappaB,TNF-alpha,and IL-6 following traumatic brain injury in rats[J].J Surg Res,2005,123(2):188-193.
[9] Zang Y,He XH,Xin WJ,et al.Inhibition of NF-kappaB prevents mechanical allodynia induced by spinal ventral root transection and suppresses the re-expression of Nav1.3 in DRG neurons in vivo and in vitro[J]. Brain Res,2010,1363(1):151-158.
[10] Dressler J,Hanisch U,Busuttil A.Comments on Hausmann: neuronal apoptosis following human brain injury[J].Int J Legal Med,2005,119(3):177–178.
