伯氏疟原虫再感染过程中树突状细胞表面分子表达水平的实验观察
2011-06-06刘英杰潘艳艳冯永辉曹雅明
刘英杰,潘艳艳,李 莹,冯永辉,刘 军,曹雅明
2.中国医科大学免疫学教研室,沈阳 110001
疟疾是一种全球高发的原虫感染性疾病。在疟疾流行区,尽管多数人群体内存在一定水平的特异性抗体,但再感染的发生也普遍存在[1]。疟原虫对宿主免疫系统产生的抑制效应是导致再感染发生的主要因素之一[2],其中包括疟原虫对树突状细胞(dendritic cells,DCs)成熟和功能的抑制[3-4]。
DCs是活化初始T细胞的唯一抗原提呈细胞,在启动固有免疫应答和协调适应性免疫应答建立过程中发挥桥梁和纽带作用。CD80、CD86和MHC-Ⅱ等表面分子表达是DCs成熟的标志,上调这些分子及CD40的表达是介导 Thl细胞应答建立的前提[5-7]。研究显示,夏氏疟原虫初次感染早期,脾DCs可选择性吞噬疟原虫感染的红细胞,然后加工并提呈疟原虫抗原给CD+4T细胞,进而诱导保护性Thl细胞免疫应答的建立,然而一旦宿主产生适应性免疫,DCs的功能迅速下调[6]。而体内存在一定水平抗体的人群在发生再感染后是否影响DCs的功能目前尚不清楚。
我们新近的研究发现,伯氏疟原虫(Plasmodium berghei ANKA,PbA)感染的DBA/2小鼠早期根治性治疗后90d,其血清中仍存在一定水平的特异性抗体。为此,我们在其初次感染后90d时进行再感染,然后对脾DCs表面相关分子表达水平进行检测和功能分析。
1 材料与方法
1.1 小鼠、疟原虫和实验感染 雌性,6~8w龄DBA/2小鼠(购自中国医学科学院实验动物研究所)经腹腔接种1×106PbA寄生的红细胞(日本爱媛大学分子寄生虫学教研室惠赠)。小鼠经尾静脉采血,制备薄血膜,吉姆萨染色,光学显微镜镜检计数红细胞感染率。
1.2 药物治疗和小鼠再感染 初次感染后3d,开始经口给药(氯喹 90mg/kg,青蒿琥脂片 60mg/kg,分别购自上海中西药业有限公司和桂林南药股份有限公司),每d 1次,连续3d;对照组小鼠给予等量的生理盐水。待初次感染后90d,小鼠用1×106PbA再次攻击感染。同时以初次感染小鼠作对照。
1.3 流式细胞仪检测脾细胞中表达相关表面分子DCs和活化性T细胞的百分率 无菌取出再感染前(0d)和再感染后第1d、3d和5d小鼠脾脏,常规方法制备脾细胞悬液,用0.17 mol/L NH4CL裂解红细胞。以含10%胎牛血清(FCS)的RPMI 1640调整脾细胞终浓度为1×107/mL。每份样品中表达每种表面分子的DCs和活化性T细胞检测均用双色分析,同时另设阴性对照管。在预先加入FcγⅢ/Ⅱ封闭抗体的流式细胞仪专用染色管中加入新鲜制备的脾细胞悬液0.1ml,然后将抗CD11c-FITC和抗CD80-PE、抗 CD11c-FITC 和抗 CD86-PE、抗CD11c-FITC和抗 CD40-PE、抗CD11c-FITC和抗MHC-II-PE、抗CD4-FITC和抗CD69-PE分别加入上述不同染色管中,用含1%FCS的PBS洗涤两次并悬浮于 500μ L PBS中,流式细胞仪(Becton Dickinson,USA)进行检测。
抗MHC-II-PE购于eBioscience公司,其余单克隆荧光标记抗体和封闭抗体均购于BD Pharmigen公司。
1.4 统计学处理 应用SPSS11.5统计学分析软件,Student's-t检验和单因素方差分析比较各组均值的显著性差异,P<0.05为差异显著(结果为3次结果的均值)。
2 结 果
2.1 小鼠再感染前后不同时间点脾细胞中CD80+DCs的百分率 如图1所示,再感染前小鼠脾细胞中CD80+DCs的百分率与未感染的正常小鼠基本相似;但与未感染的正常小鼠或再感染前小鼠相比,再感染后第3d小鼠脾细胞中CD80+DCs百分率明显增加(P<0.01),此后还有进一步升高的趋势。由于疟原虫感染的红细胞也于感染后第3d出现在外周血中(数据未显示)。提示,CD80+DCs百分率的升高系由疟原虫刺激所致。
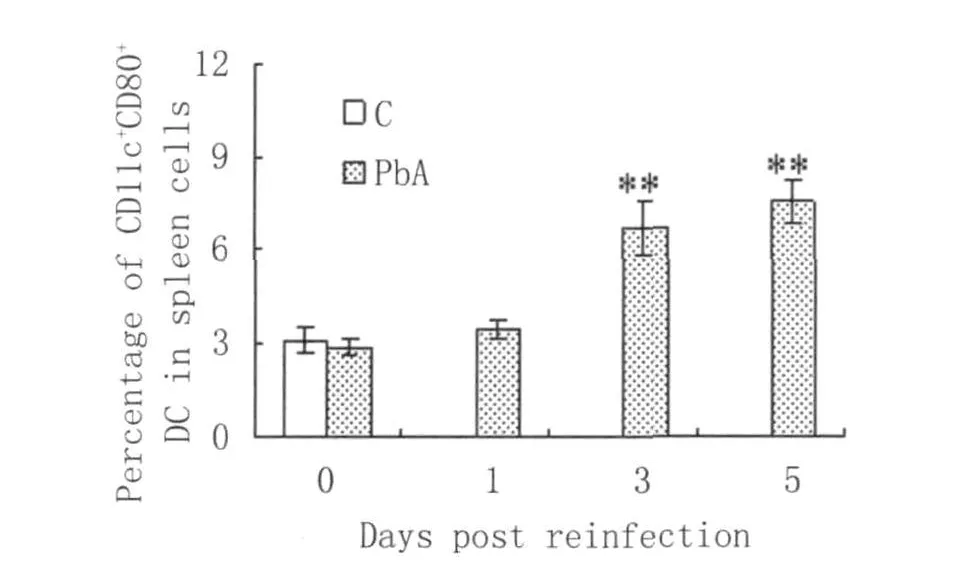
图1 小鼠再感染前后不同时间点脾细胞中CD80+DCs的百分率C:正常未感染小鼠;PbA:再感染小鼠**P<0.01,表示与正常或再感染前小鼠相比Fig.1 Percentage of CDc11+CD80+DCs in spleen cells from miceatdifferent time points after reinfection with PbAC:represent control(noninfected)mice;PbA:represent mice reinfected with PbA**P<0.01,compared with control(noninfected)mice or pre-reinfected mice(0 d)
2.2 小鼠再感染前后不同时间点脾细胞中CD86+DCs的百分率 如图2所示,再感染前小鼠脾细胞中CD86+DCs的百分率与未感染的正常小鼠基本相似;但与未感染的正常小鼠或再感染前小鼠相比,再感染后第3d CD86+DCs百分率明显增加(P<0.01);再感染后第5d的水平与第3d的基本相当。
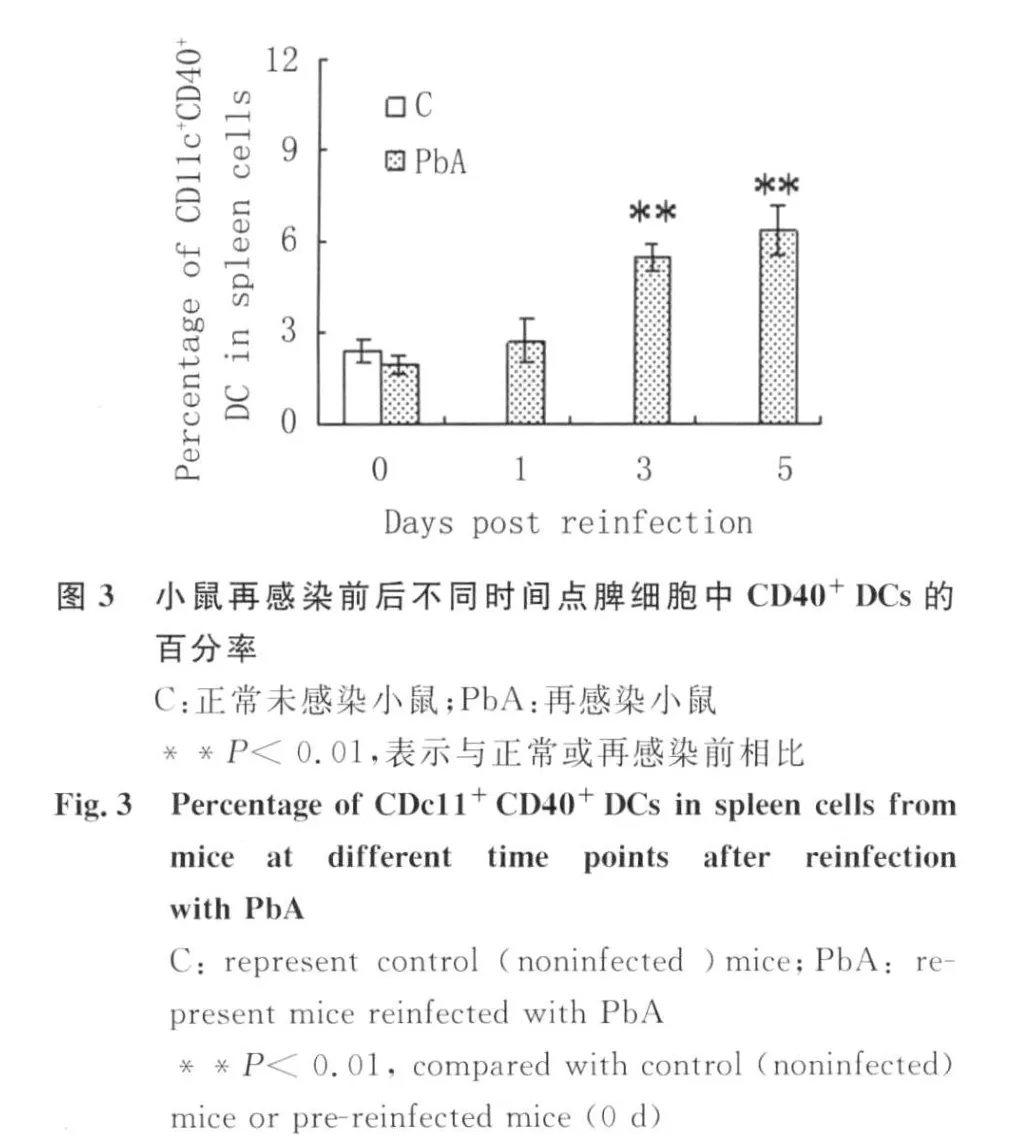
2.3 小鼠再感染前后不同时间点脾细胞中CD40+DCs的百分率 如图3所示,与未感染的正常小鼠相比,再感染前小鼠脾细胞中CD40+DCs的百分率稍有下降,但没有显著差异(P>0.05);与未感染的正常小鼠或再感染前小鼠相比,再感染后第3d小鼠脾细胞中CD40+DCs百分率明显增加(P<0.01);并在再感染后第5d进一步升高。

2.4 鼠再感染前后不同时间点脾细胞中MHC-II+DCs的百分率 如图4所示,与未感染的正常小鼠相比,再感染前小鼠脾细胞中MHC-II+DCs的百分率稍有下降,但没有显著差异(P>0.05);与未感染的正常小鼠或再感染前小鼠相比,感染后第3d小鼠脾细胞中MHC-II+DCs百分率明显增加(P<0.05);并且在再感染后第 5d进一步升高(P<0.01)。
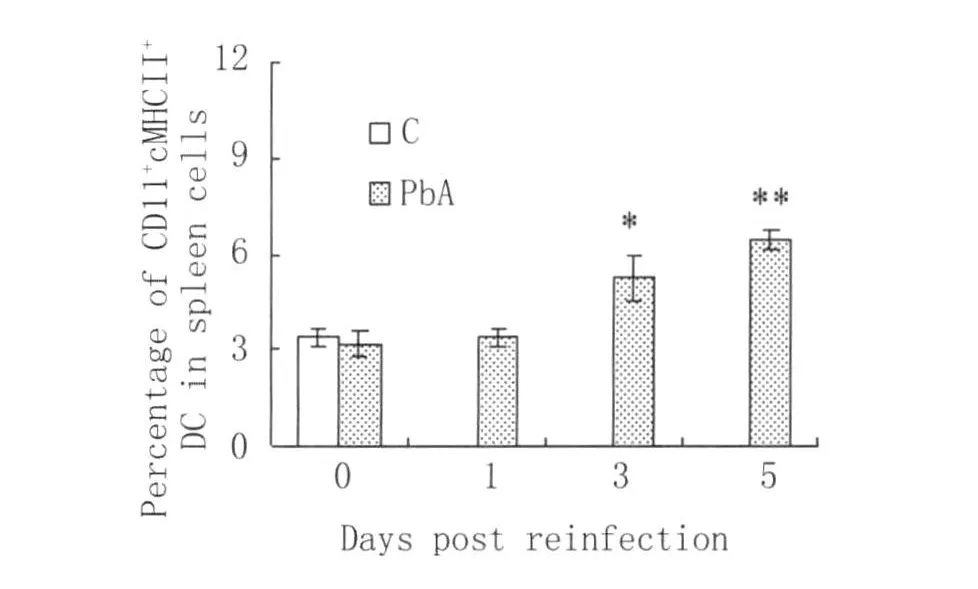
图4 小鼠再感染前后不同时间点脾细胞中MHC-II+DCs的百分率C:正常未感染小鼠;PbA:再感染小鼠*P<0.05和**P<0.01,表示与正常或再感染前相比Fig.4 Percentage of CDc11+MHC-II+DCs in spleen cells from mice at different time points.after reinfection with PbAC:represent control(noninfected)mice;PbA:represent mice reinfected with PbA*P<0.05 and**P<0.01,compared with control(noninfected)mice or pre-reinfected mice(0 d)
2.5 小鼠再感染前后不同时间点脾T细胞中活化性T细胞的百分率 如图5所示,与未感染的正常小鼠相比,再感染前小鼠脾T细胞中活化性T细胞(CD4+CD69+)的百分率与其基本相似;但再感染后第1d出现了有意义的升高(P<0.05),这表明,再感染前小鼠体内可能存在一定数量的记忆性 T细胞,当再次感染时这些细胞迅速活化。而此后活化性T细胞百分率进一步升高,则提示除记忆性T细胞活化外,可能又有一些初始T细胞逐渐活化。
3 讨 论
我们新近的研究发现,联合应用氯喹和青蒿琥脂片对PbA感染早期小鼠进行根治性治疗,待90d后再感染时,小鼠仅出现短暂且低水平的虫体血症。再感染后第1d IFN-γ开始升高,再感染后第3d,不仅IFN-γ继续升高,而且TNF-α和特异性IgG水平也显著升高;并且再感染前小鼠血清中存在一定水平的特异性IgG。再感染后第1d IFN-γ的升高和再感染前特异性IgG的存在可能与初次感染后产生的免疫记忆有关;但再感染后第3d,IFN-γ、TNF-α和特异性IgG出现极为显著的升高,则提示,小鼠针对再感染产生了明显的Th1应答和特异性体液免疫应答。

图5 再感染前后不同时间点脾T细胞中活化性T细胞的百分率C:正常未感染小鼠;PbA:再感染小鼠;*P<0.05和**P<0.01,表示与未感染的正常小鼠相比;P<0.01,表示与再感染前小鼠相比Fig.5 The percentage of actived T cells in spleen T cells from mice atdifferent time points after reinfection with PbAC:represent control(noninfected)mice;PbA:represent mice reinfected with PbA;*P<0.05 and**P<0.01,compared with control(noninfected)mice;P<0.01,compared with pre-reinfected mice(0 d).
作为活化初始 T细胞的唯一抗原提呈细胞,DCs是启动固有免疫应答和协调适应性免疫应答建立不可或缺的关键性细胞。致死型约氏疟原虫感染C57BL/6J小鼠可完全抑制其DCs的功能,导致虫体血症迅速升高和小鼠死亡,而非致死型约氏疟原虫感染,DCs可发挥正常的抗原提呈功能并刺激Th应答建立进而抑制虫体血症快速升高,使宿主存活,将非致死型约氏疟原虫感染小鼠的DCs过继转移给致死型约氏疟原虫感染的小鼠,可使其控制虫体血症并存活[8]。在致死型约氏疟原虫感染过程中,与易感的BALB/c小鼠相比,抵抗的DBA/2小鼠其表达CD80、CD86、MHC-Ⅱ和CD40等表面分子的成熟DCs数量明显高于BALB/c小鼠,并能抑制急性期虫体血症快速升高,且全部存活,而BALB/c小鼠虫体血症升高极为迅速,并于感染后6d全部死亡,进一步的实验也证实,DBA/2小鼠的DCs在疟原虫感染红细胞的刺激下可明显促进CD4+T细胞增殖能力和IFN-γ分泌水平[9]。这些结果充分证明,疟原虫既可抑制DCs成熟,但也能刺激高表达 CD80、CD86、MHC-Ⅱ和 CD40成熟的DCs产生,并藉此启动Th应答,进而影响疟疾的感染结局。
在此,我们的研究显示,再感染后第3d,脾DCs表达CD80、CD86、MHC-Ⅱ及CD40分子开始明显增强,同时活化的 T细胞百分率也显著增加,并且我们前期研究已发现IFN-γ和TNF-α在再感染后第3d也出现非常显著的升高。PbA是导致啮齿类动物发生重症脑疟的病原体,具有较强毒力[10],而DCs的成熟和功能的发挥既与虫株毒力相关也受虫体血症水平所影响[4,8,11],但我们的结果则表明,虽然PbA具有较强毒力,但在一定限度的虫荷状态下仍可诱导DCs的成熟和功能的发挥,早期根治性治疗后,宿主存在一定水平的抗体也未对DCs的功能产生明显的影响。虽然我们的模型系统不能全面精准地反映人类疟疾再感染的全部特征,但也可为研究人类抵御疟疾再感染的免疫应答机制提供可借鉴的信息和线索。
[1]Cole-Tobian JL,Michon P,Biasor M,et al.Strain-specific duffy binding protein antibodies correlate with protection against infection with homologous compared to heterologous Plasmodium vivax strains in Papua New Guinean children[J].Infect Immun,2009,77(9):4009-4017.
[2]Webster HK,Boudreau EF,Pang LW,et al.Development of immunity in natural Plasmodium f alciparum malaria:antibodies to the falciparum sporozoite vaccine 1 antigen(R32tet32)[J].J Clin Microbiol,1987,25(6):1002-1008.
[3]U rban BC,Ferguson DJ,Pain A,et al.Plasmodium falciparuminfected ery throcytes modulate the maturation of dendritic cells[J].Nature,1999,400(6739):73-77.
[4]Elliott SR,Spurck T P,Dodin JM,et al.Inhibition of dendritic cell maturation by malaria is dose dependent and does not require Plasmodium falciparum erythrocy te membrane protein 1[J].Infect Immun,2007,75(7):3621-3632.
[5]Stevenson MM,Urban BC.Antigen presentation and dendritic cell biology in malaria[J].Parasite Immunol,2006,28(1-2):5-14.
[6]Ing R,Segura M,T hawani N,et al.Interaction of mouse dendritic cells and malaria-infected ery throcytes:uptake,maturation,and antigen presentation[J].J Immunol,2006,176(1):441-450.
[7]MacLeod M,Kwakkenbos MJ,Crawford A,et al.CD4 memory T cells survive and proliferate but fail to differentiate in the absence of CD40[J].J Exp Med,2006,203(4):897-906.
[8]Wykes MN,Liu XQ,Beattie L,et al.Plasmodiumstrain determines dendritic cell function essential for survival from malaria[J].PLoS Pathog,2007,3(7):e96.
[9]Zheng W,Wang QH,Liu YJ,et al.Distinct host-related dendritic cell responses during the early stage of Plasmodium yoelii infection in susceptible and resistant mice[J].Parasite Immunol,2010,32(5):324-334.
[10]Wu JJ,Chen G,Liu J,et al.Natural regulatory T cells mediate the development of cerebral malaria by modifying the pro-inflammatory response[J].Parasitol Int,2010,59(2):232-241.
[11]Orengo JM,Wong KA,Ocaña-Morgner C,et al.Plasmodium yoelii soluble factor inhibits the phenotypic maturation of dendritic cells[J].Malar J,2008,7(254):1-13.
