猪囊尾蚴谷胱甘肽S-转移酶的表达研究*
2011-06-06肖靓靓包怀恩
方 文,肖靓靓,包怀恩,牟 荣
2.贵阳医学院寄生虫学教研室,贵阳 550004
猪带绦虫病是在世界范围内流行、危害人类健康的肠道蠕虫病之一,而其幼虫除了可寄生于中间宿主猪外,还可寄生于人体,引起严重的囊尾蚴病[1],不仅给养殖业带来巨大经济损失,而且给人民健康带来严重威胁。因此积极开展对猪带绦虫的研究并控制其感染和流行具有重要意义。谷胱甘肽S-转移酶(glutathione S-transferase,GST)广泛存在于多种生物体内,对机体具有重要的解毒和保护作用。迄今为止,在所有已研究过的蠕虫中均证实有GST表达,并证实GST在蠕虫抵抗宿主免疫攻击中起重要作用[2]。本研究应用免疫组化、双向电泳结合蛋白质印迹技术分析猪囊尾蚴GST的表达,为筛选猪带绦虫保护性抗原及可能的治疗靶分子提供实验依据。
1 材料和方法
1.1 材料
1.1.1 主要试剂 GST免疫组化试剂盒(北京中杉生物技术有限公司)、固相pH梯度(immobilized pH gradient,IPG)干胶条(pH 3~10,7 cm)、IPG 缓冲液(pH 3~10)、丙烯酰胺、甲叉双丙烯酰胺、甘氨酸、三羟甲基氨基甲烷(T ris)、二硫苏糖醇(DTT)、硫脲(Thioourea)、十二烷基硫酸纳(SDS),超纯脲(ultra urea)、四甲基乙二胺(T EMED)、丙基硫酸盐(CHAPS)、碘乙酰胺(iodoacetamide)、蛋白酶抑制剂(Protease Inhibitor Cocktail)、核酸酶(Dnase和Rnase)等(美国General Electric公司),低分子量蛋白标准(北京天根生化科技有限公司),辣根过氧化物酶标记的羊抗大鼠IgG(HRP-IgG)(北京索来宝生物技术有限公司),聚偏氟乙烯膜(PVDF膜)及化学发光(ECL)试剂盒(武汉博士德生物技术有限公司),其余试剂均为国产分析纯。
1.2 方法
1.2.1 实验虫体的来源及虫卵悬液的制备 猪带绦虫成虫,采自四川省雅江县呷拉乡猪带绦虫病患者(女性,28岁,自诉经常肚子痛,有排节片史,喜食生腊肉),口服槟榔-南瓜子驱虫[3],新鲜虫体用0.9%生理盐水浸泡保存。虫体孕节及头节用卡红染色,制作压片,经显微镜观察证实为猪带绦虫成虫。挑开猪带绦虫后段全部孕节的子宫,用生理盐水冲洗子宫数次使虫卵溢出,收集全部冲洗液,3 000 r/min离心15 min,收集沉淀的虫卵。取虫卵悬液1mL进行胆汁孵育试验,用台盼蓝染色计数六钩蚴法[4]检测虫卵存活率为 80%。取虫卵悬液0.1mL,光镜下计数虫卵(重复操作6次,取平均值),计算虫卵总数。用生理盐水稀释虫卵悬液浓度约10万个/mL,其中的存活虫卵数约为8万个/mL(10万×80%)。
1.2.2 实验动物感染 20d龄三元杂交乳猪6头,体重6.5~7kg,由贵州大学农学院动物养殖中心提供,经粪检和间接血凝实验(IHA)证实,无猪囊尾蚴及其他寄生虫感染。将每头猪灌胃1mL虫卵(8万个/mL)。乳猪以专用膨化颗粒饲料饲养,隔离圈养于清洁水泥地面饲养宅内,防止自然感染。
1.2.3 免疫组化 在第40d、80d和120d天各宰杀2头猪。取含猪囊尾蚴的肝脏(120 d除外)和肌肉组织1.0×1.0×0.5cm3各数块,置于10%福尔马林中4℃冰箱过夜。常规脱水,石蜡包埋,4μ m 连续切片。切片经脱蜡、脱苯、水化后,置于 pH 6.0枸橼酸缓冲液中用高压锅进行抗原修复2min,PBS洗涤3次,分别滴加单克隆抗体GST(1∶300),置于4℃冰箱内过夜,PBS洗涤后滴加二抗孵育30min,然后常规DAB显色、苏木素复染、封片。阴性对照用PBS液代替一抗。
1.2.4 数据测量及显微摄影 将上述免疫组化切片每组随机选取10张,每张切片在囊尾蚴囊壁及头节随机选取5个视场,每个视场选取5个阳性表达区域用Mias图像分析处理系统测量平均光密度(平均光密度为测量薄层斑点透射光强度大小,平均光密度值越大,标本染色越浅)。日本NIKON光学显微摄影装置拍照。
1.2.6 猪囊尾蚴蛋白的制备 取感染后40d寄生在肌肉的猪囊尾蚴50 mg,用1 mL裂解液[含7 mol/L超纯脲(ultraurea),2 mol/L硫脲(Thiourea),4%丙基硫酸盐(CHAPS),40 mmol/L二硫苏糖醇(DT T),2%pH 3~10固相pH 梯度(IPG)缓冲液],临用前加1%复合蛋白酶抑制剂(Protease Inhibitor Mix)冰浴匀浆,分装于1.5 mL离心管,加20μ g/mL脱氧核糖核酸酶(Dnase)和 5μ g/mL核糖核酸酶(RNase)置4℃15 min,于4℃40 000×g离心1 h,收集上清,用双向电泳沉淀剂(2D cleanup)试剂盒处理。考马斯亮蓝法(Bradford法)测定蛋白浓度,分装,-80℃保存。
1.2.7 猪囊尾蚴蛋白双向电泳分析 猪囊尾蚴总蛋白溶液于4℃融化、8 000×g离心10 min。加入上样缓冲液(7mol/L ultraurea、2 mol/L T hiourea、2%CHAPS、65mmol/L DTT、0.5%pH 3 ~ 10 IPG缓冲液和痕量溴酚蓝),每胶条上样300μ g(体积为 125μ L),将两根 IPG胶条(7cm)分别置于溶胀槽中重泡胀至少12 h,再转入等电聚焦仪(型号为Ettan IPGphorⅢ ,美国 General Electric公司)进行第一向等电聚焦(依次为250 V 40 min,500 V 40 min,4000 V 3 h,4000 V 20000 Vh)。胶条经两次平衡后进行12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),其中的一块胶为制备胶,另一块胶用于蛋白质印迹(Western blotting)分析。制备胶经考马斯亮蓝染色,用扫描仪(型号为UNISCAN e100,中国清华紫光股份有限公司)进行透射扫描,用双向电泳图像分析软件(ImageMaster 2D platinum 5.0)对图像进行强度校正、点检测、背景消减和点匹配等。用二维校正法确定蛋白质等电点(pI)和相对分子质量(Mr)。实验重复3次。
1.2.8 蛋白质印迹(Western-blotting)分析 采用半干转膜技术(参照TE77 PWR半干转仪器说明书)将双向电泳凝胶蛋白转至PVDF膜(与凝胶同样大小)(1.0 mA/cm2室温转移1.0 h)。用5%脱脂奶粉室温封闭2 h,TBST(含20 mmol/L Tris·HCl pH 7.6,140 mmol/L NaCl和0.1%Tween20)洗3次(10 min/次,下同)。实验组一抗为本课题组自制大鼠抗猪带绦虫GST血清[5](1∶100)、对照组一抗为正常大鼠血清(1∶100)室温孵育3 h,TBST洗膜3次。二抗为羊抗大鼠HRP-IgG(1∶200)室温孵育2 h,TBST洗膜 3次。干燥1~2 min。在暗室将胶片剪成与PVDF膜同样大小,用化学发光(ECL)试剂盒(产品编号:EK1004,中国武汉博士德生物工程有限公司)将PVDF膜进行胶片曝光显影、定影,流水冲洗、干燥,扫描保存杂交图像。比较两组杂交蛋白点的差异,确定猪囊尾蚴GST抗原抗体阳性杂交斑点。
2 结 果
2.1 免疫组化观察 GST阳性表达主要定位于猪囊尾蚴头节及囊壁细胞的胞浆,呈棕黄色颗粒,见图1。不同时期寄生在肝脏及肌肉的猪囊尾蚴均表达GST,随感染时间增加,寄生在肌肉的猪囊尾蚴GST的表达变化不大(P>0.05),寄生在肝脏的猪囊尾蚴GST的表达升高(P <0.05),见表1。

图1 猪囊尾蚴GST的表达1.1阴性对照(感染40d寄生在肌肉的猪囊尾蚴头节及囊壁胞浆处未见GST棕黄色颗粒)(×100);1.2感染80d的猪囊尾蚴囊壁及邻近肌肉组织胞浆处可见GST棕黄色颗粒(×200);1.3感染120d寄生在肌肉的猪囊尾蚴头节胞浆处可见GST棕黄色颗粒(×100);1.4感染40d的猪囊尾蚴囊壁及邻近肝组织胞浆处可见GST棕黄色颗粒(×200);1.5感染80d的猪囊尾蚴囊壁及邻近肝组织胞浆处可见GST棕黄色颗粒(×200)Fig.1 GST expression on cysticercus cellulosae1.1 Negative control(None GST brown granules could be seen in cysticercus cellulosae parasitizedin muscle 40 days after infection)(×100);1.2 GST brown granules could be seen in cysticercus cellulosae and the adjacent muscle 80 days after infection(×200)1.3 GST brown granules could be seen in the head of cysticercus cellulosae parasitizedin muscle 120 days after infection(×100);1.4 GST brown granules could be seen in cysticercus cellulosae and the adjacent liver 40 days after infection(×200);1.5 GST brown granules could be seen in cysticercus cellulosae and the adjacent liver 80 days after infection(×200)
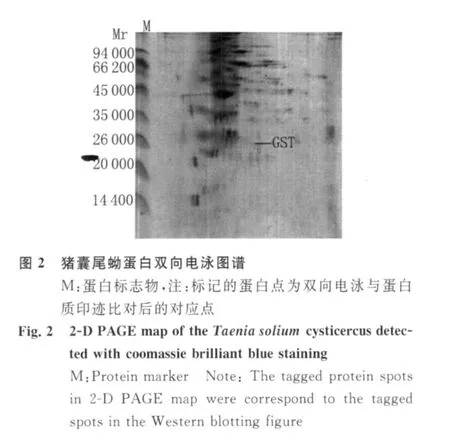
2.2 猪囊尾蚴蛋白双向电泳 3块制备胶经考马斯亮蓝染色后用扫描仪获取图像,再用双向电泳图像分析软件进行分析,结果表明蛋白斑点数为207±9,相对分子质量(Mr)为 14 400~94 000,等电点(pI)为3.0~10.0。其中153±4个蛋白斑点的 pI为4.0~7.0,在极酸性(pH 3)和极碱性(pH 10)区域也出现少量蛋白斑点,见图2。
2.3 猪囊尾蚴GST的Western-blotting分析 结果显示,猪囊尾蚴GST抗原抗体阳性杂交斑点为1个,阴性对照未见抗原抗体阳性杂交斑点,见图3。将Western-blotting检测的抗原抗体阳性杂交斑点与原双向电泳凝胶斑点进行比对,找到对应蛋白斑点,经ImageMaster 2D Platinum 5.0软件分析后初步确定该蛋白斑点的pI/Mr为(6.6/25 548),与猪带绦虫GST的pI/Mr理论推导值接近。
表1 不同时期和寄生部位猪囊尾蚴GST表达的平均光密度值( ±s)Table 1 GST average value of optical densityon cysticercuscellulosae parasited in different tissuesat different times

表1 不同时期和寄生部位猪囊尾蚴GST表达的平均光密度值( ±s)Table 1 GST average value of optical densityon cysticercuscellulosae parasited in different tissuesat different times
*:表示和同组40d比较,P<0.05.
部位 40d 80d 120d肝脏 179.84±6.59 171.73±6.82* 0对照组 198.54±5.82 201.46±2.19 0肌肉 183.22±7.11 181.95±6.36 184.12±5.47对照组 201.43±1.59 201.54±4.21 201.83±2.35

3 讨 论
谷胱甘肽S-转移酶(glutathione S-ransferases,GST)从原虫到脊椎动物广泛存在,是由多个基因编码、具有多种功能的超家族酶。它能使外源性或内源性的毒素分子失活而转变为水溶性化合物以达到初步解毒的作用,因而是多种生物体内主要的Ⅱ相解毒系统,与许多生理及异源物质的排泄有关[6-7]。
Brophy等[2]报道在所有蠕虫成虫的体内均存在有活性的GST,且GST多存在于虫体细胞的胞质中,是蠕虫主要解毒酶之一。方强[8]等用GST底物催化法检测寄生在肌肉的成熟、未成熟猪囊尾蚴头节及囊壁匀浆的GST活性,发现猪囊尾蚴头节及囊壁内存在相同的GST活性,且GST活性与猪囊尾蚴的成熟程度无关。
本研究结果显示:不同时期寄生在肝脏及肌肉的猪囊尾蚴均表达GST,随感染时间增加,寄生在肌肉的猪囊尾蚴GST的表达变化不大(P>0.05),寄生在肝脏的猪囊尾蚴(120d除外)GST的表达升高(P<0.05)。病理观察肝脏炎症反应也随感染时间延长而加重,可能由于肝脏血供丰富,抗体较其他器官集中,宿主对囊尾蚴产生强烈的炎症病理反应,可是早期猪囊尾蚴依然存活下来继续生长,推测GST的表达在一定程度上对猪囊尾蚴在宿主中的生存起到保护作用,随感染时间增加GST分泌增多,直到后期(120d)猪囊尾蚴才出现坏死和钙化,推测是由于肝脏中宿主免疫效应逐渐增强,猪囊尾蚴自身保护机制与宿主免疫杀伤作用抗争的结果。
本研究首次运用双向电泳结合western-blotting技术分析猪囊尾蚴GST的表达。蛋白质双向电泳技术应用于带绦虫的研究报道不多,仅见少量猪带绦虫蛋白质组的研究报道[9-11],本研究首次运用双向电泳技术获得猪囊尾蚴的总蛋白图谱,并用本课题组自制的大鼠抗猪带绦虫GST血清[5]作蛋白质印迹反应,得到1个特异性抗原抗体阳性杂交斑点,阴性对照未见阳性杂交斑点。将 Western blotting检测的抗原抗体阳性杂交斑点与原双向电泳凝胶斑点比对后找到对应蛋白斑点,经 ImageMaster 2D Platinum 5.0软件分析后初步确定该蛋白斑点的pI/Mr为6.5/25 548,与猪带绦虫GST的pI/Mr理论推导值接近[12]。
如今 ,GST作为较强保护性抗原、有效的降低机体虫荷和排泄物虫卵的数量及影响成虫生殖能力的特点逐渐被学术界认同。同时,GST还是抗恶性疟原虫潜在的药物靶标[13],也是免疫化学方法抗蠕虫的潜在标靶,是WHO提出的6个最具有潜力的候选疫苗分子之一[14-15]。本研究揭示不同时期和寄生部位猪囊尾蚴GST的表达情况,这对开发相关疫苗及可能的治疗靶分子,实现对寄生虫数量和分布的控制会起到积极作用,从而为畜牧业生产及人类健康服务。
[1]吴观凌.人体寄生虫学[M].3版.北京:人民卫生出版社,2005:515-530.
[2]Brophy PM,Pritchard DI.Parasitic helminth glutathione S transferase[J].Exp Parasitol,1994,79(1):89-96.
[3]李雍龙.人体寄生虫学[M].3版.北京:人民卫生出版社,2004:146.
[4]Wang IC,Ma YX,Kuo CH,et al.A comparative study on egg hatching methods and oncosphere viability determination for Taenia solium eggs[J].International Journal for Parasitology,1997,27(11):1311-1314.
[5]戴佳琳,黄江,廖兴江,等.猪带绦虫谷胱甘肽转移酶GST的原核表达及免疫学研究[J].中国人兽共患病学报,2010,26(2):107-110.
[6]聂立红,王声勇,胡毅玲.谷胱甘肽转移酶研究进展[J].中国病理生理杂志,2000,16(11):1240-1243.
[7]姚欣,钱元恕.肝外药物代谢酶的研究进展[J].国外医学药学分册,2003,30(2):97-101.
[8]方强,闽宏林,夏惠,等.猪囊尾蚴谷胱甘肽-S-转移酶活性研究[J].实用寄生虫病杂志,2000,8(1),12-13.
[9]Mayta H,Hancock K,Levine MZ,et al.Characterization of a novel Taenia solium oncosphere antigen[J].Mol Biochem Parasitol,2007,156(2):154-161.
[10]Levine MZ,Calderón JC,Wilkins PP.Characterization,cloning and expression of two diagnostic antigens for Taenia solium tapeworminfection[J].J Parasitol,2004,90(3):631-638.
[11]方文,包怀恩,肖靓靓,等.猪囊尾蚴特异性抗原的筛选、鉴定和生物信息学分析[J].中国寄生虫学与寄生虫病杂志,2009,27(4):313-317.
[12]黄江,胡旭初,徐劲,等.亚洲带绦虫成虫谷胱甘肽S-转移酶基因的克隆及生物信息学分析[J].中国人兽共患病学报,2007,23(11):1093-1100.
[13]Harwaldt P,Rahlfs S,Becker K.Glutathione S-transferase of the malarial parasite Plasmodium falaiparum:characterization of a potential drug target[J].Biol Chem,2002,383(5):821-830.
[14]Bergquist NR,Colley DG.Schistosomiasis vaccines:research to development[J].Parasitol Today,1998,14(3):99-104.
[15]Boulanger D,Warter A,Sellin B,et al.Vaccine potential of a recombinant glutathine S-transferase cloned from Schistosoma haematobiumin primates experimentally infected with an homologous challenge[J].Vaccine,1999,17(4):319-326.
