抗氧化剂对金枪鱼肉冻藏过程中组胺的抑制作用
2011-06-01姜李雁郑平安苏秀榕
姜李雁,王 霞,王 佩,郑平安,高 翔,蒋 鑫,苏秀榕*
抗氧化剂对金枪鱼肉冻藏过程中组胺的抑制作用
姜李雁,王 霞,王 佩,郑平安,高 翔,蒋 鑫,苏秀榕*
(宁波大学生命科学与生物工程学院,浙江 宁波 315211)
利用C18柱、紫外检测器的高效液相色谱建立快速准确检测金枪鱼鱼肉中组胺含量的方法和技术,并对抗氧化剂对金枪鱼储藏过程中组胺产生的抑制作用进行研究。对不同部位的鱼肉采用不同抗氧化剂浸泡处理,检测不同储藏时间下组胺含量的产生和变化。结果表明:该方法的线性回归方程为Y=5.3748X+11.42,线性范围为10~1000μg/mL,相关系数为0.9986,加标回收率为92.0%~111.3%,检出限为3.684μg/mL,用于实际样品测定操作简单、准确灵敏、适用性强、结果满意;经抗氧化剂处理的金枪鱼鱼肉中组胺含量明显低于未经处理的,其中异VC钠和柠檬酸钠混合溶液的浸泡效果最好、VC钠次之、柠檬酸钠最差。抗氧化剂既可以防止金枪鱼鱼肉氧化变黑,又可有效降低组胺的产生。
高效液相色谱;组胺;金枪鱼;抗氧化剂
金枪鱼(Thunnus thynnus)是一种生活在海洋中上层的鱼类,分布在太平洋、大西洋和印度洋的热带、亚热带和温带广阔水域,为高度跨洋性的洄游鱼类。金枪鱼肉质柔嫩,富含蛋白质、DHA和EPA,其背部肌肉粗蛋白含量为26.0%[1]。金枪鱼作为一种深海鱼类,以其营养价值高、纯天然、无污染而享誉国际市场,有“海洋黄金”之称。由于金枪鱼肉中含有丰富的血红蛋白和肌红蛋白,在有生命活动的组织内,肌红蛋白与肌红蛋白处于平衡状态,而鱼体死后经氧化生成的高铁肌红蛋白则呈现不良的棕红色[2]。一般认为,肌红蛋白的化学状态是影响鱼肉颜色的根本所在[3]。同时由于鱼肉中的组氨酸在组胺细菌脱羧酶的作用下,发生脱羧反应生成组胺[4]。海水中存有污染鱼类的组胺菌,组胺生成菌普遍存在于海水鱼的体表,也生活在活鱼的鳃和内脏中。当鱼体存活时,该细菌不对鱼产生危害。一旦鱼死亡,鱼的防御系统就破坏,在适宜温度条件下,组胺菌就迅速生长并产生组胺。金枪鱼是常见的产组胺鱼类,又是易变黑的红肉鱼。本实验拟研究可食用的抗氧化剂在冻藏条件下对金枪鱼肉中的组胺变化规律。
1 材料与方法
1.1 材料、试剂与仪器
金枪鱼(冻藏) 宁波今日食品有限公司。
磷酸组胺 上海求德生物化工有限公司;磷酸氢二钠、磷酸、异VC钠、乙腈均为色谱纯;柠檬酸钠为分析纯。
1120LC高效液相色谱(附带紫外检测器) 美国安捷伦公司;Cary 50 scan紫外分光光度计 美国瓦里安技术(中国)有限公司。
1.2 方法
1.2.1 样品处理
金枪鱼肉在低温条件下采集,背部与腹部鱼肉各分成4份。样品Ⅰ:用质量分数0.3%异VC钠浸泡2~3h;样品Ⅱ:用质量分数0.3%异VC钠和质量分数0.3%柠檬酸钠混合溶液浸泡2~3h;样品Ⅲ:用质量分数0.3%柠檬酸钠浸泡2~3h;样品Ⅳ:未浸泡。所有样品浸泡2~3h之后,在-20℃条件下冻藏。
称取切碎的样品1.0g,放入15mL带塞试管中,加入50%甲醇溶液5mL。超声波萃取30min,然后在60℃水浴中放置15min,静置后用移液管移取上清液至4mL离心管中,在6500r/min条件下离心10min,取上清液经0.22μm滤膜过滤后,取2μL进样。
1.2.2 液相色谱分析
1.2.2.1 组胺标准曲线
配制10~90μg/mL的系列组胺标准液,分别测定标准液并计算其峰面积A值。以A值为纵坐标、A所对应的各质量浓度(C)为横坐标,绘制标准曲线。
1.2.2.2 色谱条件
XDB-C18柱(4.6mm×150mm)的色谱柱。流动相A为25mmol/L磷酸氢二钠(8.4g/L,pH6.5),流动相B为色谱纯乙腈,流动相A-流动相B(80:20,V/V);流速为0.5mL/min;紫外检测器,检测波长为225nm;进液量为2μL;柱温为30℃。
2 结果与分析
2.1 液相色谱检测结果
在200~800nm波长范围内对反应液进行波长检测,发现组胺在225nm波长处吸收最强,信号干扰小,因此选定检测波长为225nm。几种流动相比例均能使色谱峰分离,但随着比例的不同,峰面积也不同。当流动相A:流动相B为20:80时,峰面积达到最大值,组胺检测灵敏度高,色谱峰分离较好,保留时间适宜。
组胺吸收峰的面积随柱温的升高而增大,当柱温达到30℃时,色谱峰面积达到最大值,柱温继续升高,峰面积剧减。
选1mg/mL和2mg/mL组胺标准溶液,每种溶液测定7次,取平均值,其RSD(精密度)值分别为0.83%和1.13%,有较好的精密度(表1)。以信噪比(RSN)为3条件下相对应的质量浓度定为检出限,计算得到该方法的检出限为3.684μg/mL。

表1 高效液相法精密度实验结果(n=7)Table 1 Precision test results for the developed HPLC method
2.2 金枪鱼鱼肉组胺含量变化
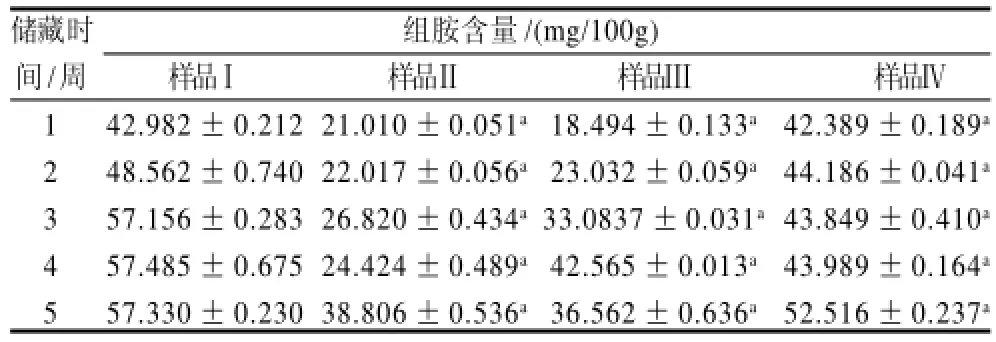
表2 不同处理条件对金枪鱼背部肉中组胺变化的影响Table 2 Effect of different antioxidant treatments on histamine content of tuna back meat
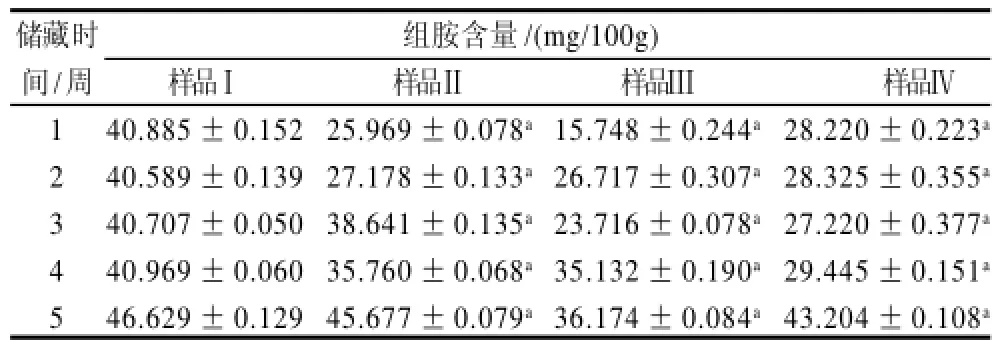
表3 不同处理条件对金枪鱼腹部肉中组胺变化的影响Table 3 Effect of different antioxidant treatments on histamine content of tuna belly meat
从表2、3可知,不同处理条件下,组胺含量随着储藏时间的增长而增加。经过比较,未经浸泡处理的金枪鱼鱼肉中的组胺含量高于3种经浸泡处理的。用0.3%异VC钠和0.3%柠檬酸钠混合溶液浸泡效果最好,其次是0.3%异VC钠浸泡,再次是0.3%柠檬酸钠浸泡。未经浸泡金枪鱼鱼肉的组胺含量均极显著高于其他3组(P<0.01),其他经抗氧化剂浸泡处理的3组,组胺含量明显降低,特别是经异VC钠浸泡处理的,效果非常明显,说明经抗氧化剂可有效抑制组胺的产生。
3 讨 论
3.1 液相色谱法检测组胺的比较
目前检测生物样品中组胺常用的方法有紫外分光光度计法、荧光分光光度计法、酶联免疫法[5]、高效液相色谱法[6-7]等。荧光法操作步骤繁琐,且难以去掉干扰,但仍是目前国际上认可的方法;酶联免疫法测定步骤简便,但检测灵敏度较低;高效液相色谱法灵敏度较高,使用一些国产仪器及耗材相对较经济,通过方法改进,应能取得良好的效果。
本研究采用液相色谱法检测组胺,用超声波萃取样品,提取步骤相对简单,提取率和回收率高。采用C18柱,紫外检测器,可不用进行繁琐的衍生化,保留时间小于4min,检测时间短、精密度高。线性回归方程为Y=53748X+11.42,线性范围为10~1000μg/mL,相关系数为0.9986,加标回收率为 92.0%~111.3%,检出限为3.684μg/mL。本法与传统的分光光度计法、荧光法等比较,具有检测极限低、线性范围宽、抗干扰能力强、回收率高、操作简便、快速准确等优点。
3.2 抗氧化剂对组胺的抑制作用
食品抗氧化剂是能减缓或防止氧化作用、防止食品成分氧化变质的一类食品添加剂。主要用于防止油脂及富脂食品的氧化酸败,以及由氧化所导致的褪色、褐变、维生素破坏等[8]。近年来发现,有一些抗氧化剂除了具有抗氧化作用以外,还对多种微生物有抑制作用[9-10]。
动物性食物中普遍存在组氨酸,尤其是一些青皮红肉的鱼类,其肌肉中含血红蛋白较多,组氨酸含量也较高当受到含高活性组氨酸脱羧酶的细菌污染后,可使鱼肉中的游离组氨酸脱羧基形成组胺[11]。经抗氧化剂浸泡后的金枪鱼鱼肉在冻藏期间与未经浸泡的鱼肉比较,其组胺含量显著降低,说明抗氧化剂可以有效的抑制金枪鱼鱼肉在冻藏过程中组胺的产生。抗氧化剂除了抗氧化方面的功能,国外报道[12-13]其还具有抑菌作用。以异VC钠和柠檬酸钠混合浸泡效果最好,其次是用异VC钠浸泡,柠檬酸钠浸泡效果最差。有研究报道,水产品中的组胺与细菌的污染程度有关,且与相应的酶的活性有关。抗氧化剂具有杀菌的作用,可以抑制甚至杀死鱼肉中的部分含高活性组氨酸脱羧酶的细菌,同时抑制某些利于组胺产生酶的活性,从而有效抑制组胺的产生。这些抗氧化剂既可以防止鱼肉氧化变黑,又可以有效降低组胺的产生。
[1]洪鹏志, 杨萍, 曾少葵, 等. 黄鳍金枪鱼背部肌肉的营养成分及评价[J]. 福建水产, 2006, 25(2): 44-45.
[2]王国永, 林乐杰. 远洋金枪鱼钓船的超低温制冷系统[J]. 渔业现代化, 2001(6): 34-35.
[3]王海燕, 彭增起. 肌红蛋白的功能特性[J]. 肉类工业, 2001(7): 36-40.
[4]TAO Z, NAKANO T, YAMAGUCHI T, et a1. Production and diffusion of histamine in the muscle of scombroid fishes[J]. Fisheries Science, 2002, 68: 1394-1397.
[5]AYGUN O, SCHNEIDER E, SCHEUER R, et al. Comparison of ELISA and HPLC for the determination of histamine in cheese[J]. J Agric Food Chem, 1999, 47(5): 1961-1964.
[6]PREVIATII M, RASPADRI A, BERTOLASO L, et al. Determination of histamine in the whole blood of colon cancer patients[J]. J Chromatogr B Anal Technol Biomed Life Sci, 2002, 780(2): 331-339.
[7]HAN X Q, VOHRA M M. A sensitive method for simultaneous determination of histamine and noradrenaline with high-performance liquid chromatography electrochemistry[J]. J Pharmacol Methods, 1991, 25(1): 29-40.
[8]凌关庭. 食品抗氧化剂及其进展(I)[J]. 粮食与油脂, 2000(6): 45-47.
[9]万素英, 赵亚军. 食品抗氧化剂[M]. 北京: 中国轻工业出版社, 1998: 25.
[10]杜林, 黄小丹, 赵文红, 等. MIC法测定四种抗氧化剂的抑茵作用[J].中国调味品, 2006(8): 41-44.
[11]王永根, 沈永伟, 王剑波, 等. 水产品中组胺检测方法的探讨[J]. 职业与健康, 2007, 23(8): 657-659.
[12]FUNG D Y, LIN C C, GAILANI M B. Effect of phenolic antioxidants on microbial growth[J]. CRC Crit Rev Microbia1, 1985, 12(2): 153-183.
[13]GAILANI M B, FUNG D Y C. Antimicrobial effects of selected antioxidants in laboratory media and in ground pork[J]. J Food Protect, 1984, 47: 428-433.
Inhibition Effect of Antioxidants on Histamine Generation in Tuna during Frozen Storage
JIANG Li-yan,WANG Xia,WANG Pei,ZHENG Ping-an,GAO Xiang,JIANG Xin,SU Xiu-rong*
(Faculty of Life Science and Biotechnology, Ningbo University, Ningbo 315211, China)
A quick and accurate method for the determination of histamine content in tuna was proposed using high performance liquid chromatography with C18column and UV detector. Besides, fish meat from different parts of tuna was soaked in aqueous solutions containing sodium D-isoascorbate alone, sodium citrate alone, or both of them for 2-3 h before -20 ℃ storage, and the production of histamine was measured during the storage. The linear regression equation of the proposed method was obtained as follows: Y = 5.3748X+11.42, of which the linear range was between 10μg/mL and 1000μg/mL. The detection limit of the method was 3.684 μg/mL. This method is a simple, accurate and widely applicable method, and has been used to determine real samples with satisfying results. Antioxidant-treated tuna meat revealed a much lower level of histamine than its untreated counterpart. Among three treatment ways, combination of the two antioxidants best inhibited the production of histamine, followed by sodium D-isoascorbate alone, and the inhibition effect of sodium citrate alone was the worst. Our results demonstrated that antioxidant treatment not only prevented tuna meat from becoming dark due to oxidation, but effectively inhibited the production of histamine as well.
high performance liquid chromatography (HPLC);histamine;Thunnus obesus;antioxidants
TS254
A
1002-6630(2011)04-0255-03
2010-10-09
浙江省重中之重学科项目;宁波市重大(重点)科技攻关计划项目(2010C0125);宁波大学优势特色学科项目
姜李雁(1986—),女,硕士研究生,研究方向为食品安全与质量控制。E-mail:jly198605@126.com
*通信作者:苏秀榕(1956—),女,教授,博士,研究方向为食品科学与工程、生物化学与分子生物学。
E-mail:suxiurong@nbu.edu.cn
