响应曲面法优化双酶法提取莲房原花青素
2011-06-01汪志慧孙智达谢笔钧
汪志慧,孙智达*,谢笔钧
响应曲面法优化双酶法提取莲房原花青素
汪志慧,孙智达*,谢笔钧
(华中农业大学食品科学技术学院,湖北 武汉 430070)
利用Box-Behnken中心组合试验设计及响应面(RSM)分析,研究双酶法提取莲房原花青素(LSPC)的浸提条件对原花青素提取率的影响,利用SAS软件对莲房原花青素提取率的二次回归模型进行分析。结果表明:双酶法提取莲房原花青素的最佳工艺参数为酶解温度53℃、酶解时间1.6h、pH4.8、果胶酶:纤维素酶=1:1.1,在此工艺参数下原花青素的提取率为5.20%,优化后的工艺相对单一乙醇提取法提取率的3.84%,有明显的提高。采用DPPH法进行抗氧化性的对比,结果显示双酶法提取的莲房原花青素比单一醇法提取的原花青素的清除DPPH自由基的能力强。因此,由Box-Behnken响应曲面法优化所得的双酶法提取工艺可为莲房原花青素的工业提取提供参考和依据。
莲房;原花青素;酶解;提取率;中心组合设计;响应面
莲房是莲科植物莲(Nelumbo nucifera Gaertn.)的成熟花托,又名莲蓬壳(lotus seedpod,LS),具有消瘀、止血、去湿的功效[1]。现已研究发现莲房中含有的主要活性生理物质为原花青素,原花青素是至今为止发现的最有效的自由基清除剂之一[2],具有增强免疫力、保护心血管、预防高血压、抗肿瘤、抗辐射、抗突变及美容等作用[3-6]。由于它广泛的生理活性及出色的安全性,在食品化妆品及医药领域具有广阔的前景[7-8]。
目前,原花青素的提取方法有水溶剂提取法、有机溶剂提取法、微波提取法、超声提取法、超临界流体萃取法等[9-13],生物酶法提取植物中的原花青素是在传统的溶剂提取方法的基础上,根据植物细胞壁的构成,利用酶的反应所具有的高度专一性等特点,选择相应的酶,将细胞壁的组成成分水解或降解,破坏细胞壁结构,使有效成分充分暴露出来,溶解、混悬于溶剂中,从而达到提高原花青素提取率的目的[14-17],而莲房中的原花青素几乎被以纤维素和果胶为主要构成的莲房细胞壁所包围,因此本实验选用纤维素酶和果胶酶对莲房进行酶解,基于以上原理建立了双酶法提取莲房原花青素的工艺,以期得到较高的提取率。
响应曲面法(response surface methodology,RSM)采用合理的试验设计,能以经济的方式,用较少的试验数量和时间对试验进行全面研究,不仅可以建立连续变量曲面模型,对因素及其交互作用也可以进行评价,可以有效快速地确定多因素系统的最佳条件[17]。RSM虽然广泛用于众多过程优化控制等领域[18-20],但关于莲房原花青素双酶法提取工艺条件的优化未见报道。本实验采用RSM法,以莲房原花青素提取率为考察指标,对影响莲房原花青素提取提取率的一些关键因素进行研究,探求酶法提取莲房原花青素的最佳工艺条件,以便于对莲房资源进一步开发利用。
1 材料与方法
1.1 材料与试剂
莲房采自武汉市汤逊湖,品种为武植2号;葡萄籽原花青素标准品(纯度95%) 天津市尖峰天然产物研究开发有限公司;纤维素酶(10000U/g) 北京奥博星生物技术有限责任公司;果胶酶(30000U/g) 北京双旋微生物培养基制品厂;DPPH自由基 美国Sigma公司;香草醛、浓硫酸、甲醇、乙醇均为分析纯 国药集团化学试剂有限公司。
1.2 仪器与设备
FuheHH-4数显恒温水浴锅 金坛市富华仪器有限公司;RE-111型旋转蒸发仪 瑞士Buchi公司;SH2-Ⅲ型循环水真空泵 上海亚荣生化仪器厂;UV-9100紫外-可见分光光度计 北京瑞利公司;电子天平 德国Sartorius公司。
1.3 方法
1.3.1 原花青素双酶法提取
新鲜莲房经粉碎后,准确称取10g,加入双酶(果胶酶-纤维素酶)进行酶解反应,酶解时溶液的体积为50mL,然后用乙醇提取,提取温度55℃,乙醇体积分数65%,提取时间120min。抽滤得提取液,在50℃条件下用旋转蒸发仪将乙醇蒸出,定容至100mL测定莲房原花青素提取率。
1.3.2 原花青素单一醇提取法提取率
新鲜莲房经粉碎后,准确称取10g,用100mL体积分数65%乙醇溶液55℃浸提120min,抽滤得提取液,在50℃条件下用旋转蒸发仪将乙醇蒸出,定容至100mL测定单一醇提法的莲房原花青素提取率。
1.3.3 原花青素提取率的测定

1.3.4 单因素及响应曲面法试验设计和统计分析
单因素影响试验主要考虑酶解温度、酶解pH值、酶解时间以及加酶量等因素原花青素提取率的影响。响应曲面法试验设计采用Box-Behnken模型,以酶解温度、酶解pH值、酶解时间以及加酶比例(果胶酶:纤维素酶)为主要考察因素(自变量),分别用X1、X2、X3、X4表示,按方程:Xi=(xj—x0)/Δx对自变量进行编码,其中,Xi为自变量的编码值,xj为自变量的真实值,x0为试验中心点处自变量的真实值,Δx为自变量的变化步长[15]。并以1、0、-1分别代表自变量的高、中、低水平,因素编码及各自变量水平见表1。
采用SAS9.0对试验数据进行回归分析。该模型通过最小二乘法拟合二次多项方程可以表达为:

式中:Y为响应值(莲房原花青素提取率);A0为常数项;Ai为线性系数;Aii为二次项系数;Aij为交互项系数;Xi、Xj(i≠j)为自变量编码值。

表1 双酶法提取莲房原花青素响应面试验因素水平及编码Table 1 Coded values and corresponding actual values of factors in CCD design
1.3.5 清除二苯三硝基苯肼自由基(DPPH自由基)的IC50值及清除率的计算
DPPH自由基是一种稳定的以氮为中心的自由基,通过在515nm波长处检测双酶法和单一醇法提取的莲房原花青素对DPPH自由基的清除效果,计算其抗氧化能力,并计算出自由基清除率为50%时自由基清除剂质量浓度,即IC50(半数抑制率质量浓度)。
取不同稀释度的提取液2mL和2×10-4mol/L DPPH自由基甲醇溶液2mL,加入同一具塞试管中,摇匀,在室温避光反应30min后于515nm处测其吸光度,并用VC溶液作为阳性对照,计算两种方法提取的原花青素对DPPH自由基的清除率[22],公式如下:

式中:A0为对照组吸光度;Ai为样品组吸光度;Aj为空白组吸光度。
2 结果与分析
2.1 响应曲面法试验设计及结果
单因素试验结果显示:酶解温度55℃、酶解pH5.0、酶解时间1.5h、纤维素酶和果胶酶的加酶比为1:1时莲房原花青素有最大的提取率。莲房原花青素提取的响应曲面实验设计方案与试验结果见表2,按照1.3.4节对酶解温度、酶解pH值、酶解时间以及加酶比作变换,以莲房原花青素提取率为响应值(Y),共27个试验点,其中24个为析因点,3个为中心点试验进行了3次,以估计误差。

表2 莲房原花青素提取试验设计与结果Table 2 Experimental design for response surface analysis and corresponding results
利用SAS 9.0统计软件对表2试验数据进行多元回归拟合,得莲房原花青素提取率(模型)的二次多元回归方程:Y= 5.25-0.069167X1+0.3025X4-0.12125X12+ 0.13X1X3+0.1X1X4-0.15X22-0.1575X32-0.12X3X4-0.76125X42。
2.2 模型的显著性检验
从回归模型方差分析(表3)可见,试验选用的模型极显著(P<0.0001),失拟项不显著P=0.270194>0.05,说明模型是合适的;模型的校正决定系数R2Adj=0.9575,说明该模型能解释95.75%响应值的变化,仅有总变异大约4.25%不能用该模型来解释;相关系数R2=0.9804,说明该模型拟合程度良好,预测值与实测值之间有较好的相关性,试验误差小,可以用该模型来分析和预测莲房原花青素的提取率。

表3 回归模型方差分析Table 3 Variance analysis of the regression model for the extraction yield of procyanidins

表4 二次多项式回归模型系数的显著性检验结果Table 4 Significance test of each regression coefficient of the regression model for the extraction yield of procyanidins
图1为莲房原花青素提取率(Y)实测值相对回归方程预测值的偏离情况对照图例。在设定的27组试验中最小响应值为4.00,最大值为5.33;预测值与实测值之间的最大偏差为:

即最大偏差为8.47%。从这一方面说明采用响应曲面法进行双酶法提取莲房原花青素的试验设计所得回归方程(模型)是可行的。
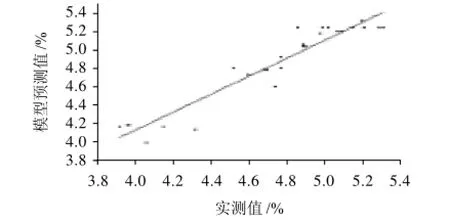
图1 实测值与模型预测值对照图Fig.1 Plot of model-predicted values against experimental values of the extraction yield of procyanidins
由表4回归方程系数显著性检验可知,在此试验设计中,一次项X1显著,X4极显著(P<0.01),二次项X1X3、X1X4、X3X4显著(P<0.05),X12、X22、X32、X42极显著(P<0.01),其余项均不显著。
2.3 响应面交互作用分析
回归模型的响应曲面及其等高线见图2,3组图直观地反映了各因素对响应值的影响。由三组图对比可知,加酶比(X4)对莲房原花青素提取率影响最为显著,表现为图2B、2C的曲面较陡。等高线的形状可反映出交互效应的强弱,椭圆形表示两因素交互作用显著,而圆形则与之相反[23]。由图2B、2C等高线可以看出,酶解温度和加酶比以及酶解pH值和加酶比的交互作用显著,表现为等高线呈椭圆形。相比较而言,酶解温度和酶解pH值之间的交互作用稍弱。


图2 各因素交互作用的响应面与等高线图Fig.2 Response surface of the pairwise interactive effects of various hydrolysis conditions on the extraction yield of procyanidins
2.4 最优提取条件
通过采用SAS软件的Rsreg回归分析语句编写对试验模型进行典型性分析,以获得最大莲房原花青素提取率时的提取条件,经典型性分析得:在X1=-0.38624、X2=0.10911、X3=-0.33626、X4=0.20036(即莲房原花青素提取的最佳条件为酶解温度53.07℃、酶解时间1.56h、pH4.8、果胶酶:纤维素酶=1:1.08)条件下,莲房原花青素提取的理论值达到5.30%。考虑到实际操作的便利,将莲房原花青素的提取工艺条件优化为酶解温度53℃、酶解时间1.6h、pH4.8、果胶酶:纤维素酶=1:1.1,此条件下,莲房原花青素提取的理论值达到5.24%。
2.5 试验模型的验证和比较
设定提取次数为3次,对模型得到的最优条件和考虑过实际操作的便利性后得到的最终条件进行验证实验。实验结果表明,模型得到的最优条件下的实际提取率为(5.28±0.02)%,考虑过实际操作的便利性后得到的最终条件下的实际提取率为(5.20±0.03)%,均与理论最大值非常接近,说明模型可以较好的反映出莲房原花青素提取的条件,从而也说明了用响应面法对莲房原花青素提取条件参数进行优化是可行的。
2.6 双酶法与单一醇提法对莲房原花青素的提取率的对比
比较双酶法与醇提法提取莲房原花青素,由实验测得单一乙醇提取法莲房原花青素的提取率为(3.84±0.02)%,双酶法提取率为(5.20±0.03)%,两者比较,双酶法提取率明显较高。
2.7 双酶法与单一醇提法提取的原花青素清除DPPH自由基能力的比较

图3 莲房原花青素清除DPPH自由基的能力Fig.3 Comparison on DPPH radical scavenging activity of lotus seed pod procyanidins extracted by different methods
按照1.3.5节方法,测得两种不同方法提取的原花青素和VC在波长515nm处的吸光度。如图3可以看出,两种不同方法提取的原花青素提取液及VC溶液都有较强的清除DPPH自由基的能力,并且随着溶液质量浓度的增加,清除率也逐渐增加。双酶法提取的莲房原花青素的IC50为6.66mg/L,单一醇法和VC的IC50分别为7.43、9.07mg/L,表明双酶法提取的莲房原花青素较之单一醇法提取的莲房原花青素有着较强的抗氧化能力。
3 结 论
采用Box-Behnken的中心组合设计及响应面(RSM)分析,建立莲房原花青素提取的二次多项式数学模型。经检验证明该模型是合理可靠的,能够较好地预测莲房原花青素提取率。利用模型的响应面及其等高线,对影响原花青素提取率的关键因素及其相互作用进行探讨,通过典型分析并考虑到实际操作的便利性得到的最终优化工艺参数为酶解温度53℃、酶解时间1.6h、pH4.8、果胶酶:纤维素酶=1:1.1。在此条件下进行验证实验所得莲房原花青素提取率为5.20%,对比乙醇提取法3.84%的提取率,双酶法具有明显高的提取率。且双酶法提取的莲房原花青素清除DPPH自由基的能力强于单一乙醇提取法的莲房原花青素。因此,利用响应面分析方法对双酶法提取莲房原花青素工艺进行优化,可获得最优的工艺参数,能有效减少工艺操作的盲目性,从而为进一步的工业化提取奠定基础,以便于对莲房资源进一步开发利用。
[1]凌智群. 莲花原花青素及其生物药理活性研究[D]. 武汉: 华中农业大学, 2001.
[2]高军涛, TANG Huiru, 侯京武, 等. 葡萄籽中多酚类物质对氧自由基清除作用的ESR研究[J]. 波谱学杂志, 1999, 16(5): 409-415.
[3]BAS J M D, FEMANDEZ-LARREA J, BLAY M, et a1. Grape seed procyanidins improve atherosclerotic risk index and induce liver CYP7A1 and SHP expression in healthy rats[J]. J Express Article, 2005, 19(3): 479-481.
[4]HUYNH T H, TEEL R W. Selective induction of apoptosis in human mammary cancer cells (MCF-7) by pycnogenol[J]. Anticancer Res, 2000, 20(4): 2417-2420.
[5]BLAZSO G, GABOR M, ROHDEWALD P. Antiinflammatory activities of procyanidin-containing extract from Pinus pinaster Ait. after oral and cutaneous application[J]. Pharmazie, 1997, 52(5): 380-382.
[6]BAGCHI D, BAGCHI M, STOHS S J, et al. Free radicals and grape seed proanthocyanidin extract: importance in human health and disease prevention[J]. Toxicology, 2000, 148(2): 187-197.
[7]赵超英, 姚小曼. 葡萄籽提取物原花青素的营养保健功能[J]. 中国食品卫生杂志, 2000, 12(6): 38-41.
[8]ULLA S, HEIKKI V, RISTO K et a1. Isolation and identification of oligomeric procyanidins from Crataegus leaves and flowers[J]. Phytochemistry, 2002, 608(8): 821-825.
[9]赵文军, 吴雪萍, 王旭. 葡萄籽中低聚原花青素提取条件研究[J]. 食品科学, 2004, 25(2): 117-120.
[10]李凤英, 崔蕊静, 李春华. 采用微波辅助法提取葡萄籽中的原花青素[J]. 食品与发酵工业, 2005, 31(1): 39-42.
[11]赵春艳, 张泽生, 刘海俊. 微波提取山楂果中原花青素工艺的研究[J]. 食品研究与开发, 2005, 26(6): 37-40.
[12]徐怀德, 闫宁环, 陈伟, 等. 黑莓原花青素超声波辅助提取优化及抗氧化性研究[J]. 农业工程学报, 2008, 24(2): 264-269.
[13]胡佳兴, 楼一层, 李淼. 葡萄籽中原花青素的超临界CO2萃取工艺优选[J]. 中国医院药学杂, 2008, 28(12): 968-970.
[14]韩爱霞, 任彦蓉. 果胶酶对枸杞中总黄酮的提取效果研究[J]. 食品科技, 2009, 34(8): 138-141.
[15]王敏, 陆兆新, 吕凤霞, 等. 响应曲面法优化酶法提取银杏叶总黄酮[J]. 食品科学, 2007, 28(3): 117-121.
[16]余清, 许慧星, 肖小蓉, 等. 基于响应面分析法优化的乌饭树叶总黄酮提取条件[J]. 中国农学通报, 2008, 24(1): 93-98.
[17]肖卫华, 韩鲁佳, 杨增玲, 等. 响应面法优化黄芪黄酮提取工艺的研究[J]. 中国农业大学学报, 2007, 12(5): 52-56.
[18]吴有炜. 试验设计与数据处理[M]. 苏州: 苏州大学出版社, 2002: 135-142.
[19]FABIO M, ANTONIO M M. Use of response surface methodology to describe the combined effects of pH, temperature and E/S ratio on the hydrolysis of dogfish (Squalus acanthias) muscle[J]. International Journal of Food Science and Technology, 1996, 31(5): 419-426.
[20]CHANDRIKA L P, FEREIDOON S. Optimization of extraction of phenolic compounds from wheat using response surface methodology[J]. Food Chemistry, 2005, 93(1): 47-56.
[21]孙芸谷, 文英. 硫酸-香草醛法测定葡萄籽原花青素含量[J]. 食品与发酵工业, 2003, 29(9): 43-46.
[22]周玮婧, 孙智达.谢笔钧, 等. 荔枝皮原花青素提取工艺优化[J]. 农业工程学报, 2009, 25(1): 175-179.
[23]杜玉兰, 黎庆涛, 王远辉. 响应曲面法优化鼠尾藻中脂质的提取工艺[J]. 天然产物研究与开发, 2008, 20(6): 1091-1094.
Optimization of the Double-enzymatic Extraction of Procyanidins from Lotus Seed Pods Using Response Surface Methodology
WANG Zhi-hui,SUN Zhi-da*,XIE Bi-jun
(College of Food Science and Technology, Huazhong Agricultural University, Wuhan 430070, China)
A process for extracting procyanidins from lotus seed pods consisting of simultaneous double-enzymatic hydrolysis with pectinase and cellulose and subsequent extraction with 65% aqueous ethanol solution was proposed in this study. Central composite design (CCD) coupled with response surface methodology (RSM) was used to investigate the optimization of the double-enzymatic hydrolysis of lotus seed pods for improved procyanidin extraction. A mathematical predictive model for the extraction yield of procyanidins was established based on the experimental data from CCD design, and analyzed using SAS software. The results showed that the optimal technological conditions for the hydrolysis of lotus seed pods were as follows: hydrolysis temperature, 53 ℃; hydrolysis time, 1.6 h; initial hydrolysis pH, 4.8; and the ratio of pectinase to cellulose, 1: 1.1, and the yield of procyanidins was 5.20% after hydrolysis under these conditions followed by 120 min extraction at 55 ℃with 65% aqueous ethanol solution, 35.7% higher than that of single ethanol extraction. In addition, procyanidins extracted by the method had stronger ability to scavenge DPPH radicals than those derived from single ethanol extraction.
lotus seed pod;procyanidins;enzymatic hydrolysis;extraction rate;central composite design;response surface methodology
TS201.1
A
1002-6630(2011)04-0064-05
2010-03-29
国家“863”计划项目(2007AA100401)
汪志慧(1984—),女,硕士研究生,研究方向为天然产物化学。E-mail:wangzhihui100@yahoo.cn
*通信作者:孙智达(1963—),男,教授,博士,研究方向为天然产物化学。E-mail:sunzhida@mail.hzau.edu.cn
