响应面优化转谷氨酰胺酶改性大豆分离蛋白工艺
2011-06-01陈丽娜代永刚
吴 琼,陈丽娜,代永刚,陈 星
响应面优化转谷氨酰胺酶改性大豆分离蛋白工艺
吴 琼1,陈丽娜1,代永刚2,陈 星1
(1.长春大学 农产品深加工吉林省重点实验室,吉林 长春 130022;2.吉林省农业科学院农产品加工研究中心,吉林 长春 130033)
为获得适于添加到冷饮食品中的大豆分离蛋白,利用转谷氨酰胺酶(TG)对其进行改性,提高其乳化性。采用响应面试验设计,以酶添加量、酶解时间、酶解温度为试验因素,以乳化活力指数为响应值,建立数学模型,对酶解条件进行优化。结果表明,最佳酶解条件为TG酶的添加量0.93×10-4g、温度46℃、时间1.2h。在此条件下,乳化活力指数的预测值为1.9623m2/g,验证实验所得乳化活力指数为1.9658m2/g。所得回归模型拟合情况良好,达到设计要求,本实验得到的改性大豆分离蛋白的乳化性显著高于未改性的大豆分离蛋白。
大豆分离蛋白;转谷氨酰胺酶;改性;乳性活力指数
大豆分离蛋白(soy protein isolate,SPI)是以低温脱溶大豆粕为原料生产的一种全价蛋白类食品添加剂[1]。其营养价值高、资源丰富、原料成本低,是植物蛋白中为数不多的可替代动物蛋白的品种之一。然而,大豆分离蛋白在现代食品加工中的应用受到一定的限制。这主要是由于大豆蛋白的功能性质还不能满足现代食品加工的需求。因此,需要对大豆分离蛋白进行改性。SPI的改性就是通过改变蛋白质的一个或几个理化性质达到加强或改善蛋白质功能性的目的,并提高大豆制品营养成分的生物有效利用性[2-3]。SPI改性方法有物理改性、化学改性、酶改性和生物工程改性[4-5]。适当的改性可产生合适的功能性质,拓宽SPI在食品工业中作为添加剂应用的范围[6-7]。
转谷氨酰胺酶(transglutaminase,TG)是从微生物中提取的一种能够催化酰基转移反应的转移酶[8-10]。在大豆蛋白的制品中,TG酶常被用来提高最终产品的凝胶强度和乳化活力[11-12]。
本研究通过转谷氨酰胺酶对SPI进行改性,提高其乳化性,采用响应面分析法(response surface methodology,RSM)对酶解条件进行优化,建立数学模型,得到最佳酶解工艺。本研究旨在获得适于添加到冷饮中的大豆分离蛋白,替代传统冷饮食品中的乳蛋白和部分添加剂。
1 材料与方法
1.1 材料与试剂
大豆分离蛋白 通榆县益发合大豆制品有限责任公司;转谷氨酰胺酶(TG) 日本味之素公司;磷酸二氢钠、磷酸氢二钠、十二烷基硫酸钠(SDS)等均为分析纯。
1.2 仪器与设备
DK-98-2A电热恒温水浴锅 天津市泰斯特仪器有限公司;JJ-1电动搅拌器、JJ-2组织捣碎机 金坛市城西晓阳电子仪器厂;UV-2201紫外-可见分光光度计 日本岛津公司;TDL-40B离心机 上海安亭科学仪器厂。
1.3 大豆分离蛋白的酶解改性
每份称取SPI 5g,配制成质量分数5%的溶液,80℃水浴搅拌加热30min,取出,冷却至室温,放入4℃冰箱中冷却过夜,备用。取热处理的SPI,加入一定量的TG,在35~50℃水浴中,用电动搅拌器搅拌,酶解0.5~1.5h,取出,立即放到沸水中灭酶15min,冷却干燥,进行乳化活力指数(emulsion activity index,EAI)的测定[13]。
将TG改性SPI用0.01mol/L、pH7.0 NaH2PO4-Na2HPO4缓冲液配制质量分数0.8%溶液,取10mL色拉油与20mL待测溶液于均质机中均质1min,用微量注射器取3μL,用含0.1%十二烷基硫酸钠(SDS)的相同缓冲液稀释成3mL,立即用分光光度计在500nm波长处测定吸光度(A)。

式中:EAI为每克蛋白质的乳化面积/(m2/g);Φ为油相所占的体积分数,本实验中油相占1/3;C为蛋白质的质量分数(0.8%);L为比色池光径(10mm);n为稀释倍数。
根据预实验,选定酶添加量(相对于1g底物)、加热时间、加热温度3个考察因素及其变化区间,设计三因素三水平共20个试验点的响应面试验方案,建立数学回归模型,反映不同因素间的交互影响,对工艺参数进行最优化分析,最后得出最佳酶解条件。以乳化活力指数为响应值,每个试验点做3个平行样,取平均值。

表1 响应面试验优化转谷氨酰胺酶活性大豆分离蛋白工艺因素水平表Table 1 Factors and levels in response surface design
1.4 数据统计与分析
采用设计专家软件(Design-Expert software 7.0)中的响应面设计法进行数据分析。
2 结果与分析
2.1 响应面试验结果
经过一段时间热处理的SPI乳化性能、表面疏水性和溶解度均有所提高[14]。所以本研究采用加热处理对大豆分离蛋白进行预处理。响应面试验结果及方差分析见表2、3。

表2 转谷氨酰胺酶改性大豆分离蛋白工艺响应面试验设计及结果Table 2 Response surface design arrangement and experimental results
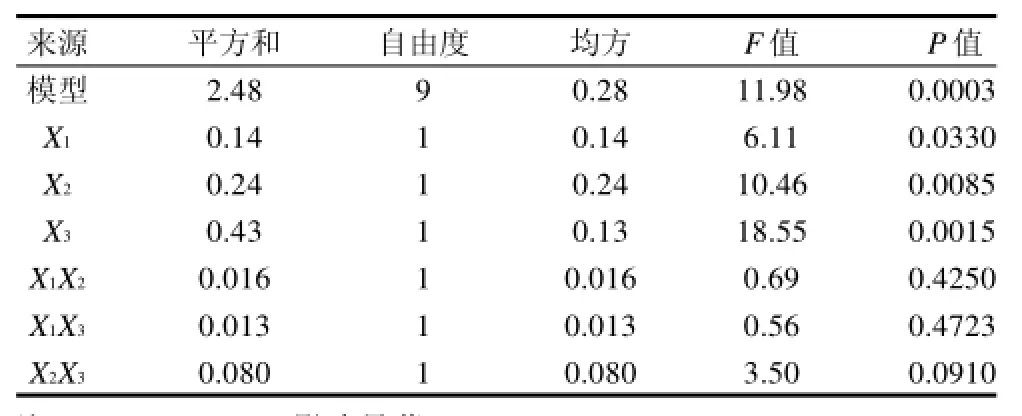
表3 正交试验结果方差分析表Table 3 Variance analysis of fiited regression model
本研究采用响应面试验设计建立一个模型来优化转谷氨酰胺酶改性大豆分离蛋白工艺。通过分析自变量和因变量得到一个能够在给定的范围内预测响应值的回归方程。TG改性SPI乳化活力指数的回归方程为:
EAI=1.83+0.12X1+0.16X2+0.21X3+0.045X1X2+0.040X1X3+0.10X2X3-0.30X12-0.27X22-0.078X32
本研究得到模型的决定系数为0.957,这表明95.7%的变化能够通过这个模型解释[15],因此,可以用该模型对TG改性SPI乳化性进行分析和预测。从表3可以看出,本研究所得回归模型显著(P<0.05),因此,此模型能充分地表明各因素之间的关系。在给定的水平范围内,酶添加量、酶解温度、酶解时间均是影响显著的因素。3个因素对TG改性大豆分离蛋白乳化性的影响依次为酶解时间>酶解温度>酶添加量。
根据所建立的数学模型进行参数最优化分析,取得最佳TG改性大豆分离蛋白EAI的参数条件为:TG酶添加量0.93×10-4g、温度46℃、时间1.2h,在此条件下EAI模型的预测值为1.9632m2/g,实际得到的EAI值为1.9658m2/g。预测值与实验值拟合良好。
大豆分离蛋白的EAI值为0.956m2/g,通过TG改性后,得到的改性SPI的EAI值明显高于未改性的SPI,说明改性成功。
2.2 因素交互作用
利用Design-Expert软件对数据进行二次多元回归拟合,3因素之间的交互作用见图1~3。当酶解时间1h时,酶添加量和酶解温度对TG改性SPI乳化活力指数的交互影响见图1。由图1可见,当酶添加量不变时,EAI值随着酶解温度的升高先增大后降低,当酶解温度达到42.50℃时,EAI值达到最大值。当酶解温度不变时,EAI值随着酶添加量的增加逐渐增大,当酶添加量达到0.8×10-4g时,EAI值开始下降。

图1 酶添加量与酶解温度对乳化活力指数的交互影响Fig.1 Effect of cross-interaction between TG addition amount and hydrolysis temperature on EAI

图2 酶添加量与酶解时间对乳化活力指数的交互影响Fig.2 Effect of cross-interaction between TG addition amount and hydrolysis time on EAI

图3 酶解温度与酶解时间对乳化活力指数的交互影响Fig.3 Effect of cross-interaction between hydrolysis temperature and hydrolysis time on EAI
当酶解温度42.50℃时,酶添加量和酶解时间对TG改性SPI乳化活力指数的交互影响见图2。由图2可见,当酶添加量不变时,EAI值随着酶解时间的增加而增加,当酶解时间达到1.5h时,EAI值达到最大为1.9614m2/g。当酶解时间固定不变时,随着酶添加量的增加,EAI也逐渐增大,当酶添加量为0.8×10-4g时,EAI值开始下降。
当酶添加量0.8×10-4g时,酶解温度和酶解时间对TG改性SPI乳化活力指数的交互影响见图3。由图3可见,当酶解温度不变时,EAI值随着酶解时间的增加而增加。当酶解时间1.5h时,EAI达到最大。当酶解时间不变时,随着酶解温度的增加,EAI值也逐渐增大,但当温度达到42.5℃,EAI值达到最大,随着温度继续升高,EAI值逐渐降低。
3 结 论
通过响应面试验设计对转谷氨酰胺酶改性大豆分离蛋白的酶解条件进行优化,取得最佳TG改性SPI酶解条件为TG酶添加量0.93×10-4g、酶解温度46℃、酶解时间1.2h。在此条件下,EAI预测值为1.9623m2/g,验证实验所得EAI值为1.9658m2/g。所得回归模型拟合情况良好,达到设计要求。
本研究采用转谷氨酰胺酶对大豆分离蛋白进行改性,整个改性过程不添加任何化学试剂,所得到的改性大豆分离蛋白安全无毒,并且提高了其乳化性和营养价值。可以直接添加到冷饮食品中,替代部分乳蛋白,提高冷饮食品的营养,降低生产成本,并起到乳化剂的作用,从而可以降低冷饮食品中乳化剂和稳定剂的使用,生产出一种安全、绿色的冷饮食品。本研究为提高大豆分离蛋白的应用范围提供了依据。
[1]杜长安. 植物蛋白工艺学[M]. 北京: 中国商业出版社, 1995: 30.
[2]黄友如, 华欲飞, 裘爱泳. 大豆分离蛋白功能性质及其影响因素[J].粮食与油脂, 2003, 21(5): 12-14.
[3]黄友如, 华欲飞. 大豆分离蛋白的改性及其对功能性质的影响[J]. 中国油脂, 2003, 28(4): 35-38.
[4]华欲飞. 大豆分离蛋白性能优化关键技术[J]. 中国油脂, 2001, 26(6): 79-81.
[5]邓勇, 吴煌欢. 微生物蛋白酶对大豆分离蛋白水解作用的研究[J]. 食品科学, 1999, 20(6): 42-45.
[6]李亚娜, 赵谋明, 李敏, 等. 酶改性大豆分离蛋白在高蛋白奶中的应用研究[J]. 食品科学, 2003, 24(5): 53-56.
[7]吴琼, 陈丽娜, 代永刚, 等. 酶改性大豆分离蛋白在冰淇淋生产中的应用[J]. 食品科学, 2010, 31(14): 313-315.
[8]刘心伟, 吕加平, 范贵生. 微生物转谷氨酰胺酶在食品工业中的研究进展[J]. 内蒙古农业大学学报, 2005, 26(4): 54-57.
[9]ZHENG Meiying, DU Guocheng, GUO Wangfang, et al. A temperatureshift strategy in batch microbial transglutaminase fermentation[J]. Process Biochemistry, 2001, 36(6): 525-530.
[10]FARNSWORTH J P, LI J, HENDRICKS G M, et al. Effects of transglutaminase treatment on functional properties and probiotic culture survivability of goat mild yogurt[J]. Small Ruminant Research, 2006, 65(1): 113-121.
[11]祖海珍, 徐幸莲, 鲁奕俊, 等. 不同热处理温度下转谷氨酰胺酶对混合蛋白凝胶性的影响[J]. 江苏农业学报, 2005, 21(3): 185-190.
[12]SHAND P J, YA H, PIETRASIK Z, et al. Transglutaminase treatment of pea proteins: effect on physicochemical and rheological properties of heat-induced protein gels[J]. Food Chemistry, 2008, 107(2): 692-699.
[13]胡敏, 张伟, 赵谋明, 等. 乳化稳定剂在改性大豆分离蛋白冰淇淋中的应用研究[J]. 食品与发酵工业, 2003, 29(2): 49-53.
[14]PETRUCCELLI S, ANON M C. Relationship between the method of obtention and the structural and functional properties of soy protein isolates. 2. Surface properties[J]. Journal of Agricultural and Food Chemistry, 1994, 42(10): 2170-2176.
[15]JOGLEKAR A M, MAY A T. Product excellence through design of experiments[J]. Cereal Foods World, 1987, 32(12): 857-868.
Modification of Soy Protein Isolate with Transglutaminase
WU Qiong1,CHEN Li-na1,DAI Yong-gang2,CHEN Xing1
(1. Key Laboratory of Agricultural Products Processing in Jilin Province, Changchun University, Changchun 130022, China;2. Center of Agro-Food Technology, Jilin Academy of Agricultural Sciences, Changchun 130033, China)
Soy protein isolate (SPI) was modified by transgultaminase (TG) to improve its emulsifying properties so as to obtain modified SPI suitable for cold drinks and foods. Response surface design was used to explore the effects of enzyme addition amount and hydrolysis time and temperature on emulsifying activity index (EAI) and establish a mathematic model of optimal enzymatic hydrolysis conditions. Results showed that the optimal modification conditions were TG dosage of 0.93×10-4g, hydrolysis temperature of 46 ℃and hydrolysis time of 1.2 h. Under the optimal conditions, the experimental EAI was 1.9658 m2/g, which was close to the predicted EAI of 1.9623 m2/g. Moreover, modified SPI revealed higher emulsion capacity than that of native SPI.
soy protein isolate;transglutaminase;modification;emulsion activity index
TS201.2
A
1002-6630(2011)04-0007-04
2010-04-21
吉林省教育厅“十一五”科学技术研究项目(吉教科合字2009第448号);
长春市科技局应用技术研究计划项目(08YJ18)
吴琼(1978—),女,讲师,博士,研究方向为天然产物开发与应用。E-mail:rabbit7815@163.com
