比格犬SLAM基因的克隆与序列分析*
2011-05-31苏建青褚秀玲马秀亮张吉清
苏建青,褚秀玲,江 成,马秀亮,张吉清
(聊城大学农学院,山东聊城 252059)
犬瘟热是犬类、毛皮动物和部分海洋哺乳动物的一种多发性、高度接触性烈性传染病[1]。病毒细胞受体是病毒宿主特异性和组织嗜性的一个决定因素,在病毒识别细胞受体进而感染宿主过程中起重要作用[2]。Tatsuo H 等[3-4]证实了犬的信号淋巴细胞激活因子(signalling lymphocyte activation molecule,SLAM)是犬瘟热病毒(Canine distemper rirus,CDV)的感染细胞受体。SLAM(也称为CD150,CDw150,PIO-3)是表达在未成熟的胸腺细胞、CD45RO+记忆性T细胞,激活的T和B淋巴细胞以及巨噬细胞和成熟树突状细胞表面上的糖蛋白,对调控机体淋巴细胞增殖、免疫球蛋白合成和分泌IFN-γ等细胞因子的共刺激因子等具有重要作用[5-6]。为了解比格犬犬瘟热细胞受体SLAM的序列结构特征以及相关物种间的差异,本研究拟对比格犬的细胞受体SLAM进行克隆和序列分析,以掌握其序列的结构特点和其他物种间的差别,了解其功能结构区域和作用位点,为进一步构建表达犬SLAM受体的转化细胞系奠定基础。
1 材料与方法
1.1 材料
1.1.1 试剂 犬淋巴细胞分离液(LTS-1079)为中国医学科学院生物工程医学研究所产品;RPMI-1640培养基、Trizol、AMV反转录酶、RNase抑制剂、dNTP、刀豆球蛋白 A(concanavalin A,ConA)、OligodT(15)、r Taq DNA 聚合酶、pMD 18-T载体、感受态细菌JM109以及各种限制性内切酶为泰安联星生物工程有限公司产品。
1.1.2 试验用动物 比格犬来自宠物医院门诊,雄性,2岁,体重16.5kg。
1.2 方法
1.2.1 犬外周血淋巴细胞分离和培养 用加有肝素抗凝剂的无菌注射器采集5mL比格犬的血液,按照犬淋巴细胞分离液说明书进行外周血淋巴细胞分离,将分离后的淋巴细胞用Hank′s液洗2次,用含100mL/L小牛血清的RPMI-1640培养基稀释到适当的浓度(约106个细胞/mL),加入到6孔细胞培养板,置37℃、体积分数为5% 的CO2培养箱中培养。如果细胞生长良好,每孔加入浓度1mg/mL Con A(终浓度10μg/mL)继续培养48h,收获淋巴细胞,用PBS(pH 7.2)洗涤2次后,用于 mRNA的提取。
1.2.2 引物 参考GenBank发表的犬SLAM基因序列(accession number:AF390108)设计扩增犬SLAM基因编码区引物。上游引物5′-GCCGATGGATTCCAGGGGCT-3′ ;下 游 引 物 5′-TCAGC TCTCTGGGAACGTCA-3′,由上海生工生物工程技术服务有限公司合成。扩增片段大小预期约1 033bp。
1.2.3 RNA的提取与cDNA的合成 RNA的抽提使用Trizol试剂按照说明操作。以10g/L的非变性琼脂糖凝胶电泳检测RNA的完整性,用分光光度法检测RNA的含量和纯度。参照Promega公司AMV反转录酶使用说明进行cDNA第一链合成。反应体系如下:将适量DEPC水溶解的RNA于70℃温育10min后,依次加入25pmol/μL OligodT(15)引物 1μL,2.5mmol/L dNTP 4μL,AMV RT 5×buffer 4μL,RNase inhibitor 0.5μL,AMV Reverse Transcriptase 0.5μL,最后加DEPC水至终体积20μL,42℃水浴1h,将样品于95℃加热5min,置-20℃保存。
1.2.4 SLAM 基因的扩增 根据TaKaRa r Taq DNA聚合酶说明书,建立20μL PCR扩增体系。PCR条件如下:首先94℃变性5min;94℃1min,53℃70s,72℃90s,35个循环;最后72℃10 min。扩增产物用10g/L琼脂糖凝胶电泳,使用琼脂糖凝胶回收试剂盒回收PCR产物,将回收产物按pMD18-T说明书连接到PMD18-T克隆载体上,挑选阳性克隆送上海生工生物工程技术服务有限公司测序。
1.2.5 序列分析 使用DNASTAR软件中的Clustal W将克隆测序得到的比格犬SLAM与人、牛、海豹、羊和狐狸等的SLAM基因序列进行比对,构建系统进化树。采用ExPASy网站的ProtParam(http://expasy.org/tools/protparam.htmL)计 算蛋白质的等电点及分子量;利用在线分析蛋白质跨膜区程序 Tmpred(http://www.ch.embnet.org/software/TMPRED_form.html)检测潜在跨膜区;利用信号肽在线预测工具SignalP(http://www.cbs.dtu.dk/services/SignalP/)预测信号肽区域;利用在线N-糖基化位点预测工具NetNGlyc(http://www.cbs.dtu.dk/services/NetNGlyc/)预测跨膜区外的潜在N-糖基化位点[8]。
2 结果
2.1 比格犬SLAM基因的克隆
通过RT-PCR从比格犬外周血淋巴细胞中成功扩增到SLAM基因序列(图1),扩增片段约1.0 kb以上,与预期相符。测序结果显示扩增片段全长1 033bp,其中开放阅读框(ORF)包括1 029个核苷酸,编码342个氨基酸,和NCBI上公布的犬SLAM基因大小完全一致。

图1 SLAM cDNA RT-PCR产物电泳结果Fig.1 SLAM cDNA RT-PCR products electrophoresis result
2.2 同源性分析和系统进化树构建
用Clustal W软件对6个物种的SLAM进行核苷酸和推导氨基酸多序列比对,人、牛、羊、狐狸和海豹的GenBank序列号分别是Human(AY040554), Cattle (AF329970), Sheep(NM001040288),Fox (EU678638) 和 Seal(AB428368)。比对结果见表1,右上角是6个物种的核苷酸序列比对结果,左下角是6个物种的推导氨基酸比对结果,和比格犬SLAM基因相似度最高的是狐狸,其次是海豹,这也和临床犬瘟热病毒可以感染这3种动物一致。牛和羊的相似度较高,符合临床牛瘟病毒可以同时感染牛和羊。说明了细胞受体决定了病毒感染宿主种类的关键作用。通过对各物种推导氨基酸的序列比对结果,发现目前已经证实的几个受体关键性氨基酸,如位点60、63、66、68、72、84、119、121和130具有较高的保守性,特别是犬、狐狸和海豹的完全相同。
基于多序列比对的结果,使用DNA Star软件中的 Neibor-joining算法构建系统进化树,比较不同物种SLAM基因的遗传关系(图2)。狗和狐狸的最近,其次是海豹,牛和羊在一个分支,人单独形成一个分支。
2.3 理化性质分析
ProtParam分析显示,SLAM蛋白的理论分子质量为38.16ku,等电点为8.02。潜在跨膜区进行分析显示,SLAM中239aa~263aa区间的得分高达3 036,属于SLAM的跨膜区。信号肽进行分析显示,SLAM中1aa~26aa的平均得分高达0.838,可能的剪切位点在26aa和27aa之间。NetNGlyc预测SLAM膜外区的N-糖基化结果显示,从N端第57、102、125、150、157位均存在可能性大于50%的N-糖基化位点,共5个。在SLAM的胞浆区序列中同样也包含3段高度保守的富含酪氨酸的基序(TxYxxV/I/A),被认为和SLAM的活化高度相关。以上分析显示,SLAM符合Ⅰ型跨膜糖蛋白的特征,N端具有26aa的信号肽区域,中间具有24aa的跨膜区域,胞外区具有5个潜在的N-糖基化位点(NX-S/T),胞内区具有3个保守的酪氨酸基序,和已经报道的其他CD2家族成员的结构相似。
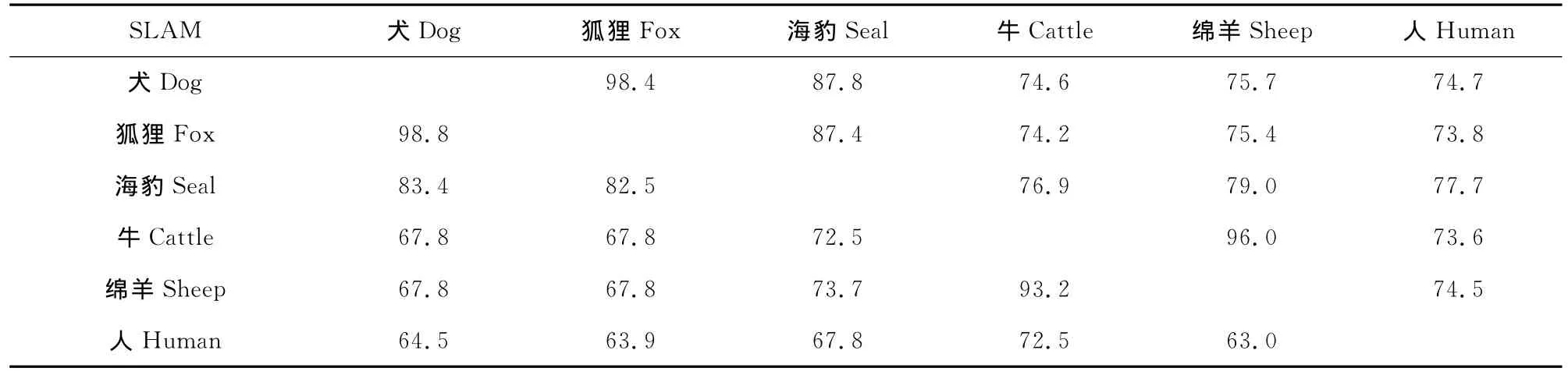
表1 不同物种间SLAM核苷酸和氨基酸序列比对结果Table 1 Comparison of nucleotide and deduced amino acid sequence identifies of SLAM gene among different species

图2 SLAM的系统进化树Fig.2 Phylogenetic tree of SLAM gene sequences
3 讨论
近年来越来越多的证据表明CDV比以前设想的具有更广的宿主范围,如CDV可以感染海豹、狮子、老虎、恒河猴、大熊猫和豹子等[7]。细胞表面受体为病毒的组织嗜性和感染宿主范围的决定因素,CDV的跨种间传播现象与其感染宿主的细胞受体的表达有着密切关系。犬信号淋巴细胞激活因子被证明是犬瘟热病毒感染宿主并引起免疫抑制的一个重要受体。SLAM是包含有胞质内尾部和特征信号序列的一类双功能受体,属于免疫球蛋白CD2超家族成员之一。SLAM对调控机体淋巴细胞增殖、免疫球蛋白合成和分泌IFN-γ等细胞因子的共刺激因子等具有重要作用。
因为细胞SLAM作为大部分副黏病毒的受体,目前已经确认的有人的麻疹病毒、牛的牛瘟病毒、羊的小反刍兽疫病毒和鲸、海豹等动物的瘟热病毒等。为了进一步研究犬瘟热病毒的跨种族传播和宿主范围的扩大,我们对常见的几种副黏病毒感染人、牛、羊、狐狸和海豹的SLAM受体进行序列分析,结果发现它们的核苷酸序列和氨基酸序列同源性分别高达73.6%~98.4%和63.0%~98.8%,为CDV 的跨种族传播奠定了基础。特别是已经发现和报道[9-10]的几个关键氨基酸位点高度保守一致,如位点60(Ile)和61(His)在5种动物中都一致,位点63、66、68、72、84、119、121和130在犬、狐狸和海豹中都一致,在牛和羊中都一致,即使是不一致的氨基酸如位点63(中性),119(中性),121(羟基类中性)和130(碱性)的氨基酸极性或类型高度一致。SLAM属于CD2家族的成员之一,其相类似蛋白的三维结构已经被测定,位于胞外的部分形成一个远膜的V结构域和一个近膜的C2结构域,随后是跨膜区和胞浆区[11-12]。胞外区具有 N-连接糖基化位点,胞内区具有3个保守的酪氨酸基序[13]。本试验序列分析结果也证实比格犬SLAM具有信号肽区、跨膜区、糖基化位点和3个保守的酪氨酸基序,和报道的受体类型相似。
CDV主要是通过病毒的血凝素蛋白H和宿主细胞受体的SLAM相互作用,而侵入感染细胞内部[14]。因为SLAM主要分布于淋巴细胞表面,所以感染经常造成患病动物的淋巴组织或器官损害,最终导致患病动物免疫抑制和继发感染[15]。通过对犬瘟热病毒细胞受体的序列结构特征分析,为进一步构建体外表达犬SLAM的转化细胞系奠定基础。
[1]Martella V,Elia G,Buonavoglia C.Canine distemper virus[J].Vet Clin North Am Small Anim Pract,2008,38(4):787-797.
[2]Zipperle L,Langedijk J P,Orvell C,et al.Identification of key residues in virulent canine distemper virus hemagglutinin that control CD150/SLAM-binding activity[J].J Virol,2010,84(18):9618-9624.
[3]Tatsuo H,Ono N,Tanka K,et al.SLAM(CDw150)is a cellular receptor for measles virus[J].Nature,2000,406:893-897.
[4]Adombi C M,Lelenta M,Lamien C E,et al.Monkey CV1cell line expressing the sheep-goat SLAM protein:a highly sensitive cell line for the isolation of peste des petits ruminants virus from pathological specimens[J].J Virol Meth,2011,173(2):306-313.
[5]Ma C S,Deenick E K.The role of SAP and SLAM family molecules in the humoral immune response[J].Ann NY Acad Sci,2011,1217:32-44.
[6]Yusuf I,Kageyama R,Monticelli L,et al.Germinal center T follicular helper cell IL-4production is dependent on signaling lymphocytic activation molecule receptor(CD150)[J].J Immunol,2010,185(1):190-202.
[7]Benetka V,Leschnik M,Affenzeller N,et al.Phylogenetic analysis of Austrian canine distemper virus strains from clinical samples from dogs and wild carnivores[J].Vet Rec,2011,168(14):377.
[8]魏小娟,张继瑜,王松泰,等.福氏志贺菌2a主动外排基因acrA的克隆和分子特征[J].畜牧与兽医,2010,42(1):56-58.
[9]Xu Q,Zhang P,Hu C,et al.Identification of amino acid residues involved in the interaction between measles virus haemagglutin(MVH)and its human cell receptor(signaling lympho-cyte activation molecule,SLAM)[J].J Biochem Mol Biol,2006,39:406-411.
[10]Ohishi K,Ando A,Suzuki R,et al.Host-virus specificity of morbilliviruses predicted by structural modeling of the marine mammal SLAM,a receptor[J].Comp Immunol Microbiol Infect Dis,2010,33(3):227-241.
[11]Navaratnarajah C K,Oezguen N,Rupp L,et al.The heads of the measles virus attachment protein move to transmit the fusion-triggering signal[J].Nat Struct Mol Biol,2011,18:128-134
[12]Corey E A,Iorio R M.Mutations in the stalk of the measles virus hemagglutinin protein decrease fusion but do not interfere with virus-specific interaction with the homologous fusion protein[J].J Virol,2007,81:9900-9910.
[13]Lee J K,Prussia A,Paal T,et al.Functional interaction between paramyxovirus fusion and attachment proteins[J].J Biol Chem,2008,283:16561-16572.
[14]Chen J,Liang X,Chen P F.Canine distemper virus utilizes different receptors to infect chicken embryo fibroblasts and vero cells[J].Virol Sin,2011,26(2):139-45
[15]Wenzlow N,Plattet P,Wittek A,et al.Immunohistochemical demonstration of the putative canine distemper virus receptor CD150in dogs with and without distemper[J].Vet Pathol,2007,44:943-948.
