关中奶山羊乳房炎灭活菌苗的制备及其免疫效果测定*
2011-05-31李成山陈德坤
牟 珊,李成山,陈德坤
(西北农林科技大学动物医学院,陕西杨凌 712100)
乳房炎主要发生于泌乳动物,尤其在奶牛最为常见。近年来随着奶山羊养殖的迅速发展,奶山羊乳房炎问题表现的也日益突出[1-3]。据我们调查,发现圈养关中奶山羊隐性乳房炎的发生率在30%~60%,而一旦奶山羊乳房炎呈现临床症状不及时治疗,通常导致乳房坏死甚至个体死亡。奶山羊乳房炎不仅给养殖场造成严重的经济损失,同样也会导致羊乳品质下降,微生物超标,引发食品安全问题。由于抗生素治疗乳房炎的缺陷越来越明显[4-6],因此解决乳房炎问题的关键还在于有效的预防措施和手段。与奶牛乳房炎最大的不同之处在于,引起奶山羊乳房炎的病原菌种类相对较少。奶牛乳房炎的病原微生物种类至少在50中以上,包括细菌、真菌和病毒等,而奶山羊乳房炎的病原微生物则主要是葡萄球菌和大肠埃希菌[7]。据此我们认为,用疫苗预防奶山羊乳房炎是可行的。本研究以我们分离的关中奶山羊乳房炎地方菌株为材料,进行了相应的疫苗研制及其免疫后的抗体测定工作,现将结果报告如下,以期为相关研究提供有益的参考。
1 材料与方法
1.1 材料
1.1.1 试验菌株 西北农林科技大学动物医学院免疫学实验室从患乳房炎关中奶山羊乳汁中分离鉴定的金黄色葡萄球菌和大肠埃希菌。
1.1.2 试验用动物 成年泌乳期奶山羊,购自杨凌周围关中奶山羊养殖户,经诊断试剂检验为乳房炎阴性。
1.1.3 主要试剂及培养基 普通琼脂培养基为奥博星生物技术有限公司产品;无水乙醇、甲醛、双氧水、吐温-80(国产分析纯),粗蜂胶,转移因子(西北农林科技大学动物医学院免疫学实验室所制);LMT为兰州隐性乳房炎诊断液);BSA为陕西中美生物科技有限公司产品,HRP-兔抗羊IgG为北京奥博森生物有限公司产品,TMB为Sigma公司产品。
1.1.4 主要仪器 无菌操作台,恒温培养箱,恒温培养摇床,半自动高压灭菌锅(YXQ-LS-1881)为上海博讯有限公司产品,粉碎机,旋转蒸发仪(RE-52AA)为上海亚荣生化仪器厂产品,冻干机(SIM),低速离心机(LD4-2A)为北京医用离心机厂产品,冷冻离心机为Sigma公司产品,制冰机,超声波细胞破碎仪(sonics),漩涡仪,4℃、-20℃冰箱,酶标仪bio-Rad,微量移液枪(10μL~1 000μL),电磁炉,电子天平,显微镜,96孔微量反应板等。
1.2 方法
1.2.1 蜂胶提取物的制备 天然蜂胶-20℃过夜,次日取出捣碎,经粉碎机充分粉碎后,溶入750 mL/L的乙醇溶液中。24h后过滤,滤液用旋转蒸发仪减压浓缩蜂胶提取液至黏稠,-45℃真空冷冻干燥48h,即得蜂胶纯化干物质,密封4℃保存备用。
1.2.2 菌液的制备 将分离菌株接种于普通肉汤,37℃培养16h~18h。然后倒少量肉汤于普通琼脂培养皿中,轻轻晃动使之均匀铺于培养皿中,倾斜培养皿,用无菌针管吸出多余肉汤。37℃培养18h~24h,倒入少量无菌生理盐水,刮取细菌,即为所扩菌液,4 000r/min离心10min,其去上清,用无菌生理盐水稀释,麦氏比浊法计数,调整两种细菌浓度至2×1010/mL。
1.2.3 菌液灭活及灭活检验 制备好的菌液中按照3ml/L加入甲醛,大肠埃希菌菌液37℃灭活48 h,葡萄球菌菌液灭活96h。取少量灭活后的菌液接种于普通培养基上,37℃培养24h,观察有无细菌生长。
1.2.4 疫苗的制备 蜂胶佐剂疫苗的制备:称取一定量的蜂胶溶于750mL/L的酒精中,制成100 mg/mL的蜂胶溶液。把扩增好的浓缩大肠埃希菌和葡萄球菌菌液稀释成1×1010个细菌/mL,1∶2混合,即为混合菌液。然后将制好的蜂胶溶液和混合菌液1∶1混合,浓度为0.5×1010个细菌/mL,再加入20mL/L的吐温80,振荡器上振荡2h,使蜂胶溶液和菌液充分混合和乳化。4℃保存。转移因子佐剂疫苗的制备:把扩增好的浓缩菌液与10mL转移因子溶液混合,制成1×1010个细菌/10mL的菌液,即为转移因子佐剂疫苗,4℃保存。无佐剂疫苗的制备:把浓缩的菌液稀释成0.5×1010个细菌/mL即可,4℃保存。
1.2.5 奶山羊免疫试验 12只泌乳奶山羊,随机分为4组,即蜂胶佐剂组、转移因子组、转移因子+蜂胶组、不加佐剂组。每组3只。免疫部位为乳房基部和腹股沟两侧。免疫剂量为:蜂胶组2mL/只,无佐剂组2mL/只,转移因子组10mL/只,蜂胶+转移因子组每只同时注射1mL蜂胶疫苗和5ml转移因子疫苗。一免后的第15d,同样剂量同样部位进行再次免疫。
1.2.6 样本的采集 分别在免疫前及第一次免疫后3、7、10、15、18、22、25、30d采取所有羊的乳汁和血液样本。分离乳清、血清,分别测定大肠埃希菌、葡萄球菌的抗体效价。
1.2.7 ELISA方法的建立 可溶性抗原的制备:分别接种大肠埃希菌和葡萄球菌于肉汤中,37℃摇床培养24h。10 000r/min离心,弃上清,菌泥用无菌生理盐水洗涤并10 000r/min离心3次,最后加入适当的PBS制成细菌悬液。冰浴超声300w,5s/5 s超声破碎至菌液清亮。10 000r/min离心10min,取上清即为抗原蛋白溶液。上清中的蛋白含量为6 mg/mL(大肠埃希菌)、0.82mL(葡萄球菌)。
ELISA最佳反应条件的摸索:用棋盘法确定抗原最佳包被浓度和样本最佳稀释度,以阳性样本吸光值减去空白和阴性对照后,值最接近1.0的为最佳稀释度,然后选择其他最佳反应条件。
1.2.8 样本抗体效价的测定 大肠埃希菌及葡萄球菌抗体效价测定 按照本试验建立的ELISA测定条件,分别测定样品中相应的抗体效价。P/N>2.1判为阳性,否则判为阴性。
乳样中IgA的测定:按照大连宝生奶山羊IgA试剂盒上的说明,检测乳样中IgA的含量。
1.2.9 攻毒试验 第一次疫苗免疫后第31天进行攻毒试验。分别取1×1010/mL浓度的大肠埃希菌、葡萄球菌活菌菌液各1mL混匀后,用灭菌脱脂棉蘸取适量涂抹试验羊乳头。连续在1周内用LMT诊断液测定乳汁体细胞的变化情况,并观察试验羊的精神状况、饮食欲、乳房外观等变化。
2 结果
2.1 灭活效果检验
经灭活处理的大肠埃希菌和葡萄球菌,接种普通培养基培养48h后,观察无菌落生长,证明灭活效果彻底。
2.2 ELISA测定葡萄球菌和大肠埃希菌的最优化条件
最终确定葡萄球菌和大肠埃希菌抗原的ELISA最佳包被浓度都为10μg/mL,抗原最佳包被条件为4℃包被24h,用10g/L的BSA作为封闭剂37℃封闭30min,样本反应时间为1h,酶标二抗的反应最佳时间为45min,底物反应时间为30 min。
2.3 乳汁中IgA抗体的测定
乳汁中分泌性IgA在乳腺免疫中发挥着极其重要的作用[8-9]。sIgA通过结合病原菌表面参与黏附宿主乳腺上皮细胞的相关抗原分子,使得病原菌丧失粘附上皮细胞并进入组织的能力,从而发挥其免疫功能。因此,准确测定乳汁中sIgA含量是评估乳腺免疫功能的重要指标之一。山羊免疫乳房炎灭活疫苗后,乳汁中sIgA含量是否升高,也是评估该疫苗的关键指标之一。本试验结果显示,各个免疫组的sIgA含量均在免疫后不断上升,与免疫前有明显差异;含佐剂的疫苗免疫后sIgA上升明显高于不含佐剂的疫苗,表明佐剂能够有效促进疫苗免疫后sI-gA的产生,蜂胶和转移因子二者的效果差异不大。但是,在针对疫苗的再次免疫应答中,不含佐剂疫苗、蜂胶疫苗免疫后1周内sIgA的含量会出现短暂的下降阶段,而转移因子协同疫苗的再次免疫应答则不会导致sIgA含量的下降,表明转移因子在乳房炎疫苗免疫中的佐剂效应还是优于蜂胶(图1)。
2.4 血液和乳汁中葡萄球菌抗体的测定结果
本次试验使用的山羊均为成年泌乳期的奶山羊,考虑到试验期仅1个月,因此试验中未设空白对照组和盐水注射对照组。更重要的是,本试验的目的是弄清楚灭活疫苗配合不同佐剂免疫后的效果差异。结果显示,与免疫前相比,各免疫组山羊血液和乳汁中均产生了抗葡萄球菌的抗体,并且随着时间延长,抗体效价呈不断提高的特征;综合分析佐剂效果,转移因子无论在促进血液还是乳汁中特异性抗体效应方面都优于蜂胶,并且对提高乳汁中特异性抗体效价的作用更佳;从抗体产生量分析,再次免疫效果更好,尤其对乳汁中特异性抗体而言更是如此。此外,乳汁中的抗体效价总是稍低于血液中相应的抗体效价1~2个低度(图2、图3),提示通过测定血液中特异性抗体效价,基本可以了解乳汁中的抗体效价。
2.5 血液和乳汁中大肠埃希菌抗体的测定结果
用灭活大肠埃希菌免疫刺激机体产生抗体的研究报道很多,但如何提高乳汁中相应抗体效价方面,这方面的文献还不是很多。本研究结果显示,尽管转移因子和蜂胶佐剂在提高血液大肠埃希菌抗体效价方面似乎作用不是很显著,但转移因子却可以显著提高乳汁中大肠埃希菌的抗体效价(图4、图5)。
2.6 攻毒试验结果

图1 乳汁中IgA的变化Fig.1 Kinetic analysis of milk sIgA

图2 血清中葡萄球菌抗体变化Fig.2 Kinetic analysis of blood serum antibody to Staphylococcus
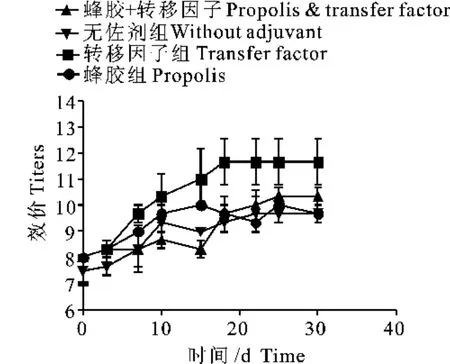
图3 乳汁中葡萄球菌抗体的变化Fig.3 Kinetic analysis of milk antibody to Staphylococcus
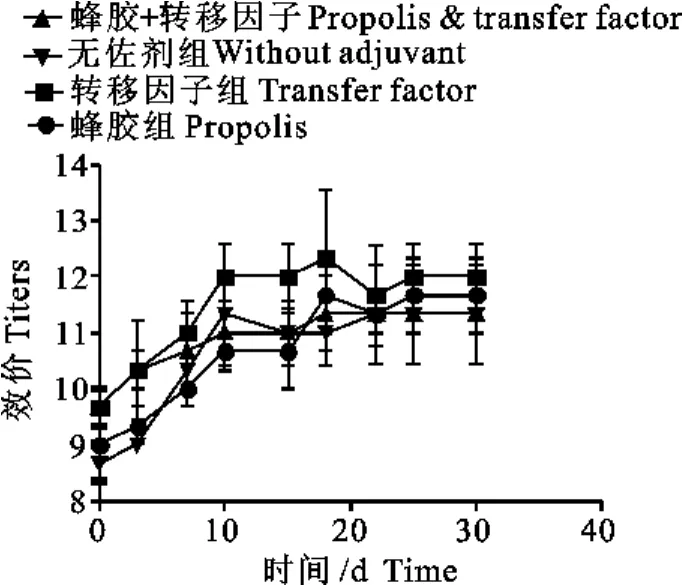
图4 血清中大肠埃希菌抗体的变化Fig.4 Kinetic analysis of blood serum antibodiy to Escherichia coli
攻毒试验结果显示,添加转移因子或蜂胶的疫苗免疫组的6只羊在细菌攻击后其精神状况、饮食欲、乳房外观等与攻击前一样,其乳汁中的体细胞也都没有超过2×105/mL;单独用疫苗免疫的3只羊,其中2只的精神状况、饮食欲、乳房外观等与添加佐剂的疫苗免疫相同,剩余的1只羊精神出现轻度沉郁、食欲不佳等表现,乳房外观略有发红现象,但这种变化在攻毒后第5天开始减轻,第7天基本恢复正常。这只羊乳汁中的体细胞在细菌攻击后出现升高,最高时达到5×105/mL,乳汁呈淡黄色,但到了第7d,乳汁中白细胞已经降到了3×105/mL,乳汁颜色也恢复正常。
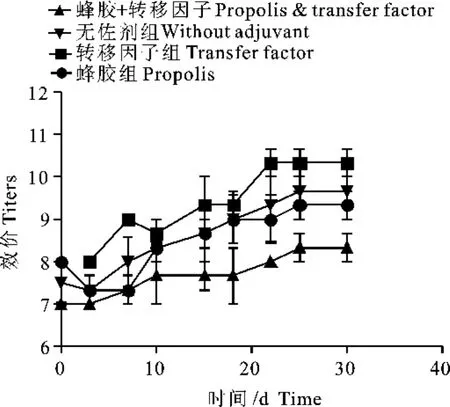
图5 乳汁中大肠埃希菌抗体的变化Fig.5 Kinetic analysis of milk antibody to Escherichia coli
3 讨论
乳房炎主要由病原菌通过乳头感染乳腺组织而引起,机体抗御乳房炎病原菌感染的免疫力量包括抗体、中性粒细胞等吞噬细胞[10]。在感染早期,清除乳腺组织病原菌的力量是中性粒细胞等吞噬细胞,特异性免疫应答一旦启动,在特异性抗体的协同作用下,清除乳腺病原菌效果更佳。抗体在其中的作用主要包括调理这样、ADCC和中和作用,抗体效价越高,其作用越强大。因此,测定抗体效价是评估乳房炎疫苗免疫效果的关键指标之一。参与清除乳房炎病原菌的抗体不仅包括IgG,还有sIgA,IgG主要参与清除乳腺组织中病原菌过程,其发挥作用的方式有ADCC、调理作用和中和作用,sIgA则通过中和乳汁中的细菌发挥其免疫功能[11-12]。因此,本研究主要测定了免疫乳房炎疫苗后血液IgG和乳汁sIgA的变化,研究结果表明,疫苗免疫可以显著增强血液和乳汁中的抗体效价,从而使机体更有效抵制乳房炎病原菌侵袭,降低乳房炎发生率。攻毒试验表明,疫苗免疫保护效果显著,添加佐剂可显著提高疫苗免疫效果。疫苗中添加佐剂是提高疫苗免疫效果的常用手段,常用的佐剂包括铝胶盐佐剂、白油、蜂胶等[13-14]。但较理想的佐剂不但要具备无毒副作用、能被机体完全吸收和促进抗体产生的效应,还应当具有改善提高机体免疫能的作用[15]。因此,本研究选择并测试了蜂胶和转移因子的佐剂效果。试验结果表明,分别采用这两种佐剂协同疫苗免疫奶山羊后,转移因子通常在免疫后2d即可被机体完全吸收,而蜂胶佐剂则在免疫后14d还存在残留。检查接种部位发现接种转移因子佐剂部位组织完全正常,而蜂胶佐剂部位不仅存在残留,且呈现明显炎症反应特征。更重要的是,与单独免疫疫苗相比,转移因子不仅能和蜂胶一样够显著提高血液中疫苗特异性抗体效价,它在提高乳汁中sI-gA效价方面的作用明显优于蜂胶,并且抗体效价不受疫苗再次免疫的影响而出现暂时下跌。因此,我们认为转移因子更适合作为乳房炎灭活疫苗佐剂。
需要指出的是,本试验采用的奶山羊属于成年泌乳山羊,并且来自散养户。虽然试验前经试剂测试都属于乳房炎阴性,但其血液中都存在一定量的大肠埃希菌和葡萄球菌抗体。这些抗体是奶山羊生活中接触大肠埃希菌和葡萄球菌而产生的,其未必都一定与乳房炎有关,由于本试验采用的ELISA方法无法区别大肠埃希菌和葡萄球菌的血清型,因此测出来免疫前的奶山羊体内存在这些细菌抗体效价,这种情况在评估乳房炎疫苗免疫效果时很难避免,因为到了泌乳期年龄的奶山羊很难也无法避免其体内不含有这两种常见细菌的抗体。但依据本研究结果分析,其并未对本试验结果产生多大影响,尤其乳汁中的sIgA在本试验中呈现典型的再次应答规律。因此,试验前保证奶山羊乳房炎阴性和个体健康是关键条件,体内抗体不是主要影响因素。一个有意思的问题是,迄今为止尚缺乏一个为大家所普遍接受的标准,即奶山羊乳汁中特异性抗体效价达到多少时,就可以有效防止相应病原菌的感染而发生乳房炎?虽然针对不同细菌要求的抗体效价不同,但找到这一标准无疑有助于对乳房炎疫苗免疫效果的评估和乳房炎的防治,本研究将就此开展进一步的工作。
[1]贺永明,刘艳红.奶山羊乳房炎的诊治[J].上海畜牧兽医通讯,2009(5):104.
[2]吕英李,庆 章.奶山羊隐性乳房炎模型的建立及早期诊断指标的研究[J].中国预防兽医学报,2008,30(4):305-308.
[3]周 密,王 超,刘玉莲,等.奶山羊乳房炎发病情况的调查与分析[J].吉林畜牧兽医,2008,29(6):46.
[4]周庆民,薄俊平,冯万宇,等.抗生素在奶牛临床上的使用现状[J].奶牛养殖,2009(6):56-59.
[5]琴.我国牛奶中抗生素残留现状分析及对策[J].当代畜牧,2005(6):1-2.
[6]郭 军,刘艳辉,李翠枝.乳及乳制品的抗生素和其他兽药残留问题[J].中国乳品工业,2004,32(9):28-32.
[7]郭抗抗,张彦明,孟 倩,等.奶山羊急性乳房炎病原菌的分离鉴定[J].中国兽医杂志,2007(2):35-36.
[8]Hanson L A,Korotkov A M.The role of breastfeeding in prevention of neonatal infection[J].Sem in Neonatal,2002,7(4):275-281.
[9]Takahshi T,Yoshida Y.Reactivity of sercretory IgA antibodies in breast milk from 107Japanese mothers to 20environmental antigens[J].Biol Neonate,2002,82(4):238-242.
[10]Rainard P,Riollet C.Innate immunity of the bovine mammary gland[J].Vet Res,2006,37:369-400.
[11]朱晓霞,唐 杰,邝良德.免疫佐剂研究概述[J].畜禽业,2010(256):43-45.
[12]夏 芳,罗满林,郭 林,等.免疫佐剂的研究进展[J].畜牧与饲料科学,2009,30(10):150-152.
[13]杨 光,王加启,哈斯额尔敦,等.牛乳中分泌型IgA的合成机理及提高技术[J].中国畜牧兽医,2009,36(8):103-107.
[14]陈 瀑,谢建渝,杨致邦,等.人母乳中分泌型免疫球蛋白A的抗体特异性分析[J].中国微生态学杂志,2009,21(3):235-238.
[15]罗 燕,谷新利,李星艳.中药作为疫苗佐剂的研究概况[J].中国兽医杂志,2009,45(8):61-62.
