姜黄素与p65siRNA促进食管鳞癌细胞凋亡的比较研究
2011-05-30田芳柴玉荣江亚南张晓艳
田芳 柴玉荣 江亚南 张晓艳
郑州大学基础医学院病理生理学教研室,△组织学与胚胎学教研室,河南 郑州450052
食管癌是世界上常见的恶性肿瘤之一,其死亡率居整个恶性肿瘤死亡的第6位[1]。核转录因子-κB (nuclear factor-kappa B, NF-κB)是近年来发现的转录调控因子,NF-κB最常见的形式是由p50和p65组成的异源二聚体。有研究表明,在多种人类肿瘤中,如肝癌、肠癌、宫颈癌,NF-κB信号通路的激活在肿瘤的发生、发展中起着重要的作用[2-4]。随着对信号传导机制与肿瘤关系研究的不断深入,研究者们逐渐认识到针对信号传导异常环节进行肿瘤治疗的重要性和可行性。在许多恶性肿瘤中,持续激活的和某些抗肿瘤药物诱发的NF-κB活化特性,使得这个转录因子成为一个有前途的分子靶点。
RNA干扰(RNA interfere,RNAi)是一种转录后的基因沉默现象。其通过短的双链RNA(small interfere RNA,siRNA)与mRNA中的同源序列结合,从而导致mRNA失活[5]。目前,RNAi被广泛用于特异性抑制基因的表达,并成为研究基因功能的一种重要实验工具。姜黄为姜科姜黄属植物,主要活性成分为姜黄素,具有抗感染、抗氧化、降血脂和抗动脉粥样硬化等多种药理作用。有研究表明,姜黄素可以抑制肿瘤细胞增殖和促进细胞凋亡,因此可以作为一种药物或作为传统化疗的辅助药物,用于肿瘤治疗[6-7]。本研究利用RNA干扰技术特异性阻断NF-κB的活化,同时研究姜黄素是否也能通过抑制NF-κB信号通路的活化,促进食管鳞癌细胞的凋亡,并与RNA干扰技术比较判断姜黄素阻断该信号通路促进细胞凋亡的效果。
1 材料和方法
1.1 材料与试剂
人食管癌细胞Eca109由本室保存,人食管癌细胞EC9706由中国医学科学院肿瘤医院肿瘤研究所分子肿瘤学国家重点实验室惠赠。细胞在含有体积分数为10%的胎牛血清、100 U/mL青霉素、100 μg/mL链霉素的RPMI-1640培养液(Gibco公司)中,于37 ℃、CO2体积分数为5%的条件下培养,实验细胞均处于对数生长期。
鼠抗人pIκBα(sc-8404)和鼠抗人p65(sc-8008)单克隆抗体购自Santa Cruz Biotechnology公司;细胞核和细胞质蛋白提取试剂盒购自Pierce公司;NF-κB p65 siRNA干扰试剂盒购自Cell Signaling Technology公司;姜黄素粉剂(姜黄素含量≥70%)购自Sigma公司;凋亡试剂盒Annexin V-FITCKit购自美国Beckman Coulter公司。
1.2 方法
1.2.1 siRNA的转染
按照s i R N A干扰试剂盒说明书的要求进行转染。转染前EC9706(5×104个)和Eca109(6×104个)按一定细胞数铺于6孔板中,使用无抗生素的培养基培养24 h,将含有siRNA的转染试剂与细胞共温育5 h后,加入新鲜培养基温育24 h。
1.2.2 姜黄素的配制
以少量DMSO溶解姜黄素粉剂,配成100 μmol/L的溶液,置于-20 ℃冰箱保存。临用时以完全培养液将姜黄素稀释到所需浓度,DMSO终浓度<0.1%。对照组培养液为含10%小牛血清的RPMI-1640培养液,其中DMSO终浓度<0.1%。
1.2.3 细胞质、细胞核蛋白的制备
按照细胞核和细胞质蛋白提取试剂盒说明书,分别提取细胞质、细胞核蛋白,Bradford法检测蛋白质的含量,-70 ℃保存。
1.2.4 Western blot测定蛋白的表达
转染p65siRNA 72 h后,从Eca109和EC9706细胞中取细胞质蛋白,与预染的蛋白质分子量标准一起上样,检测p65和非靶向MAPK蛋白表达;并在EC9706和Eca109细胞中加入姜黄素,分别培养0、1、3和6 h后,收集对照组和实验组细胞提取细胞质蛋白,检测pIκBα和内参actin的表达。经120 g/L SDS-PAGE分离,电转到硝酸纤维膜上。5%的脱脂奶粉TBST溶液封闭2 h,抗体按1∶100温育4 ℃过夜,TBST溶液洗涤10 min×3次,硝酸纤维膜分别与辣根过氧化物酶标记的二抗(1∶50 000)室温温育1 h后,TBST溶液洗涤10 min×3次,DAB显色,实验重复3次。
1.2.5 流式细胞仪检测凋亡细胞
转染p65siRNA的食管鳞癌细胞,单独或联合使用化疗药氟尿嘧啶(5-fluorouracil,5-FU)治疗后72 h;在EC9706和Eca109细胞中加入姜黄素培养72 h,或联合使用姜黄素和5-FU培养72 h,分别收集各组细胞,制备各组单细胞悬液,计数细胞。取至少1×106个细胞移入新的1.5 mL离心管中,4 ℃离心5 min,形成细胞团。小心移去上清液,冰预冷PBS洗细胞2次,保证每管细胞数至少1×106个细胞。加5 μL Annexin V-FITC和2.5 mL PI到100 μL的细胞悬液中,轻轻混匀;以未染色细胞调零,以Annexin V-FITC单染管和PI单染管作为基准参照,测定每个上样管数据,利用CellQuest 3.0软件进行参数获取和资料分析,计算凋亡细胞百分比。
1.2.6 治疗前后细胞形态学观察
在细胞培养状态下,用倒置显微镜分别观察两种食管鳞癌细胞对照组、姜黄素组、转染p65siRNA组、5-FU治疗组及姜黄素+5-FU组、转染p65siRNA+5-FU治疗组的细胞生长状态及形态学改变。
1.3 统计学处理
应用SPSS 13.0统计软件进行统计学处理,统计学数据用表示,对计量资料、两样本均数比较采用t检验。检验水准α=0.05,P<0.05为差异有统计学意义。蛋白的表达水平下调,而对非靶向蛋白MAPK的表达无影响。说明针对p65siRNA可特异性抑制p65蛋白表达,对其他蛋白的表达无影响(表1)。

2 结 果
2.1 食管鳞癌细胞转染p65siRNA后各组p65蛋白的表达水平
EC9706和Eca109细胞转染siRNA72 h后,收集各组细胞提取细胞质蛋白,Western blot检测细胞中p65的蛋白表达水平(图1)。实验结果表明,与未转染p65siRNA的EC9706和Eca109细胞相比,转染后的EC9706和Eca109细胞,p65

表 1 p65蛋白表达水平半定量分析Tab.1 The protein expression of p65 after transfected with p65siRNA
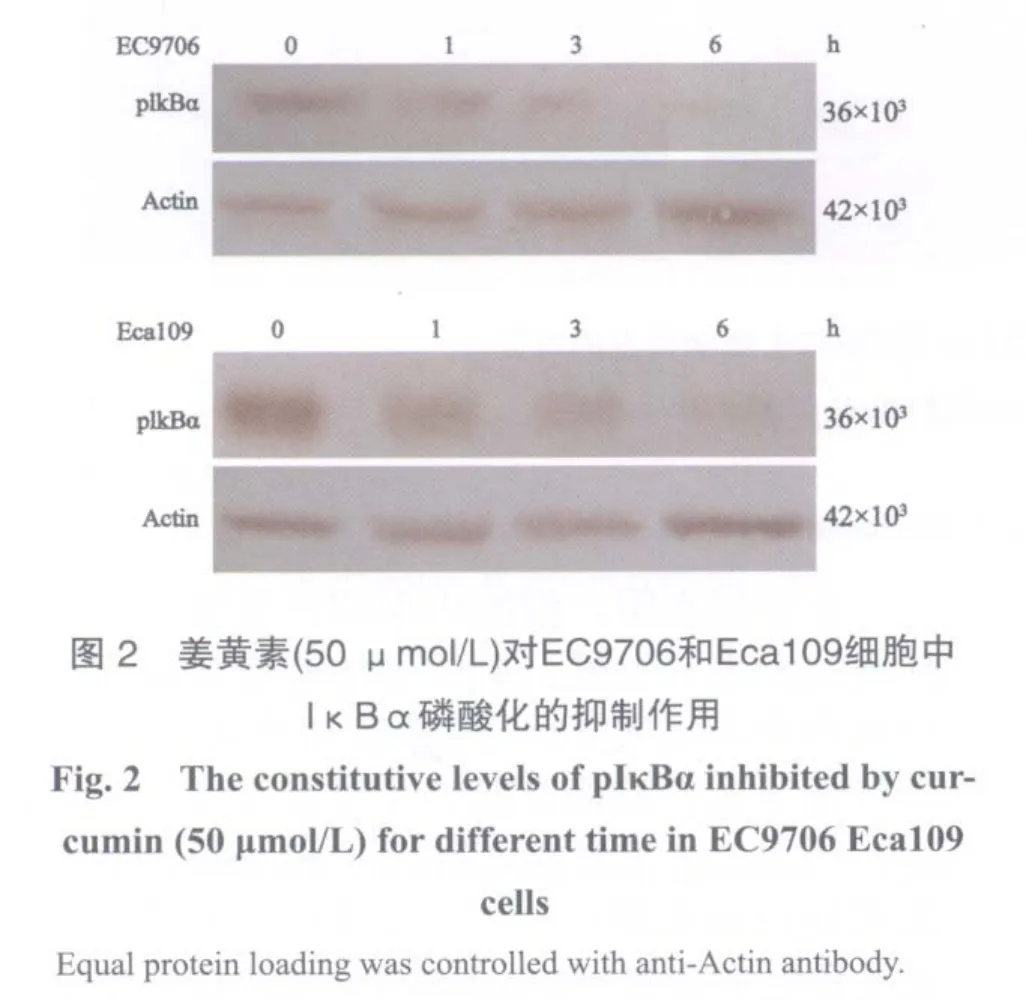
2.2 姜黄素对NF-κB信号通路的阻断作用
在EC9706和Eca109细胞中加入姜黄素,剂量为50 μmol/L,分别培养0、1、3和6 h后,提取相应的细胞质蛋白,检测姜黄素对NF-κB信号通路的作用。Western blot检测结果显示,EC9706和Eca109细胞中pIκBα蛋白的表达水平随姜黄素作用时间的延长逐渐下降(图2),IκBα磷酸化水平降低,可直接影响NF-κB的活化(表2)。
2.3 两种阻断方法对EC9706和Eca109细胞凋亡的影响
将p65siRNA转染组与姜黄素组所引起的食管鳞癌细胞的凋亡及联合应用化疗药所引起的细胞凋亡进行比较,结果发现,与p65siRNA转染组相比,单独使用姜黄素可引起细胞凋亡数增加(P<0.05);当联合使用化疗药时,细胞凋亡数均明显增加,尤其是当姜黄素与5-FU联合应用时,作用更加显著(P<0.05,表3)。

表 2 pIκBα蛋白表达水平半定量分析Tab.2 The protein expression of pIκBα in different concentrations of curcumin
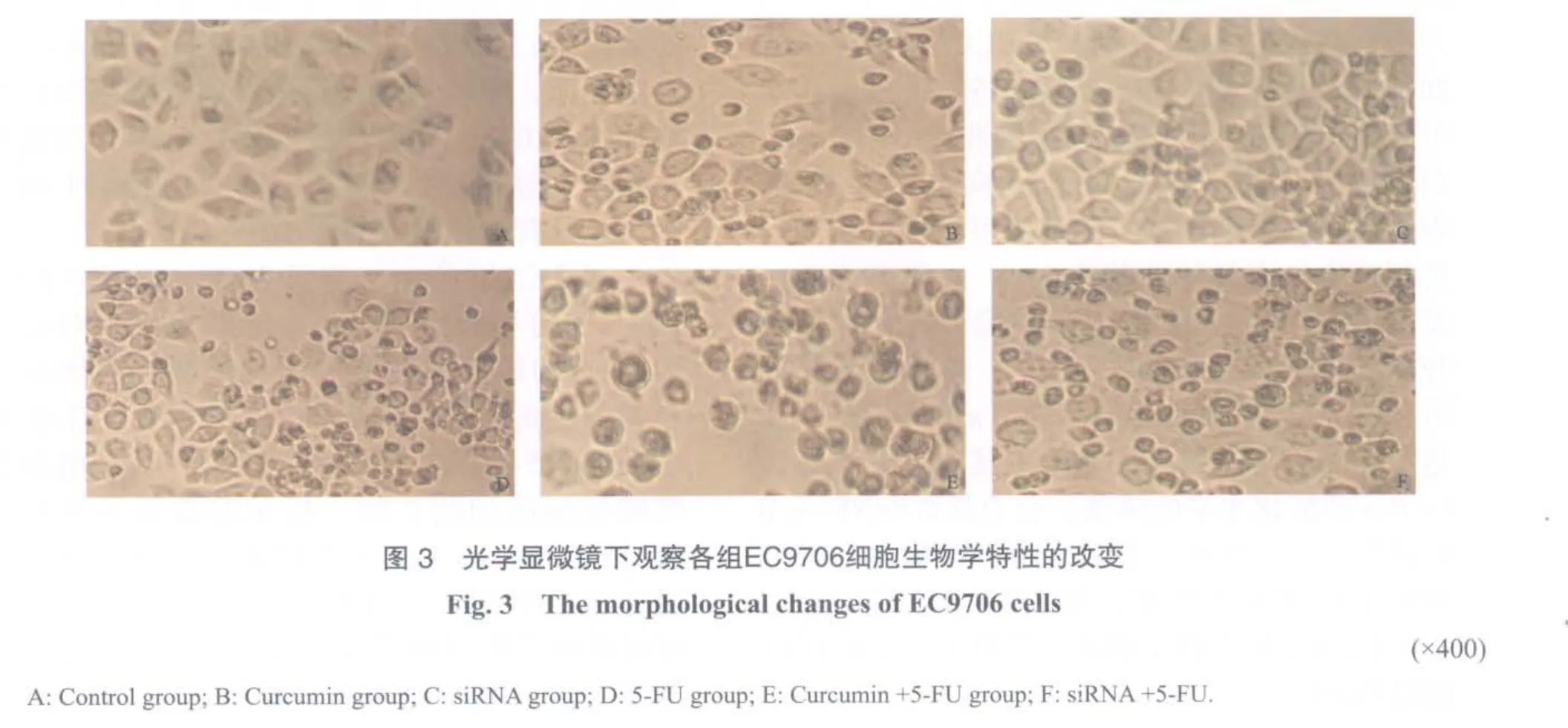
2.4 姜黄素、p65siRNA与5-FU联合应用对食管鳞癌细胞形态学特性的影响
姜黄素及p65siRNA转染72 h后,EC9706和Eca109细胞出现细胞形态缩小,漂浮数增加,细胞增殖较慢;姜黄素及p65siRNA与化疗药5-FU联合作用72 h,EC9706和Eca109细胞出现细胞形态缩小,细胞质凝缩,细胞漂浮数明显增加,细胞数量下降,增殖明显受到抑制(图3、4)。

表 3 流式细胞仪检测姜黄素对EC9706和Eca109细胞凋亡率Tab.3 The apoptosis rates of EC9706 and Eca109 cells detected by fl ow cytometry
3 讨 论
活化的NF-κB信号通路可促进多种下游调控基因的表达,这些基因的过表达在促进肿瘤细胞的生成、转化、浸润和转移、抗凋亡及增加对化疗药的耐药性等方面起着重要的作用,肿瘤的这些特征将会使患者的预后欠佳。因此,抑制NF-κB信号通路或许有助于下调与肿瘤发生、发展有关的基因表达,增强肿瘤细胞对化疗药的敏感性。

作者以往的研究已证实,在2种食管鳞癌细胞中存在有激活NF-κB的信号通路[8-9],然而能否通过阻断NF-κB信号通路,促进食管鳞癌细胞的凋亡及增强对化疗药的敏感性,目前尚不清楚。在功能基因组研究中,需要对特定基因进行功能丧失或降低突变,以确定其功能。由于RNAi具有高度的序列专一性,可以使特定基因沉默,获得功能丧失或降低突变。本研究使用RNA干扰技术,特异性阻断NF-κB亚单位p65的表达,研究NF-κB信号通路在食管鳞癌的发生、发展中的作用。本研究中,将p65siRNA分别转染EC9706和Eca109细胞,持续作用72 h,检测p65的蛋白表达水平。结果发现,与未转染细胞相比,p65的蛋白表达水平明显下降,而非靶向抗体MAPK的表达水平未受到影响。姜黄素可以通过不同的机制产生抗炎抗肿瘤的特性[10]。研究表明,姜黄素可以通过干预NF-κB信号通路,影响肿瘤细胞的生长和凋亡[11-12]。本研究结果显示,EC9706和Eca109细胞中pIκBα蛋白的表达水平随着姜黄素作用时间的延长逐渐下降,IκBα磷酸化水平的降低,会直接影响NF-κB的活化[13]。因此,姜黄素可以抑制食管鳞癌细胞中IκBα磷酸化,使NF-κB不能从NF-κB-IκBα复合物上解离,降低NF-κB-DNA的结合活性。
有证据表明,细胞出现凋亡异常,会引起肿瘤的发生、发展,更重要的是引起肿瘤细胞对化疗药的耐受性。在肾癌细胞中,姜黄素可以诱导死亡受体在mRNA和蛋白水平上的表达,从而促进由肿瘤坏死因子相关凋亡诱导配体诱发的细胞凋亡[14]。本研究还采用流式细胞仪检测姜黄素、p65siRNA单独或联合使用化疗药5-FU对食管鳞癌细胞凋亡的影响。结果显示,EC9706和Eca109在单独使用姜黄素后,就可促进细胞的凋亡;当与化疗药5-FU(327 μg/mL)联合使用时,可明显提高肿瘤细胞对化疗药的敏感性,凋亡和坏死的细胞均显著增加。同时,将siRNA转染组与姜黄素组所引起的食管鳞癌细胞的凋亡及联合应用化疗药所引起的细胞凋亡加以比较,结果发现,与siRNA转染组相比,单独使用姜黄素可引起细胞凋亡数增加(P<0.05);当联合使用化疗药时,细胞凋亡数均明显增加,与p65siRNA联合5-FU组相比,差异有统计学意义(P<0.05)。
以上结果显示,姜黄素也可以通过抑制NF-κB信号通路,增强食管鳞癌细胞对化疗药5-FU的敏感性,使肿瘤细胞凋亡数增加。与特异性的p65siRNA干扰技术相比,姜黄素单独或与5-FU联合应用,都能够明显增加食管鳞癌细胞的凋亡数,提示姜黄素不但可以通过阻断NF-κB的活性起作用,或许还可以通过其他机制促进细胞凋亡。通过显微镜也可清楚地观察到食管鳞癌细胞形态学上的一些改变。本研究使用两种方法作用于NF-κB信号通路,RNA干扰技术具有高效、特异性强等优点,可特异性地阻断NF-κB信号通路,用于研究NF-κB信号通路在食管鳞癌细胞中的功能;RNA干扰虽特异,但用于临床还需要一段时间。而姜黄素作为一种化合物,不良反应小、无毒,可以抑制食管鳞癌细胞中IκBα磷酸化,从而阻断NF-κB信号通路,增强食管鳞癌细胞对5-FU的敏感性,使肿瘤细胞凋亡数增加。
[1]PISANI P, PARKIN D M, BRAY F.Estimates of the worldwide mortality from 25 cancers in 1990 [J].Int J Cancer, 1999,83(1): 18-29.
[2]WANG J H, HUANG Q K, CHEN M X.The role of NF-κB in hepatocellular carcinoma cell [J].Chin Med J, 2003,116(5): 747-752.
[3]YU H G, YU L L, YANG Y.Increased expression of RelA/nuclear factor-kappa B protein correlates with colorectal tumorigenesis [J].Oncology, 2003, 65(1): 37-45.
[4]NAIR A, VENKATRAMAN M, MALIEKAL T T.NF-kappa B is constitutively activated in high-grade squamous intraepithelial lesions and squamous cell carcinomas of the human uterine cervix [J].Oncogene, 2003, 22(1): 50-58.
[5]HAMMOND S M, BERNSTEIN E, BEACH D, et al.An RNA-directed nuclease mediates post-transcriptional gene silencing in Drosophila cells [J].Nature, 2000, 404(6775): 293-296.
[6]AGGARWAL B B, SHISHODIA S, TAKADA Y, et al.Curcumin suppresses the paclitaxel-induced nuclear factorkappaB pathway in breast cancer cells and inhibits lung metastasis of human breast cancer in nude mice [J].Clin Cancer Res, 2005, 11(20): 7490-7498.
[7]RADHAKRISHNA P G, SRIVASTAVA A S, HASSANEIN T I,et al.Induction of apoptosis in human lung cancer cells by curcumin [J].Cancer Lett, 2004, 208(2): 163-170.
[8]田芳, 侯卫红, 王建民, 等.食管鳞癌细胞中NF-κB与IκBα的mRNA、蛋白表达[J].中国肿瘤临床, 2006,33(4): 198-201.
[9]田芳, 许培荣, 侯卫红, 等.NF-κB信号通路在食管鳞癌细胞系中的激活[J].肿瘤防治研究, 2006, 33(1): 11-14.
[10]AGGARWAL B B, KUMAR A, BHARTI A C.Anticancer potential of curcumin: preclinical and clinical studies [J].Anticancer Res, 2003, 23(1): 363-398.
[11]WANG Z, ZHANG Y, BANERJEE S, et al.Notch-1 downregulation by curcumin is associated with the inhibition of cell growth and the induction of apoptosis in pancreatic cancer cells [J].Cancer, 2006, 106(11): 2503-2513.
[12]THOMPSON K H, BÖHMERLE K, POLISHCHUK E, et al.Complementary inhibition of synoviocyte, smooth muscle cell or mouse lymphoma cell proliferation by a vanadyl curcumin complex compared to curcumin alone [J].J Inorganic Biochem, 2004, 98(12): 2063-2070.
[13]田芳, 宋敏, 许培荣, 等.姜黄素阻断NF-κB信号通路促进食管鳞癌细胞凋亡的体外研究 [J].癌症, 2008, 27(6):566-570.
[14]JUNG E M, LIM J H, LEE T J, et al.Curcumin sensitizes tumor necrosis factor-related apoptosis-inducing ligand(TRAIL)-induced apoptosis through reactive oxygen speciesmediated upregulation of death receptor 5 (DR5) [J].Carcinogenesis, 2005, 26(11): 1905-1913.
