上皮-间叶转变相关蛋白在非小细胞肺癌中的表达及其预后意义
2011-05-30石永利吴鸿雁樊祥山张明逸叶庆冯振卿
石永利 吴鸿雁 樊祥山 张明逸 叶庆 冯振卿*
1.南京医科大学病理学系,江苏 南京 210008;
2.南京市鼓楼医院病理科,江苏 南京 210008
非小细胞肺癌(non-small cell lung cancer,NSCLC)是国内致死率最高的恶性肿瘤。其主要治疗手段是手术切除结合手术后放疗和化疗[1]。目前已经通过检测一些相关分子标志物的表达情况来反映肿瘤的分化、增殖程度等,以指导临床治疗[2]。然而肿瘤的复发和转移通常是NSCLC患者死亡的主要原因,因此研究与肿瘤转移相关的分子标志物能够更好地判断患者的预后情况,为NSCLC患者的分子靶向治疗提供新思路[1]。研究发现上皮-间叶转变(epithelial-mesenchymal transitions,EMT)是肿瘤发生侵袭、转移的一个重要原因[3-4]。本研究采用组织芯片技术和免疫组织化学方法,检测EMT相关蛋白Snail、Vimentin、E-cadherin和β-catenin在NSCLC中的表达情况,分析其表达与NSCLC患者临床病理参数及预后的关系。
1 资料和方法
1.1 临床资料
从南京市鼓楼医院病理科选取2006年—2008年间石蜡包埋的NSCLC患者肿瘤组织标本165例,患者中男性115例,女性50例;年龄36~83岁,中位年龄62岁。患者术前均未接受放疗和化疗。按照2009年WHO肺癌组织学分类及分级标准,其中腺癌107例,鳞癌58例;中高分化117例,低分化48例;TNM分期Ⅰ期64例,Ⅱ期39例,Ⅲ期57例,Ⅳ期5例。患者具有完整的随访资料。
1.2 方法
1.2.1 分组
依据Snail、Vimentin、E-cadherin/β-catenin复合体的异常表达情况对患者进行分组:组1(均无异常)、组2(仅1种异常)、组3(2种异常)和组4(3种异常),继续分为:EMT-L1组(1~2种异常)和EMT-L2组(3~4种异常)。
1.2.2 组织芯片的制备
复习所有患者的全部HE切片,确定有代表性的病变部位并在相应的蜡块上做好标记。应用组织微阵列打孔仪(购自美国Beecher instrument公司)在1个空白蜡块(28 mm×22 mm×15 mm)上打孔(孔直径1 mm,长4 mm),然后在蜡块的标记部位穿刺与孔大小相同的蜡柱,准确放入空白蜡块的小孔中,依次按序操作。设计的组织阵列为14×11阵列。每个病例重复取点3次,以获得较好的代表性。制作完成的组织芯片蜡块4 μm连续切片50张,置于-20 ℃储存。
1.2.3 免疫组织化学染色
Snail兔抗人多克隆抗体购自Abcam公司,工作浓度为1∶500。E-cadherin、β-catenin鼠抗人单克隆抗体均购自Zymed公司,工作浓度分别为1∶200和1∶150。Vimentin鼠抗人单克隆抗体购自Dako公司,工作浓度为1∶400。依照EnVision试剂盒说明书行免疫组织化学染色。PBS代替一抗作阴性对照。
1.2.4 结果判定
由2名 富有经验的病理医师通过双盲法独立评估。按肿瘤细胞染色强度进行评分:无色为0;淡黄色为1分;棕黄色为2分;棕褐色为3分。按肿瘤细胞阳性百分比评分:0为阴性;<10%为1分;11%~50%为2分;51%~80%为3分;>80%为4分。按照染色强度评分与阳性细胞百分比评分的乘积决定最终染色结果:其中0~3分为阴性(-),4~12分为阳性(+)[5]。
1.3 统计学处理
所有数据采用SPSS 11.0统计软件包处理。采用χ2检验、Spearman相关分析等统计学方法。患者的生存数据进行Kaplan-Meier分析,并绘制生存曲线图,应用Log-rank检验差异性。建立Cox回归模型,对预后因子进行多因素分析。P<0.05为差异有统计学意义。
2 结 果
2.1 Snail、Vimentin、E-cadherin和β-catenin的表达及其与临床病理参数的关系
Snail是一种转录因子,以细胞核出现棕黄色染色为阳性(图1A)。Vimentin表达于间叶细胞的细胞质中,上皮细胞阴性。阳性结果为肿瘤细胞的细胞质内出现棕黄色着色(图1B)。E-cadherin与β-catenin表达于上皮细胞的细胞膜,在细胞表面形成复合物,维持细胞间的粘附功能,但在一些患者的肿瘤细胞膜上表达下调或者转位至细胞核(图1C、D)。在165例癌组织中,Snail、Vimentin、E-cadherin和β-catenin的阳性例数分别为75(45.5%)、56(33.9%)、110(66.7%)和84(50.9%)。65(39.4%)例患者同时呈E-cadherin和β-catenin阳性表达,表明E-cadherin/β-catenin复合体完整。Snail的表达与E-cadherin的水平呈负相关(P<0.001),E-cadherin的表达与β-catenin呈正相关(P=0.003,表1)。Vimentin、E-cadherin和β-catenin的表达与患者年龄、性别、组织学类型、TNM分期无明显相关性。Snail的表达与肿瘤的分化有关,低分化的NSCLC患者Snail的阳性率高于中高分化的NSCLC患者,差异有统计学意义(P=0.013)。
2.2 Snail、Vimentin及E-cadherin/β-catenin复合体的表达与患者预后的关系
165例NSCLC患者的平均生存时间为28个月,3年生存率为41.9%。Kaplan-Meier生存分析显示,Snail、Vimentin阳性组的总生存期显著短于阴性组(P=0.005 9、P=0.025 7,表2)。E-cadherin/β-catenin复合体不完整组(E-cadherin和β-catenin的表达至少1个阴性)的总生存期显著短于完整组(E-cadherin和β-catenin的表达同时阳性,P=0.0025,表2)。
生存分析显示,组1和组2患者之间的生存期无显著差异,但两组患者的生存期显著短于组3和组4的患者,说明Snail、Vimentin及E-cadherin/β-catenin复合体其中任意2种表达异常或者3种表达异常组的总生存期显著短于无异常或仅有1个异常表达组(图2)。EMT-L2组的患者与EMT-L1组相比肿瘤的分化程度相对较差,差异具有统计学意义(P=0.003)。生存分析结果显示,EMT-L2组患者的生存期显著短于EMT-L1组的患者(P<0.000 1,图3A)。以此因素以及表2中患者性别、分化程度、肿块最大径、TNM分期及神经侵袭为独立变量进行Cox回归多因素分析。结果显示,TNM分期、肿块最大径、EMT-L是独立的风险预后因子(表3)。在Ⅰ期NSCLC(n=64)患者中,EMT-L2组(n=24)的总生存率显著低于EMT-L1组(n=40,P=0.0244,图3B),Cox多因素分析显示差异具有统计学意义(HR=0.318;95%CI=0.116~0.867;P=0.025)。


表 1 NSCLC患者体内Snail、Vimentin、E-cadherin和β-catenin表达的相关性Tab.1 Correlation between Snail, Vimentin, E-cadherin and β-catenin expression in patients with NSCLC
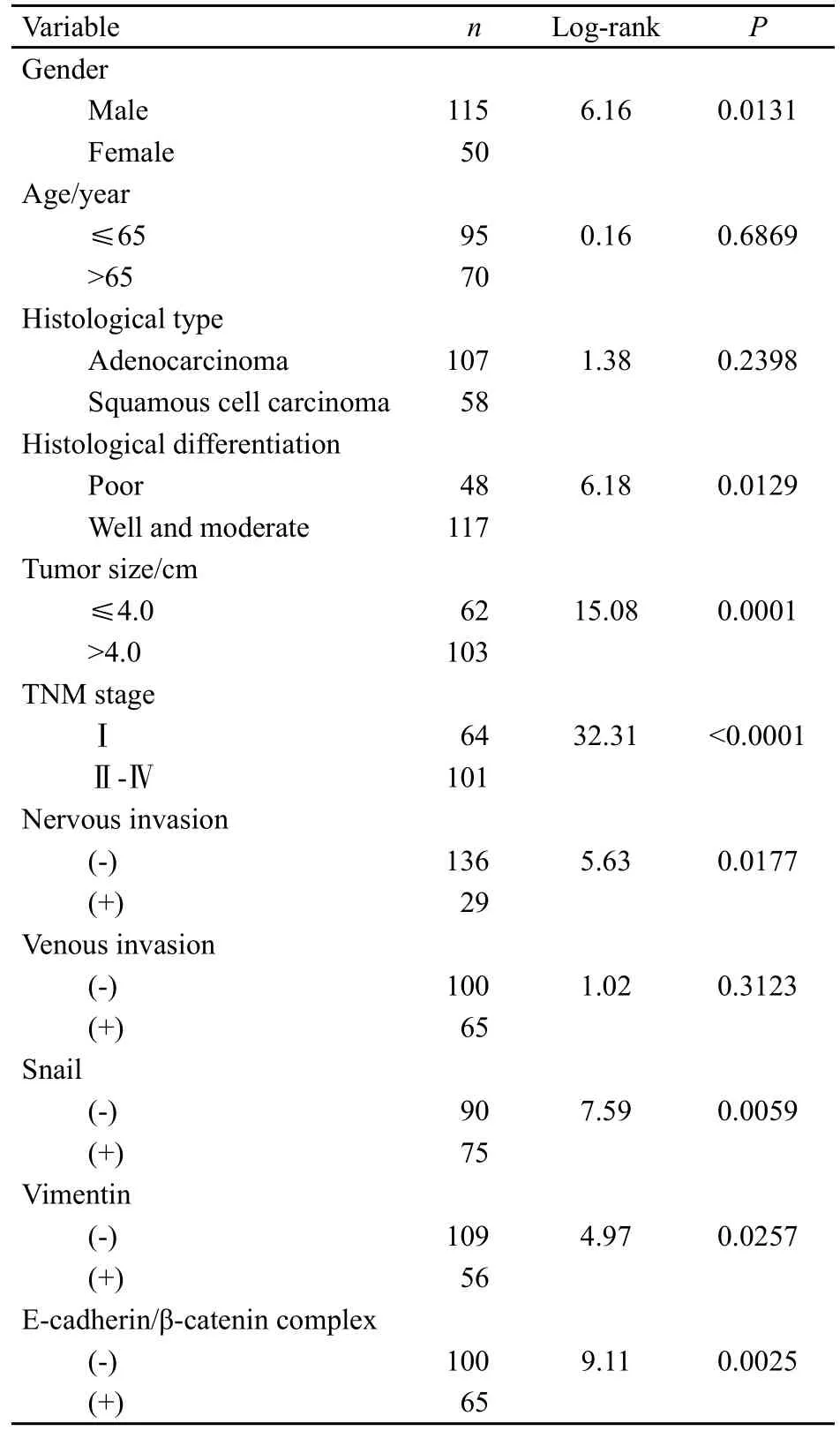
表 2 165例NSCLC患者总生存期的单因素分析Tab.2 Univariate analysis for overall survivals of 165 patients with NSCLC

表 3 165例NSCLC患者总生存期的多因素分析Tab.3 Multivariate analysis for overall survivals of 165 NSCLC patients


3 讨 论
EMT是指细胞由上皮表型向间叶表型转变的过程,其重要方面之一是丢失上皮标志物,例如c ytokeratin、E-cadherin和β-catenin等。E-cadherin是上皮细胞表面的黏附分子,对于细胞之间的黏附起到重要的作用,其下调是EMT的重要特征之一。β-catenin在细胞膜上与E-cadherin形成复合体,共同参与细胞之间的黏附作用。E-cadherin、β-catenin的表达下调常使细胞之间的黏附能力下降,转移和侵袭能力增强。在多种肿瘤组织中如结肠癌、肺癌等也发现E-cadherin/β-catenin复合体的破坏,与肿瘤的复发和转移密切相关[6-9]。本研究165例NSCLC患者,E-cadherin/β-catenin复合体在65例(39.4%)患者中完整存在。E-cadherin/β-catenin复合体不完整组的总生存期显著短于完整组,表明E-cadherin/β-catenin复合体完整的患者预后较好。
EMT的另外一个重要方面是间叶标记的表达,如间叶细胞表面标志物Vimentin和调节间叶细胞分化的核转录因子Snail、S-100A4等。许多研究显示,间叶蛋白的表达与肿瘤的分化程度以及细胞侵袭的表现型和肿瘤患者生存期缩短相关[10-13]。Snail的表达可以增加乳腺肿瘤细胞的侵袭性,在乳腺癌中其高表达与肿瘤的低分化和患者生存期缩短相关[11]。过表达Snail使胰腺肿瘤细胞的转移和侵袭能力增强,将过表达Snail的胰腺肿瘤细胞注射入小鼠体内,发现肿瘤的转移能力明显增强[14]。Snail、Vimentin阳性组的总生存期显著短于阴性组。Snail或者Vimentin阳性的患者的预后较差,说明Snail、Vimentin异常表达的患者常常在术后易发生肿瘤复发和转移,生存时间较短。本研究中Snail与肿瘤的分化程度相关,中高分化的肿瘤Snail高表达,低分化的肿瘤Snail表达相对较低,这表明Snail可能在NSCLC的发生中起重要作用。
Snail的表达与E-cadherin的表达呈负相关。Snail是一种核转录因子,通过与E-cadherin启动子的结合而抑制E-cadherin的表达[15]。E-cadherin的表达与β-catenin呈正相关,β-catenin的膜丢失常伴随着E-cadherin表达的降低。原因可能是当E-cadherin丢失,E-cadherin/β-catenin复合体遭到破坏,β-catenin由细胞膜的定位转移至细胞核中,发挥转录因子的作用,调节与EMT相关蛋白的表达[16]。
目前许多研究已经报道了采用一些分子标志物能够判断NSCLC患者的预后和生存情况[17-18]。但是将与转移相关的一些分子标志物联合起来,用来判断NSCLC患者的预后和生存情况的研究还很少。Snail、Vimentin及E-cadherin/β-catenin复合体的异常表达是EMT过程中的重要变化,在多种肿瘤中表达异常与患者的预后有着密切的关系。本研究显示,Snail、Vimentin及E-cadherin/β-catenin复合体EMT异常表达与NSCLC患者生存期短相关。根据每个患者这3种蛋白的改变情况,将患者分为EMT-L1组与EMT-L2组,EMT-L2组患者与EMT-L1组患者相比,其分化程度相对较低,说明当EMT的水平越升高时,不仅使细胞之间的黏附性下降,同时对于肿瘤组织的分化程度也有一定的影响。生存分析结果显示,EMT-L2组患者的总生存期显著短于EMT-L1组。此因素与TNM分期和肿瘤最大径是独立的预后因素,因此根据患者这3种与转移相关的蛋白的异常表达情况,能够对患者的生存情况做出判断,这3种蛋白中任意2种蛋白表达异常时患者的预后较差。晚期的NSCLC在手术后要接受化疗,然而早期NSCLC的化疗仍然存在争议[19]。本研究也分析了此分组在Ⅰ期NSCLC患者中判断患者生存期的作用。在Ⅰ期NSCLC患者中,EMT-L2组患者的总生存期显著短于EMT-L1组患者。因此这3种蛋白的异常表达情况对手术后Ⅰ期NSCLC患者的治疗具有指导意义。
综上所述,Snail、Vimentin和E-cadherin/β-catenin复合体在NSCLC中的异常表达与患者的生存期相关。任何2种或2种以上蛋白的异常表达提示预后相对较差,是NSCLC独立的风险预后因子,这对于NSCLC患者的治疗方式和预后判断具有重要的参考价值。
[1]SUGIMURA H, NICHOLS F C, YANG P, et al.Survival after recurrent non-small cell lung cancer after complete pulmonary resection[J].Ann Thorac Surg, 2007, 83(2): 409-417.
[2]D’AMICO T A.Molecular biologic staging of lung cancer[J].Ann Thorac Surg, 2008, 85(2): 737-742.
[3]KLYMKOWSKY M W, SAVAGNER P.Epithelialmesenchymal transition: a cancer researcher's conceptual friend and foe[J].Am J Pathol, 2009, 174(5): 1588-1593.
[4]GUPTA G P, MASSAGUE J.Cancer metastasis: building a framework[J].Cell, 2006, 127(4): 679-695.
[5]ENGELS K, KNAUER S K, METZLER D, et al.Dynamic intracellular survivin in oral squamous cell carcinoma:underlying molecular mechanism and potential as an early prognostic marker[J].J Pathol, 2007, 211(5): 532-540.
[6]BAUMGART E, COHEN M S, SILVA NETO B, et al.Identification and prognostic significance of an epithelialmesenchymal transition expression profile in human bladder tumors[J].Clin Cancer Res, 2007, 13(6): 1685-1694.
[7]AAMODT R, BONDI J, ANDERSEN S N, et al.The prognostic impact of protein expression of E-cadherin-catenin complexes differs between rectal and colon carcinoma [J].Gastroenterol Res Pract, 2010[Epub 2010 Aug 16].
[8]KANG H, MIN B S, LEE K Y, et al.Loss of E-cadherin and MUC2 expressions correlated with poor survival in patients with stages Ⅱ and Ⅲ colorectal carcinoma[J].Ann Surg Oncol, 2010, 18(3): 711-719.
[9]CHELIDONIS G, KAVANTZAS N, PATSOURIS E, et al.DNA ploidy, E-cadherin, beta-catenin expression and their clinicopathologic significance in imprints of non-small cell lung cancer[J].Anal Quant Cytol Histol, 2009, 31(5): 332-339.
[10]GALVAN J A, GONZALEZ M V, CRESPO G, et al.Snail nuclear expression parallels higher malignancy potential in neuroendocrine lung tumors[J].Lung Cancer, 2010, 69(3):289-295.
[11]MOODY S E, PEREZ D, PAN T C, et al.The transcriptional repressor Snail promotes mammary tumor recurrence[J].Cancer Cell, 2005, 8(3): 197-209.
[12]WILLIPINSKI-STAPELFELDT B, RIETHDORF S,ASSMANN V, et al.Changes in cytoskeletal protein composition indicative of an epithelial-mesenchymal transition in human micrometastatic and primary breast carcinoma cells[J].Clin Cancer Res, 2005, 11(22): 8006-8014.
[13]LASCOMBE I, CLAIROTTE A, FAUCONNET S, et al.N-cadherin as a novel prognostic marker of progression in superficial urothelial tumors[J].Clin Cancer Res, 2006,12(9): 2780-2787.
[14]NISHIOKA R, ITOH S, GUI T, et al.SNAIL induces epithelial-to-mesenchymal transition in a human pancreatic cancer cell line (BxPC3) and promotes distant metastasis and invasiveness in vivo[J].Exp Mol Pathol, 2010, 89(2): 149-157.
[15]CASTRO ALVES C, ROSIVATZ E, SCHOTT C, et al.Slug is overexpressed in gastric carcinomas and may act synergistically with SIP1 and Snail in the down-regulation of E-cadherin[J].J Pathol, 2007, 211(5): 507-515.
[16]STEMMER V, DE CRAENE B, BERX G, et al.Snail promotes Wnt target gene expression and interacts with beta-catenin[J].Oncogene, 2008, 27(37): 5075-5080.
[17]SINGHAL S, VACHANI A, ANTIN-OZERKIS D, et al.Prognostic implications of cell cycle, apoptosis, and angiogenesis biomarkers in non-small cell lung cancer: a review[J].Clin Cancer Res, 2005, 11(11): 3974-3986.
[18]LAU S K, BOUTROS P C, PINTILIE M, et al.Three gene prognostic classifier for early-stage non-small cell lung cancer[J].J Clin Oncol, 2007, 25(35): 5562-5569.
[19]STRAUSS G M, HERNDON J E Ⅱ, MADDAUS M A, et al.Adjuvant paclitaxel plus carboplatin compared with observation in stage ⅠBnon-small cell lung cancer: CALGB 9633 with the Cancer and Leukemia Group B, Radiation Therapy Oncology Group, and North Central Cancer Treatment Group Study Groups[J].J Clin Oncol, 2008, 26(31): 5043-5051.
