MDM2基因SNP309可能与早发性乳腺癌易感性无关:福建病例-对照研究
2011-05-30宋传贵傅芳萌吴雪英林舜国王川
宋传贵 傅芳萌 吴雪英 林舜国 王川
福建医科大学附属协和医院乳腺外科,福建 福州 350001
早发性乳腺癌(发病年龄≤35岁)属于具有遗传倾向的乳腺癌人群,易感性基因BRCA1或BRCA2基因的胚系突变只能解释其中10%的人群[1],其余的则涉及到众多低外显易感基因位点[2]。MDM2基因为抑癌基因p53的负性调控因子,与p53协同调控细胞周期,保持基因组稳定性[3]。近年来有研究表明,MDM2基因的SNP309 (T>G,rs2279744)可能增加人群的散发性乳腺癌发病风险[4-5]。但各研究结果尚不一致,国内尚无MDM2基因SNP309单核苷酸多态性在早发性乳腺癌(≤35岁)易感性中的作用的研究报道。为进一步明确其可能的易感效应,本研究选择福建地区早发性乳腺癌患者为研究对象,探讨MDM2rs2279744多态性位点基因型的分布及是否可以作为乳腺癌的低外显率易感基因位点的可能性。
1 资料和方法
1.1 资料来源
1.1.1 研究对象
病例为福建医科大学附属协和医院2006年1月—2010年6月无血缘关系的福建地区汉族123例原发性乳腺癌患者,全部经组织病理证实,家族史状况由病史或调查表获得,并最后经本人证实。病例组均为单纯早发性乳腺癌患者,无明显家族史,发病年龄≤35岁。入组患者年龄21~35岁,中位年龄31.7岁。平均初潮年龄为(15.0±1.5)岁。对照组101例为健康女性,年龄20~39岁,中位年龄33.01岁,平均初潮年龄为(14.0±1.6)岁,按年龄与研究对象配对(年龄±4岁)入组。年龄以及初潮年龄两组相比,差异均有统计学意义(P=0.023,P<0.01)。
1.1.2 标本
获得患者知情同意后,抽取外周静脉血5 mL置于含800 μL酸性枸橼酸葡萄糖(ACD)抗凝液的试管中备用。
1.1.3 主要试剂和仪器
FlexiGene DNA提取试剂盒(美国Qiagen公司),GeneAmp®9700 PCR 系统(美国ABI公司),HotStar Taq聚合酶(5 U/μL)及试剂盒(美国Qiagen公司),MassARRA YTM Analyzer(美国Sequenom公司)。
1.2 方法
1.2.1 基质辅助激光解吸电离飞行时间质谱(MALDI-TOF-MS)法
步骤方法参考文献[6-7](与深圳华大基因组研究中心合作完成):⑴DNA提取 从外周血提取基因组DNA,置于-20 ℃冰箱中保存备用。⑵PCR扩增 引物如下:1st-PCRP:5’-ACGTTGGATGAGTTCAGGGTAA AGGTCACG-3’,2nd-PCRP:5’-ACGTT GGATGTCACACTAGTGACCCGACAG-3’, UEP序列:5’-GGACCTCCCGCGCCG-3’。PCR反应体系总体积为5 μL,其中各种引物浓度为0.1 μmol/L,各种dNTP浓度为0.25 μmol/ L,MgCl2浓度为1 mmol/L,Taq多聚酶(Invitrogen)1.25 U,DNA 模板2.5 ng。PCR反应的条件为95 ℃预变性15 min;94 ℃变性20 s,56 ℃退火30 s,72 ℃延伸1 min,共45个循环;72 ℃终延伸3 min,然后4 ℃保存。随后纯化PCR产物进行延伸反应。延伸反应体系总体积9 μL,PCR纯化产物7 μL,延伸混合液2 μL。反应条件:94 ℃预变性2 min;94 ℃变性5 min,52 ℃退火5 min,72 ℃延伸5 min,55个循环;72 ℃终延伸3 min,产物于4 ℃保存。每个延伸反应用3 mg Clean Resin树脂纯化后于384孔Specter CHIP芯片上点样。使用MassARRA YTM Analyzer质谱检测,运行MassARRA YTM Typer 3.0.1软件进行数据分析,并输出各样本相应位点的基因型。
1.2.2 基因型的判断
各样本经PCR反应及质谱检测,检测位点就生成特征性峰值图,通过判断其特征性峰值图,就可得出其相应的碱基。各位点的代表性图谱见图1。
1.3 统计学处理
应用SPSS 17.0统计软件进行统计分析。采用χ2检验进行各基因型和等位基因频率在病例组和对照组间的分布差异比较以及Hardy-Weinberg遗传平衡定律的吻合度检验;两组间的流行病学资料均数间比较采用t检验;相对危险度采用比值比(odd ratio,OR)和95%可信区间(confidence interval,CI)并应用非条件Logistic回归分析计算,并对混杂因素进行校正。所有统计采用双侧概率检验,以P<0.05为差异有统计学意义。

2 结 果
2.1 病例对照组间流行病学特征比较
病例组的年龄小于对照组的年龄,对照组初潮年龄低于病例组的初潮年龄(P<0.05),所以在计算OR时需要予以校正。
2.2 基因型鉴定
MDM2基因rs2279744各基因型采用时间飞行质谱分析鉴定(图1),结果共123例病例和101例对照PCR成功进行分型。
2.3 MDM2基因SNP309 基因型分布
正常对照组中MDM2基因rs2279744 TT、TG及GG基因型的频率分别为28(27.7%)、50(49.5%)和23(22.8%);经Hardy-Weinberg遗传平衡定律检验,均符合遗传平衡(P>0.05),表明其具有群体代表性。病例组rs2279744 TT、TG及GG基因型的频率分别为26(21.1%)、61(49.6%)和36(29.3%),与对照组相比,差异无统计学意义(P=0.389,表1)。
2.4 SNP309基因型与乳腺癌发病风险的关系
分别以rs2279744 TT基因型为参照,非条件Logistic回归分析结果提示,不管TG [1.216(95%CI:0.604~2.445)]或是GG[1.326(95%CI:0.869~2.024)]还是TG+GG[1.358(95%CI:0.706~2.614)]都提高了患乳腺癌的发病危险,但差异均未达到统计学意义(P>0.05,表1)。
3 讨 论
MDM2基因为p53的上游基因,可以负性抑制p53基因抑癌功能的表达,SNP309 (T>G)为功能性多态,位于基因的启动子区,可以上调MDM2蛋白表达,从而抑制p53及其下游通路的抑癌功能,某些研究表明T>G的转换增加了乳腺癌的发病风险。在江苏人群的研究中,Ma等[5]的研究中605例对照中MDM2基因各基因型的频率结果(TT 24%、TG 50.9%、GG 25.1%)与本研究101例对照的结果相似(TT 27.7%、TG 49.5%、GG 22.8%),其中,GG基因型比例明显低于新加坡人群(44例对照,34.1%)[4];说明中国大陆人群与新加坡的华裔人群的地域特征和遗传特征已有不同。Logistic回归分析表明,本研究MDM2基因的多态性位点SNP309(GGvsTT或GG+TGvsTT)在病例组中的分布相对于对照人群有增高趋势,但都未显著性的提高早发性乳腺癌的发病风险。这与在散发性乳腺癌的研究基本相似[5,8],表明该多态性位点对乳腺癌的易感效应相对微弱。相对于上海人群中进行的乳腺癌研究,Lum等[4]发现MDM2基因的SNP309 G等位基因增加总体乳腺癌的发病风险达2.68 (1.54~4.69)倍;但是在早发性散发性乳腺癌(<40岁)亚组中,SNP309多态性G基因型对乳腺癌发病风险为1.53 (0.68~3.45),这与本研究结果相似,说明在早发乳腺癌人群中SNP309的效应作用较小,可被其他易感基因所掩盖。
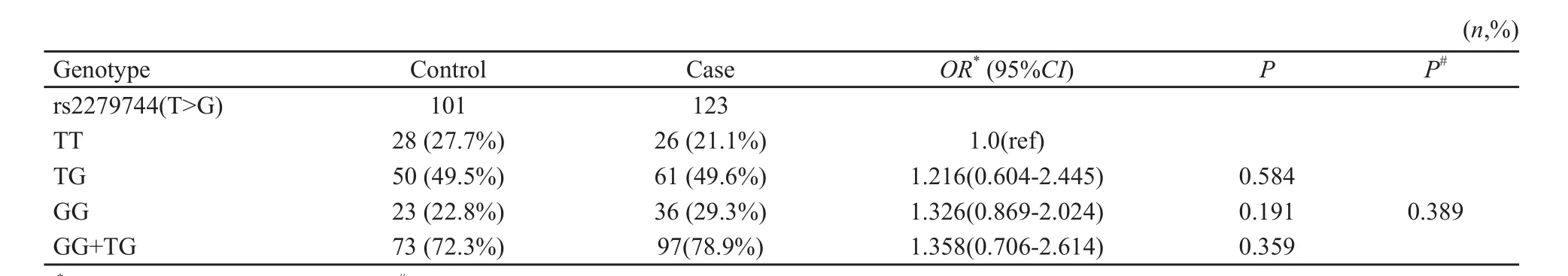
表 1 MDM2 SNP309多态性基因型分布及其与乳腺癌发病风险的关系Tab.1 Genotype distribution of SNP 309 of MDM2 gene and its association with risk of breast cancer
我们的研究与前面的研究不同之处在于,本研究的例数相比散发乳腺癌人群要少,可能存在着选择偏差,但由于我们的研究对象为具有遗传倾向的早发性乳腺癌(发病年龄≤35岁),更能体现基因的易感效应,所以偏差可以得到一定程度的纠正。对比在中国台湾的散发性乳腺癌研究(124病例,平均年龄54岁;97例对照,平均年龄38岁),本研究(123病例,平均年龄31.78岁;101例对照,平均年龄33.01岁)的结果值得探讨[9]。
从遗传基因组学分析,MDM2基因SNP309多态性位点可以影响基因的转录过程和蛋白产物的表达,但其实际的遗传学效应尚不明确;其二是否其潜在影响被其他未鉴定的相对高外显易感基因位点所覆盖尚需考证。
总之,本研究结果认为,MDM2基因SNP309多态性在中国大陆人群中有其自身的分布特点,可能与福建地区早发性乳腺癌(≤35岁)的遗传易感性无明显关联,尚不能作为低外显率的乳腺癌易感基因位点。明确MDM2基因遗传多态性位点在中国人群中的确切作用,还需要更大样本的遗传倾向乳腺癌的流行病学研究确认。
[1]Song CG, Hu Z, Wu J, et al.The prevalence of BRCA1 and BRCA2 mutations in eastern Chinese women with breast cancer [J].J Cancer Res Clin Oncol, 2006, 132(10): 617-626.
[2]Hu Z, Song CG, Lu JS, et al.A multigenic study on breast cancer risk associated with genetic polymorphisms of ER Alpha, COMT and CYP19 gene in BRCA1/BRCA2 negative Shanghai women with early onset breast cancer or affected relatives[J].J Cancer Res Clin Oncol, 2007, 133(12):969-978.
[3]Firoz EF, Warycha M, Zakrzewski J, et al.Association of MDM2 SNP309, age of onset, and gender in cutaneous melanoma[J].Clin Cancer Res, 2009, 15(7):2573-2580.
[4]Lum SS, Chua HW, Li H, et al.MDM2 SNP309 G allele increases risk but the T allele is associated with earlier onset age of sporadic breast cancers in the Chinese population [J].Carcinogenesis, 2008, 29(4):754-761.
[5]Ma H, Hu Z, Zhai X, et al.Polymorphisms in the MDM2 promoter and risk of breast cancer: a case-control analysis in a Chinese population [J].Cancer Lett, 2006, 240(2):261-267.
[6]Milne AN, Carneiro F, O'Morain C, et al.Nature meets nurture: molecular genetics of gastric cancer [J].Hum Genet, 2009, 126(5):615-628.
[7]Lee DH, Hahm KB.Inflammatory cytokine gene polymorphisms and gastric cancer[J].J Gastroenterol Hepatol, 2008, 23(10):1470-1472.
[8]Petenkaya A, Bozkurt B, Akilli-Ozturk O, et al.Lack of association between the MDM2-SNP309 polymorphism and breast cancer risk [J].Anticancer Res, 2006, 26(6C):4975-4977.
[9]Sun YF, Leu JD, Chen SM, et al.Results based on 124 cases of breast cancer and 97 controls from Taiwan suggest that the single nucleotide polymorphism (SNP309) in the MDM2 gene promoter is associated with earlier onset and increased risk of breast cancer [J].BMC Cancer, 2009, 9:13.
