玫瑰胶囊的微乳薄层鉴别及吸湿特性研究
2011-05-26郎轶咏梅丽娜朱晓红姜同英
郎轶咏, 王 强, 梅丽娜, 朱晓红, 姜同英
(1.中国人民解放军第202医院,辽宁沈阳 110003;2.沈阳药科大学药学院,辽宁沈阳 110016)
玫瑰胶囊为中国人民解放军第二〇二医院院内制剂,由当归、夏枯草、杜仲、天麻、红花几味中药经过提取加工制成,具有化瘀止痉、养血安神的功效,主要用于各种昡晕,心脑缺血性疾病以及高血压的治疗。玫瑰胶囊成分复杂,吸湿性较强,原标准采用薄层色谱法分别对夏枯草、杜仲进行鉴别,操作涉及提取、萃取、过柱分离、浓缩、干燥等过程,程序复杂且重现性差。为简化鉴别方法,以含微乳液展开剂作为流动相,聚酰胺薄膜为固定相,研究了玫瑰胶囊的微乳薄层色谱行为,对玫瑰胶囊的有效成分(夏枯草、杜仲、红花)进行了分离和鉴定,取得了较好的效果[1-3]。为提高药物的稳定性,本实验以玫瑰胶囊内容物吸湿时间曲线、吸湿等温线、平衡吸湿量和临界相对湿度作为判断指标,采用二项式回归的方法[4],直观表征了内容物吸湿特性,归纳了内容物吸湿性的规律,为寻找适宜的防潮方法提供实验依据及理论支持。
1 仪器与试剂
2F-1三用紫外分析仪(上海精科实业有限公司);FA2004电子分析天平(上海天平仪器厂);电热恒温培养干燥用箱(厦门医疗电子仪器厂);玫瑰胶囊(中国人民解放军第202医院制剂室,批号:20081103);对照药材:当归、夏枯草、杜仲、天麻、红花由202制剂室提供;十二烷基硫酸钠(SDS)(湖南尔康制药有限公司);司盘(SP)80(国药集团化学试剂限公司);其它试剂均为分析纯;
2 实验方法
2.1 溶液的制备
2.1.1 微乳层析液制备[2-3]取SDS,精密称定,溶解于适量水中,分别加入表面活性剂、油相,加水至足量,磁力恒温搅拌器搅拌混匀,放置24 h即得澄清透明的微乳液。将各种改性剂加至组成不同的微乳液中,即得组成不同的微乳层析液。
2.1.2 供试品溶液的制备 取玫瑰胶囊内容物3 g,加甲醇10 mL,超声振荡30 min,备用。
2.1.3 对照药材溶液的制备 分别取夏枯草、杜仲、红花对照药材5 g,加甲醇10 mL,超声提取30 min过滤,滤液为对照药材溶液。
2.1.4 阴性对照溶液的配制 按处方比例,分别制备夏枯草、杜仲、红花四味药材的阴性对照溶液。
2.2 薄层色谱 分别吸取夏枯草、杜仲、红花的对照药材溶液、阴性对照溶液及玫瑰胶囊供试品溶液及阴性对照溶液各2 μL,点于聚酰胺薄膜,直径为1~2 mm。以微乳层析液为展开剂,室温下饱和30 min,上行法展开,展程约6 cm,取出晾干后,立即置紫外光(365 nm)下检视,供试品色谱中,在与对照药材溶液色谱相应位置上夏枯草显蓝色荧光斑点,杜仲显蓝色荧光斑点;红花显绿色荧光斑点。
2.3 吸湿性实验 精密称取玫瑰胶囊内容物1.0 g,平摊于恒重的称量瓶中。开盖置于干燥器中7 d使其脱湿平衡。取脱湿后的内容物颗粒,精密称重后置于不同湿度恒温干燥器(25℃),每隔一定时间精密称重至吸湿重量不再增加,计算吸湿增重百分率及绘制吸湿曲线。
吸湿增重百分率%=(吸湿后样品重量-吸湿前样品重量)/吸湿前样品重量×100%
3 实验结果
3.1 微乳展开体系的选择
3.1.1 SDS对展开效果的影响 分别取不同量的SDS与15.8 g正丁醇、2.5 g正辛烷及77.0 g重蒸馏水配制系列微乳液,以微乳液-甲酸(9∶1)为展开剂,对夏枯草、杜仲、红花的对照药材溶液薄层展开,SDS量对对照药材主斑点Rf影响情况见图1。夏枯草对照药材溶液的Rf值随十二烷基硫酸钠(SDS)量的增加变化不明显;红花对照药材溶液的Rf值与杜仲对照药材溶液的Rf值随十二烷基硫酸钠(SDS)量的增加先降低后增大(见图1)。
在W/O型微乳中,表面活性剂极性端位于其内部,随着SDS量的增加,表面活性剂胶团量增加,对极性物质(红花、杜仲)的吸附性增加,Rf值随SDS量的增加而减小;在O/W型微乳中则相反。当SDS量为6.7 g时微乳由W/O型向O/W型转变[5],表现为极性物质(红花、杜仲)的增溶作用随表面活性剂(SDS)量的逐渐增加而增强,其Rf值则随表面活性剂(SDS)量的逐渐增加而增加;夏枯草Rf值较小,则变化不大。当SDS量为4.7 g,相邻组分间的分离度较大,分理效果理想。
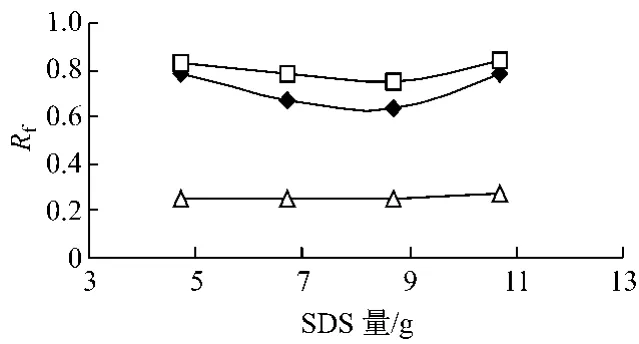
图1 玫瑰胶囊主要成分的Rf值与SDS量的关系图Fig.1 The relationship between Rfand the amount of SDS
3.1.2 油相对展开效果的影响 以微乳液(SDS-正丁醇-油相-水 =4.7 ∶15.8 ∶2.5 ∶77 g/g)-甲酸(9∶1)为展开剂,对夏枯草、杜仲、红花的对照药材溶液薄层展开,结果见图2。

图2 玫瑰胶囊各主要成分Rf值与油相种类的关系图Fig.2 The relationship between Rfand the oil phase
微乳中所使用的油相应与界面膜上表面活性剂分子之间保持渗透和联系,并易于与表面活性剂形成界面膜,这就意味着油相分子的大小对微乳的形成较为重要。一定范围内,油相分子体积越小,对药物的溶解力越强,油相分子体积过大则不能形成微乳,所以一般选择短链油相。正己烷、正庚烷、正辛烷为油相的微乳中,选择正辛烷作为油相,相邻组分间的分离度较大,分理效果理想,固选其作为油相。
3.1.3 改良剂对层析效果的影响 在保证(SDS-正丁醇-正辛烷-水 =4.7∶15.8 ∶2.5 ∶77 g/g)微乳液组分不变的情况下,考察了多种改性剂,如甲酸,乙酸,乙酸乙酯,氯仿,氨水等对夏枯草、杜仲、红花的对照药材分离情况的影响。结果表明乙酸乙酯,氯仿加入后不能形成微乳。选择甲酸做为改良剂相邻组分间的分离度较大,分离效果理想;乙酸的加入不能改善层析结果中的拖尾现象。固选择甲酸作为改良剂。甲酸加入量对各组分的Rf值的影响结果见图3。甲酸的含量大于10%时,相邻组分间的分离度较大,分离效果理想,固选其微乳与甲酸配比为9∶2。实验中发现丙酮的加入可明显缩短展开时间且不影响展开效果,因此,选择甲酸、丙酮同时作为改性剂,以获得最佳层析效果。丙酮加入量对展开效果的影响见图4。微乳-甲酸-丙酮比例达到9∶2∶1时,相邻组分间的分离度较大,分离效果理想。
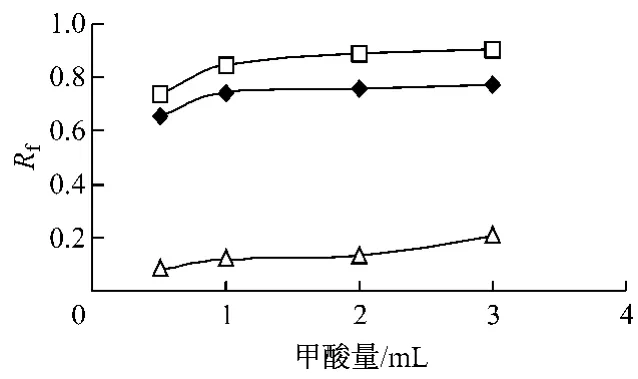
图3 甲酸量对各主要成分Rf值的影响Fig.3 The effect of formic acid on the Rf

图4 丙酮对玫瑰胶囊主要成分Rf值的影响Fig.4 The effect of acetone on the Rf
3.2 层析结果 以含水量77%微乳液-乙酸-丙酮(9∶2∶1)为展开系统,玫瑰胶囊的薄层色谱见图5。玫瑰胶囊色谱中,供试品色谱所呈对照药材溶液主斑点的位置和荧光颜色与对照品相同,各阴性对照液无此斑点。玫瑰胶囊中夏枯草、杜仲及红花3种主要成分在所选择的展开系统中分离效果较佳,此展开系统可用于玫瑰胶囊中夏枯草、杜仲及红花3种主要成分。

图5 玫瑰胶囊主要成分鉴别微乳薄层色谱图Fig.5 TCL chromatograms of Meigui Capsule
3.3 吸湿时间曲线的数据化处理及结果 对玫瑰胶囊内容物吸湿-时间曲线进行一元二次方程拟和得方程:

式中w为吸湿量,t为时间,a,b,c分别为常数。对方程(1)进行一阶求导得到吸湿速率(r)方程:

由方程(2)可知当t=0时,吸湿的初始速度为r0=b;当达吸湿平衡时,吸湿速度为0,则达到吸湿平衡时间为t′=-b/2a,样品的吸湿平衡时量为w′=at′2+bt′+c[6]。数据分析结果见表 1。玫瑰胶囊内容物初始吸湿速率随环境相对湿度的增加而加快,相对湿度达到62%,初始吸湿速率增大明显,提示我们生产过程中相对湿度应控制在60%以下。玫瑰胶囊内容物吸湿平衡时间与吸湿增重百分率计算值与实测值相一致。
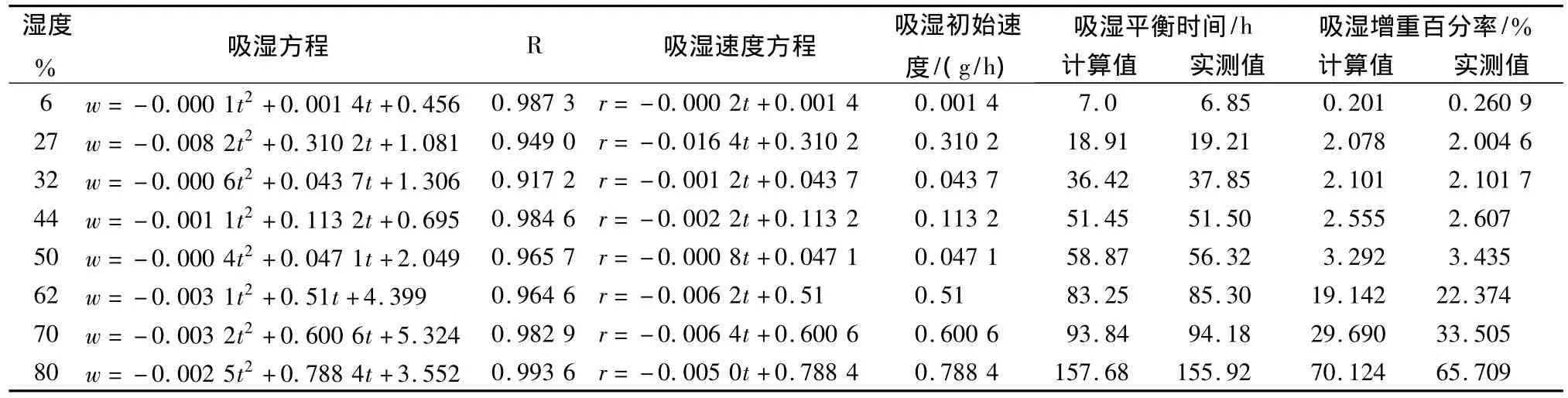
表1各湿度吸湿数据结果Tab.1 The data of moisture absorption
3.3 相对湿度的测定 以平衡吸湿百分率对相对湿度作图,分别对曲线两端作切线,切线交点所对应的横坐标即为玫瑰胶囊内容物的临界相对湿度为65%(见图6),与计算值相符。

图6 25℃条件下吸湿平衡曲线Fig.6 Critical relative humidity curve
4 讨论
中成药的成分非常复杂,有效成分的鉴定比较困难。本课题研究了微乳薄层色谱法对玫瑰胶囊有效成分的分离鉴定。以微乳液作为展开剂与常用展开剂相比,被测组分与其它组分的分离度显著提高,样品中检出的斑点明显增多。微乳薄层色谱的原理与胶束色谱理论大致相同[7],当以微乳为流动相时,溶质的分配可能是在固定相、微乳液的水连续相及油核和界面膜数相之间进行。由于微乳液的富集增溶,降低界面张力作用,极性大的分子分配于微乳水连续相中,极性小的分子分配于微乳油核或穿插排列于表面活性剂与助表面活性剂组成的膜栅栏中。并且由于分配、吸附、静电、疏水、立体等效应,使待测药品中各组分在微乳液中展开是迁移速度不同,使其具有独特的选择性,可同时分离亲水物质和疏水物质,对带电成分和非带电成分亦有较好的分离选择,适用于分离结构和性质差别细微的复杂组分的物质,且更有利于提高色谱效率。本研究同时对同一药物中几种有效成分在微乳中的色谱行为进行探讨[8-10]。实验表明,性质差别较大的各类组分和性质结构差别细微的同系物可同时进行分离鉴定,克服了常用层析方法一次只能鉴定某单一成分的缺憾,为中成药有效成分的分离鉴定提供了一种高效简捷的新方法。
玫瑰胶囊为铝塑包装,具有一定的防潮性能,基本能满足产品的需求,但生产环节中涉及到整粒结束到成品包装前半成品储存条件,胶囊内容物吸湿曲线可以直观地比较不同提取物吸湿程度的强弱,而对吸湿过程的数据处理可以为比较不同吸湿性提取物提供丰富的理论数据。新的吸湿特性参数可以比较准确的直接表征中药提取物的吸湿能力,对指导优化生产过程中防潮工艺的选择,优选产品包装材料,优化半成品储存条件有重要的意义。
[1]李干佐,郭 荣.微乳液理论及其应用[M].北京:石油工业出版,1995:159.
[2]曾常青,谭泉基.止咳枇杷颗粒的微乳薄层鉴别[J].广东药学院学报,2006,22(3):261-262.
[3]康 纯,闻璃毓,丁仲伯.微乳薄层色谱用于黄酮类药物分离鉴定的研究[J].药物分析杂志,2000,20(2):121.
[4]丁志平,乔延江.不同粒径黄连粉体的吸湿性实验研究[J].中国实验方剂学杂志,2004,10(3):5-7.
[5]康 纯,闻利毓,丁仲伯,等.微乳薄层色谱用于黄连类药物分离鉴定的研究[J].中国中药杂志,2000,25(5):262-263.
[6]杜若飞,冯 怡,刘 怡.中药提取物吸湿特性的数据分析与特征[J].中成药,2008,30(12):1767-1771.
[7]戈早川,林辉概,李志良.胶束色谱与包合色谱的概况与进展[J].分析化学,1991,19(9):1092.
[8]钟精芬.表面活性剂在药剂学中的应用[M].北京:人民卫生出版社,1996:543.
[9]崔正刚.微乳化技术与应用[M].北京:中国轻工业出版社,1999:15-16.
[10]张正全,陆 彬.微乳给药系统研究概况[J].中国医药工业杂志,2001,32(3):139.
