大承气颗粒中大黄酚在大鼠体内血药浓度的含量测定
2011-05-26刘俊红方步武伍孝先李棣华吴咸中
刘俊红, 方步武, 伍孝先, 李棣华, 吴咸中
(1.天津市中西医结合急腹症研究所,天津 300100;2.天津医科大学,天津 300070)
大承气颗粒与《伤寒论》中大承气汤的处方组成相同(大黄、厚朴、枳实、芒硝),作为医院制剂在天津市南开医院用于急腹症的中西医结合治疗已20余年。目前我院采用先进工艺提取精制的大承气颗粒,用于肠梗阻[1]、急性胰腺炎[2]、内毒素血症[3]及其它腹腔感染性疾病[4]的治疗,取得满意疗效。有文献报道大黄酚在兔体内血药浓度的测定[5-6],金氏痔疮膏或通脉活血灵胶囊制剂中大黄酚的HPLC测定[7-8],但大承气复方中大黄有效成分的血药浓度测定未见报道。本研究的系列工作表明,大承气颗粒给大鼠灌胃后,大黄的主要成分可被吸收入血[9],其血清中大黄酚的测定不受方中其它成分和空白血清的干扰,从而建立了测定大承气颗粒中大黄酚的血药浓度的HPLC,并初步分析了其血药浓度的变化,为大承气颗粒的进一步研究和应用奠定基础。
1 仪器与材料
1.1 动物
Wistar大鼠10只,清洁级,军事医学科学院第四研究所动物室提供,体重200 g~250 g,♀♂兼用。
1.2 仪器
日本岛津LC-10ATvp高效液相色谱仪;SPD-10Avp紫外-可见光检测器;数据处理使用SSI分析之星工作站;日本岛津Libror AEG-120万分之一天平;LXJ-64-01型离心机(北京医疗仪器修理厂)。
1.3 药品与试剂
大承气颗粒(天津市南开医院药物研究室制备);大黄酚对照品(中国药品生物制品检定所提供,批号0796-9404);乙腈、甲醇均为色谱纯,氯仿、高氯酸均为分析纯。
2 方法与结果
2.1 大鼠用药剂量和药物血清制备
大承气颗粒单次用药剂量为1.205 g/kg,配成浓度为0.2 g/mL的混悬液,用前充分摇匀;大鼠灌胃 0.602 5 mL/100 g,分别于灌胃后30 min、45 min、1、1.5、3、6、12、24 h 大鼠球后静脉丛采血,各时间点采血均约 1 mL,离心 3 500 r/min,20 min,血清分装,-20℃冻存。
2.2 血清样品的处理
分别将不同时间段的血清解冻,精密吸取500 μL置于10 mL离心管中,精密加入1 mL高氯酸,振摇1 min,再精密加入氯仿提取2次,每次5 mL,振摇 1 min,离心(4 000 r/min,20 min),吸取氯仿层合并,过0.45 μm微孔滤膜,冷风吹干,残留物用甲醇100 μL溶解作为样品液。
2.3 色谱条件
色谱柱kromasil C18250 mm×4.6 mm,流动相:甲醇-水(含1%高氯酸)80∶20,流速1.0 mL/min,检测波长254 nm,灵敏度 0.01 AUFS,进样20 μL,室温。
2.4 标准曲线的制备
取约10 mg大黄酚对照品,精密称定,加入50 mL量瓶中用乙腈稀释至刻度,作为贮备液。从中精密吸取0.1、0.2、0.6、0.8、1.0 mL 加入 5 mL 量瓶,用乙腈稀释至刻度,再从浓度最低一份标准溶液中精密吸取2.5 mL用乙腈溶解于10 mL量瓶中。进样20 μL,测定峰面积,绘制AU-C曲线图,线性方程为Y=1.060×10-5X+3.027 ×10-1,相关系数r=0.999 7。
2.5 校正曲线的制备
从上述标准溶液中的五个浓度,分别精密吸取100 μL置于10 mL离心管中,冷风吹干,加入500 μL空白血清,按2.3项下操作,进样20 μL,测定峰面积,绘制AU-C曲线图,线性方程为Y=1.050×10-5X+2.034 ×10-1,相关系数r=0.999 9,线性范围为0.855 μg/mL。按上述色谱条件测定血清中大黄酚最低检测浓度为0.855 μg/mL。
2.6 回收率及精密度试验
分别取高、中、低三个浓度的大黄酚标准液,各精密吸取100 μL,加入到10 mL具塞离心管中,冷风吹干,加入500 μL空白血清溶解,再按2.2项下处理后进样测定,与相应对照品峰面积比较计算回收率。并且于日内不同时间和不同的日间分别进样测定,计算日内标准偏差和日间标准偏差,结果见表1。

表1 回收率及精密度试验
2.7 重现性试验
分别取大鼠灌胃1 h、6 h后的血清,各5份,再按2.2项下“精密吸取500 μL……作为样品液”处理后进样测定,进样20 L。结果血清样品中大黄酚RSD值分别为6.66%、7.18%。
2.8 稳定性试验
分别精密吸取浓度为1.14 μg/mL和27.36 μg/mL的大黄酚标准液100 μL,分别加入到10 mL具塞离心管中,冷风吹干,加入500 μL空白血清溶解,再按2.2项下“精密加入1 mL高氯酸……作为样品液”处理,分别于 0、4、8、24、48 h 进样测定,进样20 L。结果血清样品中大黄酚在48 h内RSD值分别为5.53%、2.28%,稳定性良好。
2.9 结果
2.9.1 大承气颗粒中大黄酚的含量测定 按照报道的方法[10]制备大承气颗粒并测定其中的大黄酚含量为5.98 mg/g。
2.9.2 空白血清色谱行为 取空白血清500 μL,按2.2项下操作。进样检测,血清中杂质不干扰大黄酚的含量测定。
2.9.3 大黄酚血药浓度测定及血药浓度—时间曲线图 将按2.2项法处理过的不同时间段血清样品进样20 μL,用外标法测定,色谱图见图1-A。每个时间点取3只大鼠,取其平均值,以横坐标为不同取血时间,纵坐标为大黄酚的浓度,绘制血药浓度-时间曲线,见图2。由图中可以看出,在灌胃1h后大黄酚的含量达到峰值,出现两个吸收峰值。

图1 含药血清、空白血清和标准品的HPLC图
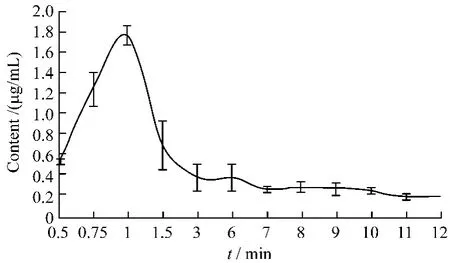
图2 大黄酚血药浓度—时间曲线
3 讨论
3.1 检测指标的确定
本提取方法能分离出大承气颗粒中大黄四种蒽醌类成分,见图1-A、1-C。但用缺项大黄的复方作为阴性对照药给大鼠灌胃,1 h后采血,经同法提取测定,色谱图中对应于芦荟大黄素、大黄酸处有干扰峰,与复方质量标准测定结果相似;大黄素体内含量较低,而且空白血浆对其略有干扰;大黄素甲醚微量,忽略不计,因此,选用大黄酚作为指标测定。
3.2 温度对检测的影响
温度对出峰时间影响很大,本研究控制室温24℃时,大黄酚出峰时间为24.5 min。
3.3 水解用酸与提取剂的选择
根据我们以往经验与文献报道[11-12],分别考察了盐酸、硫酸、高氯酸;乙醚-环己烷、乙醚、氯仿,最后确定用高氯酸水解,氯仿提取2次,大黄酚的测定不受血清干扰,且回收率较好。
3.4 我们曾用大黄生药、单味大黄提取物给大鼠灌胃,1 h后采血,经同法提取测定,结果大黄生药体内血药浓度远远低于大黄提取物,说明大黄提取物更利于体内吸收。
3.5 测定复方制剂血药浓度的意义
中药复方由若干味中药组成,每味中药又含有多种成分,多数中药或复方现行质量标准中“指标性成分”多为主要药物的主要成分或可检测成分,并无充分依据证明其为有效成分。由于药物在吸收等环节的相互作用,只有被吸收入血的成分才具有成为有效成分的可能。本研究证实复方中大黄的几个蒽醌类主要成分被吸收入血,以芦荟大黄素、大黄酸、大黄素、大黄酚的血药浓度较高,所建立的方法适用于血中大黄酚的定量测定,复方灌胃后约1 h,血中大黄酚的浓度达到峰值。大承气颗粒有一重要的作用环节即缩小肠道细菌库及内毒素池和保护肠屏障,虽然目前没有报道大黄酚在这方面的药理作用,但本研究对确定其药效物质基础有一定的意义。
[1]解基良,何清宇,薛文斗.大承气汤冲剂术后早期使用的临床观察[J].中国中西医结合外科杂志,2000,6(6):386.
[2]方步武,邱 奇,崔乃强,等.大承气颗粒剂和清胆灵对胆胰疾病所致全身性炎症反应的影响[J].中国中西医结合外科杂志,2000,6(6):375-379.
[3]穆拉迪.大承气颗粒对肠源性内毒素血症的影响[D].天津:天津医科大学,2006.
[4]邱 奇,崔乃强,吴咸中.大承气冲剂对腹腔感染所致SIRS/MODS的治疗作用[J].中国中西医结合外科杂志,2004,10(4):239-243.
[5]庞志功,汪宝琪,李生有.大黄素大黄酚在兔体内药代动力学的研究[J]. 西安医科大学学报,1993,14(4):346-348.
[6]谭晓虹,张丹参,张 力,等.大黄酚在兔体内药物代谢动力学的研究[J]. 中成药,2006,28(7):1039-1040.
[7]金 纯,鲍银童,刘长宝,等.金氏痔疮膏中大黄酚的药代动力学实验研究[J].温州医学院学报,2005,35(5):421-422.
[8]李兰芳,张勤增,解丽君,等.通脉活血灵胶囊中大黄酚在大鼠血浆中的浓度及药代动力学研究[J].河北医学,2006,12(12):1207-1209.
[9]方步武,吴咸中,来丽娜,等.大承气颗粒药物血清对小鼠肠上皮内淋巴细胞产生/分泌IL-2的作用[J].中国中西医结合外科杂志,2005,11(6):514-516.
[10]魏俊峰,刘俊红,伍孝先,等.“大承气汤”颗粒质量标准的研究[J]. 中草药,2000,31(4):257-260.
[11]谭 力,袁倚盛,杨俊伟,等.高效液相色谱法测定人血浆中大黄酸含量及药动学研究[J].金陵医院学报,1998,11(2):112-115.
[12]王新宏,范广平,安 睿,等.大鼠血浆中大黄蒽醌甙元的HPLC 分析方法学研究[J].中成药,1997,19(1):37-39.
