归延胶囊对脑缺血再灌注时相点大鼠皮层神经细胞凋亡的影响
2011-05-26刘明义王胜春王俊琴田卫斌曹增发
刘明义, 王胜春, 王俊琴, 田卫斌, 曹增发
(中国人民解放军第四军医大学西京医院药剂科,陕西西安 710032)
众多研究认为CI/R可导致缺血及周边区域神经细胞坏死和凋亡共存,其发生机制复杂,多种因素参与了其发生与发展[1-3]。凋亡在缺血性损害中尤其是CI/R中起着重要作用[4-5]。抑制细胞凋亡的发生,对于减轻局灶性脑缺血再灌注损伤程度和范围,减少脑梗塞体积和限制神经细胞结构及功能的损害,改善中风患者预后有重要意义。归延胶囊是由当归、莪术、延胡索组成的中药复方制剂,每粒内容物相当于含生药1.86 g,临床一日3次,每次3粒,用于脑栓塞恢复期及后遗症的治疗,本实验采用大鼠CI/R模型观察归延对凋亡及相关基因的影响,分析归延治疗脑缺血的作用机制,为临床用药提供依据。
1 材料与方法
1.1 实验动物 清洁级SD大鼠,体重(270±10)g,♂性,由第四军医大学实验动物中心,医动证字SCXK(军)2002-005。
1.2 材料 Fas、Fas-L、Bax、BcL-2、Caspase-3、9 引物合成(北京博迈);RT-PCR试剂盒(TaKaRa);细胞凋亡检测试剂盒(Roche);Rabbit anti-Fas、Fas-L、gout Anti-Rabbit辣根酶标记 IgG(Santa Cruz);Rabbit anti-Bax、Bcl-2、Caspase-3、9(Boster)、Saper ECL Plas超敏发光液(普利来公司);膜聚偏二氟乙烯(PVDF)膜(Millipore);红四氮唑(TTC)(上海山浦化);半干转膜仪(Bio-Rad);酶标仪(Biorad model 680,Japan);PCR扩增仪(USA PE);数字凝胶成像系统(USA Alpha);紫外分光光度计(UV-2501PC)(日本岛津);归延胶囊(归延)(西京医院药剂科生产,批号:20060815)。
1.3 大鼠脑中动脉脑缺血再灌注模型建立 取清洁级SD大鼠180只,依文献[6]建立大鼠MCAO脑CI/R模型,术后随机分为模型组,归延2.00 g/kg组,另取大鼠90只,除不插线外,其余方法同上,为假手术组。大鼠清醒后灌胃(ig)给药,假手术、模型组ig给予蒸馏水10 mL/kg;归延组ig归延2.00 g/kg。每天1 次,每组分为6 h、24 h、48 h、3 d、10 d、30 d时相点。
1.4 脑组织含水量的测定 取1.3项下每组每时相点大鼠6只,分别麻醉,迅速断头取脑,称重,记录。将脑组织置于80℃烘箱内烘烤48 h,称其干重,记录,按EIIis公式计算含水量,脑含水量=湿质量-干质量/湿质量×100%进行计算。
1.5 TTC染色测定大鼠脑梗死面积及病理组织学标本制备 取1.3项下每组每时相点大鼠6只,分别麻醉,迅速断头取脑,以视交叉为中点,将其以冠状面切成2.5 mm的脑片,置于5 mL含有4%TTC及1 mol/L K2HPO40.1 mL溶液中,避光,37℃温浴40 min,正常脑组织为玫瑰红色,缺血区为白色,4%的多聚甲醛固定12 h,数码照相机拍照,Mias图像分析软件测定缺血面积比[Aa(%)](缺血面积/全脑面积);组织常规脱水,包埋,用于HE及凋亡染色。
1.6 凋亡细胞原位末端标记法(TUNEL) 每组每时相点取6张切片,采用末端脱氧核苷酸转移酶介导的带生物素dUTP切口末端标记技术检测凋亡细胞,以细胞核有明显棕黄色为阳性细胞,标记切片在油镜下定位,输入细胞图象分析系统,每张切片随机选取50个视野,计数凋亡细胞和非凋亡细胞并计算凋亡率(凋亡率=阳性细胞数/总细胞数)。
1.7 RT-PCR、Western Blot脑组织样品制备 取1.3项下每组每时相点大鼠4只,分别麻醉,经颈总动脉灌注冰冷生理盐水20 mL,迅速断头取脑,置冰盘上分离损伤侧皮层脑组织冠状面一分为二,置液氮中放置24 h,移置-80℃冰箱保存备用。
1.8 脑组织总RNA提取测定 取冻存脑皮层组织块,每组每时相点取4个,按试剂盒说明书操作提取总RNA,经测定A260/A280比值在1.8~2.0,取2 μg总RNA进行逆转录cDNA合成,以20 μL反转录产物作为PCR反应的模板。取上述总反应产物15 μL,行2.0%的琼脂糖凝胶电泳,80V电压电泳30~45 min,数字凝胶成像系统分析仪采集图像,薄层色谱扫描仪行条带扫描,测定PCR产物峰面积,用公式计算mRNA产物的含量。产物的含量=扩增产物条带的峰面积值/参照系统β-actin或GAPDH扩增产物条带的峰面积值。PCR引物设计及反应条件,见表1。
1.9 Western Blot检测脑组织蛋白的表达 取冻存的脑皮层组织,每组每时相点取4个,分别置于玻璃研磨器中加入1 mL组织裂解液,反复研磨使组织均匀地分散在裂解液中,置冰浴上裂解30 min,每隔10 min振摇一次。4℃ 12 000 r/min离心20 min,上清液即为组织蛋白提取液,BCA法定量,并调整各上样量 25 μg蛋白/泳道,经 10%SDS-PAGE 电泳,半干转膜、封闭,分别与一抗(1∶300)杂交,4℃孵育过夜,加入辣根过氧化物酶标记的二抗(1∶5 000)37℃孵育50~70 min,化学发光、压片,采用Gel-pro Analyzer(BioRad)软件计算目的蛋白表达的灰度值,以试验组目的条带灰度值/6 h模型组目的条带灰度值的比值为蛋白表达水平。
1.10 统计学处理 所得数据采用SPSS 10.0软件进行数据的统计处理,采用ANOVA分析,各组间比较采用t检验,试验结果以±s表示,以α=0.05为显著检验水准。

表1 定量RT-PCR引物合成序列Tab.1 Sequences of polymerase chain reaction primers and amplification conditions
2 结果
2.1 对CI/R时相点组织形态学的影响 光镜下假手术组皮层组织结构完整,神经细胞嗜色均匀,见图A1、A2、A3。模型组CI/R 6 h大鼠脑皮层损伤侧明显充血,血管周围间隙增宽,神经细胞体积缩小,与周围组织脱离,部分神经元呈梭形,神经纤维走向紊乱,间质轻度水肿,小胶质细胞激活,少量炎细胞浸润,见图B1;CI/R 24 h脑皮层损伤范围扩大,损伤中心区大量神经元细胞核固缩、偏位、胞浆呈空泡样变性,胶质细胞活化,小胶质细胞明显增生,间质水肿,少量炎细胞浸润,见图B2;CI/R 48 h脑皮层损伤侧间质重度水肿,炎细胞浸润明显增加,小胶质细胞肿胀,神经纤维断裂,细胞间隙明显增大,核深染,胞浆嗜酸性增多,见图B3;CI/R 3 d脑皮层损伤侧间质水肿明显减轻,小胶质细胞明显增生激活,炎细胞浸润明显增多,见图B4;CI/R 10 d脑皮层损伤侧坏死区呈结节状分布,小胶质细胞大量增生,炎细胞大量浸润,间质水肿明显减轻,坏死边缘区可见细胞核固缩明显,深染,胞浆嗜酸性增多,见图 B5;CI/R 30 d脑皮层损伤侧间质水肿消失,坏死组织脱落后留下软化区,在缺损边缘区组织开始修复,见图B6。与模型组CI/R各时相点比较,归延对CI/R各时相点脑皮层损伤侧组织有明显改善作用,对30 d的改善作用优为明显,见图C6。
2.2 对CI/R时相点大鼠脑梗死面积的影响 假手术组各时相点大鼠脑组织无梗死面积。与假手术组比较,模型组梗死面积在6 h已存在,24 h~3 d梗死面积基本一致,10 d有所降低。与模型组比较,归延各时相点脑梗死面积均显著降低(P<0.05),见图2。
2.3 对CI/R时相点大鼠脑组织含水量的影响与假手术组比较,模型组CI/R 24 h后大鼠脑含水量明显增加(P<0.05)。与模型组比较,归延组CI/R 6 h大鼠脑含水量显著升高(P<0.05),24 h与模型组一致,48 h后脑含水量明显降低(P<0.05),见图3。
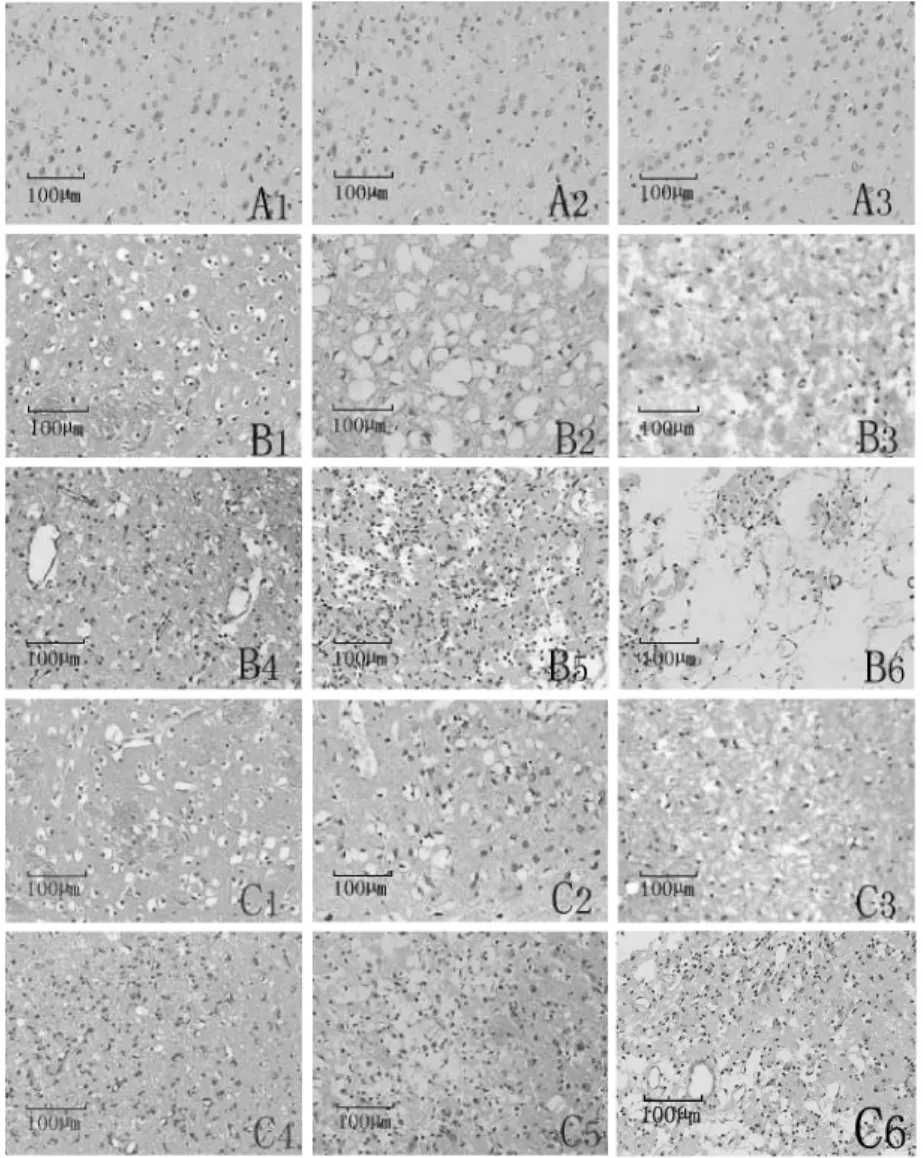
图1 归延对CI/R时相点脑皮层损伤病理组织学的影响Fig.1 Effects of Guiyan on the injury of pathologe histologe in cortex tissue of cerebral ischemia reperfusion at different times
2.4 对CI/R时相点大鼠神经细胞凋亡率的影响与假手术组比较,模型组各时相点细胞凋亡率显著增加,6 h~10 d呈上升趋势,10 d达峰值。与模型组比较,归延组48 h后均显著低于模型组(P<0.05),见图4。
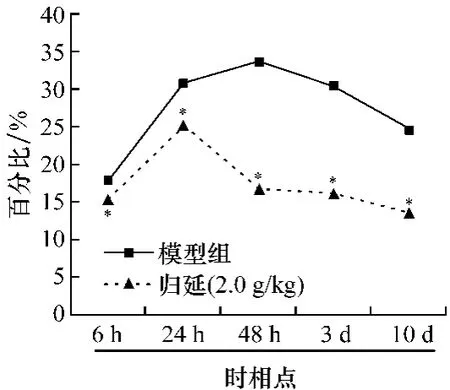
图2 归延对脑组织梗死面积的影响Fig.2 Effect of Guiyan on the infarct area in brain tissue(±s,n=6,与模型组比较*P <0.05)

图3 归延对脑组织含水量的影响Fig.3 Effect of Guiyan on the brain water content(±s,n=6,与模型组比较*P <0.05)

图4 归延对脑皮层组织神经细胞凋亡率的影响Fig.4 Effect of Guiyan on apoptosis rate of neural cell in brain cortex(±s,n=6,与模型组比较*P <0.05)
2.5 对CI/R时相点大鼠皮层凋亡信号通路mRNA表达的影响 与假手术组比较,模型组CI/R 24 h~ 30 d 脑皮层 Fas、FasL 、Bax、Bcl-2、Caspase-3、9 mRNA 表达明显上调(P< 0.05),Fas、FasL、Bax、BcL-2 3 d 达峰值;Caspase-3、9mRNA 表达在 24 h为最高值。与模型组比较,归延组Fas、Bax mRNA表达在3 d~30 d明显下调(P<0.05);FasL在各时相点均显著下调(P<0.05);BcL-2在6 h显著降低,30 d 明显上调(P<0.05);Caspase-3、9mRNA 表达各时相点均显著下调(P<0.05),见图5。
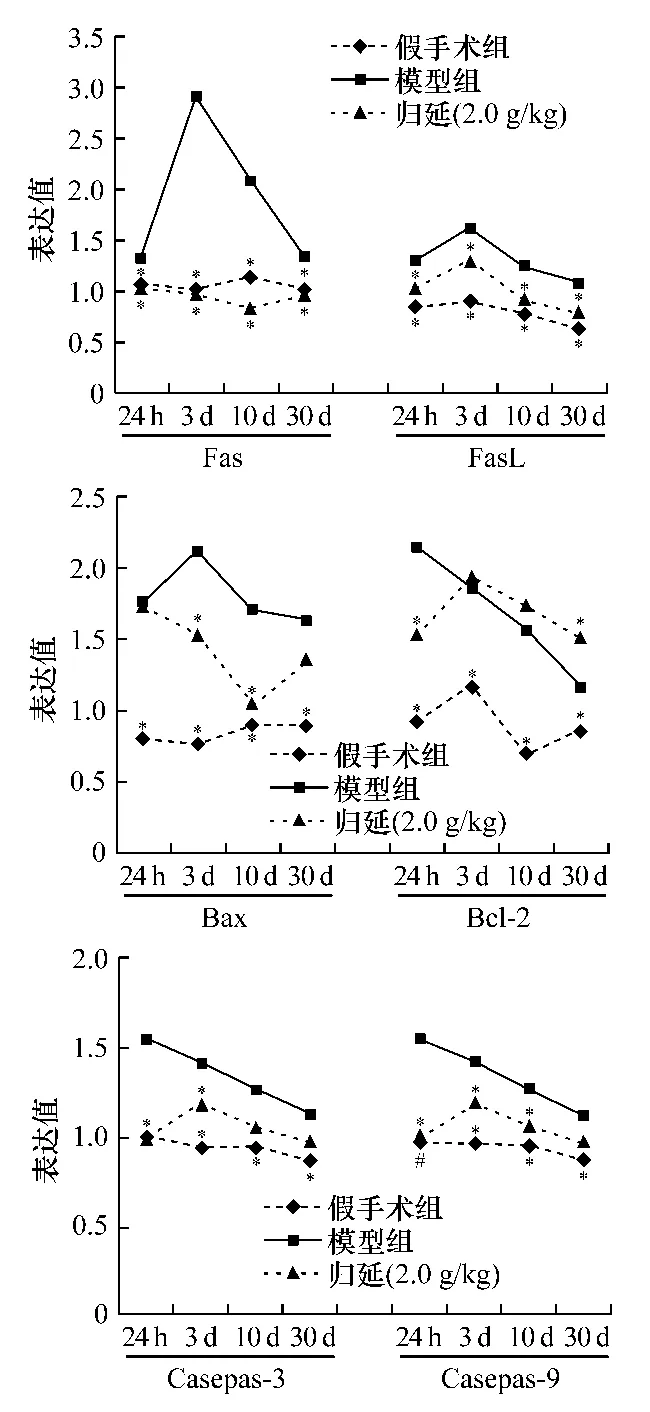
图5 归延对CI/R相点大鼠皮层Fas、Bax、Caspase mRNA表达的影响Fig.5 Effects of Guiyan on the expression of Fas,Bax,Caspase mRNA in cerebral ischemia reperfusion at different times rats(±s,n=4,与模型组比较*P <0.05)
2.6 对CI/R时相点大鼠皮层Fas、FasL蛋白表达的影响 与假手术组比较,模型组Fas蛋白表达趋势与假手术组一致,但各时相点表达水平均显著上调(P<0.05);FasL蛋白表达在时相点6 h、3 d、10 d显著上调(P<0.05),24 h与48 h降低。与模型组比较,归延组Fas蛋白表达在24 h后明显下降(P<0.05);FasL蛋白表达6 h、48 h明显增加(P<0.05),3 d、10 d 表达明显下降(P<0.05),见图 6(a、b、c)。
2.7 对CI/R时相点大鼠皮层Bax、Bcl-2蛋白表达的影响 与假手术组比较,模型组Bax各时相点表达显著升高(P<0.05),48 h为峰值;模型组 Bcl-2蛋白6 h表达显著上调(P<0.05),与模型组比较,归延组24 h后Bax表达显著下调(P<0.05)。Bcl-2 表达6 h、24 h明显上调(P<0.05),见图 7(a、b、c)。
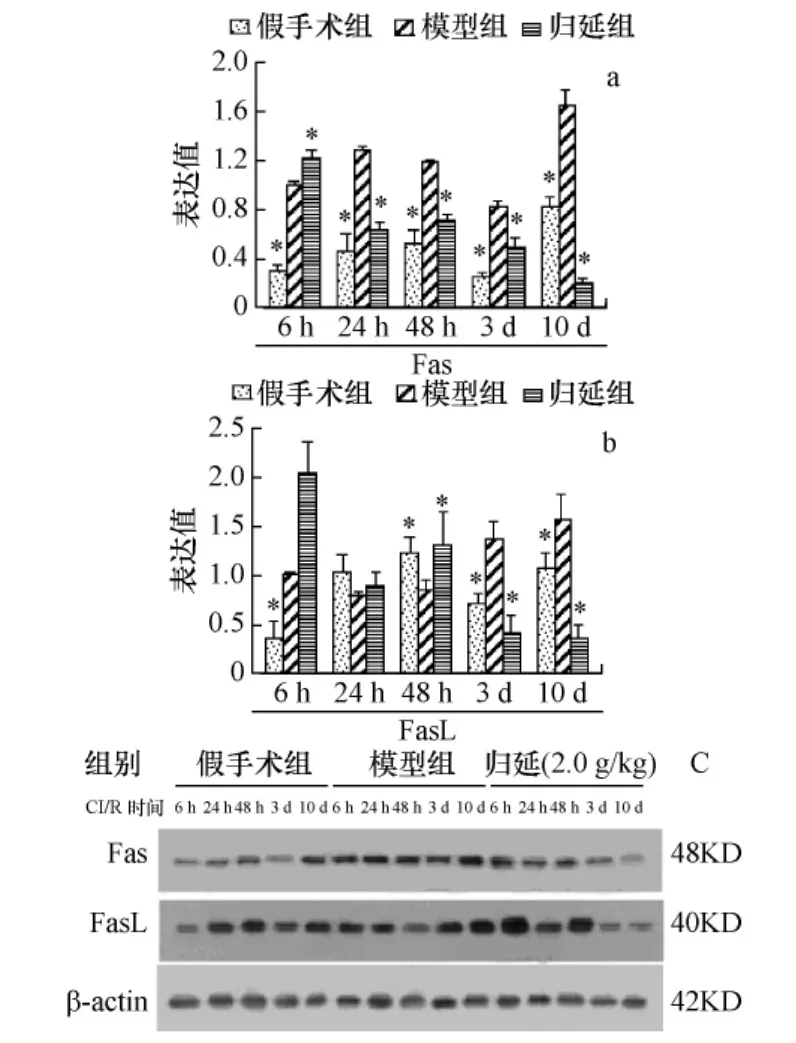
图6 归延对CI/R时相点大鼠脑皮层Fas、FasL蛋白表达的影响Fig.6 Effect of Guiyan on the expression of Fas,FasL protein in cerebral ischemia reperfusion at different times rats(±s,n=4,与模型组比较*P <0.05)

图7 归延对CI/R时相点大鼠皮层Bax、Bcl-2蛋白表达的影响Fig.7 Effect of Guiyan on the expression of Bax,Bcl-2 in cortex of cerebral ischemia reperfusion at different times rats(±s,n=4,与模型组比较*P <0.05)
2.8 对CI/R时相点大鼠皮层Caspase-3、9蛋白表达的影响 与假手术比较,模型组Caspase-3蛋白表达6 h~48 h表达显著高于假手术(P<0.05);Caspase-9表达 6 h显著增高,10 d显著降低(P<0.05),与模型组比较,归延组 Caspase-3 24 h、10 d表达显著下调(P<0.05)Caspase-9表达24 h、48 h显著降低,见表图 8(a、b、c)。
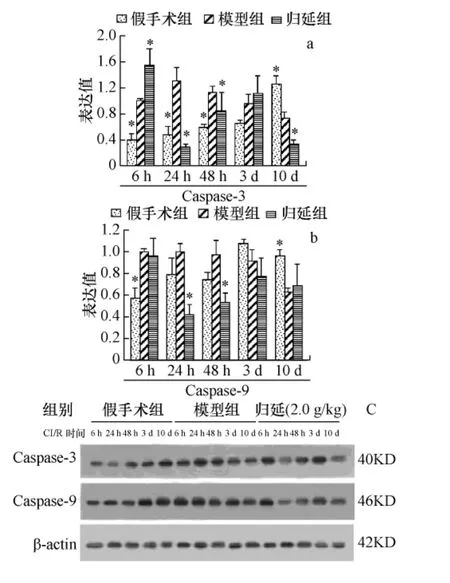
图8 归延对CI/R时相点大鼠脑皮层Caspase-3、9蛋白表达的影响Fig.8 Effect of Guiyan on the expression of Caspase-3,9 in cortex of cerebral ischemia reperfusion at different times rats(±s,n=4,与模型组比较 *P <0.05)
3 讨论
目前认为凋亡是迟发性脑死亡的主要形式,凋亡在CI/R损伤的发病机制中发挥着重要作用。本实验观察CI/R各时相点皮层神经细胞凋亡数显著增多,组织学观察显示在CI/R早期神经细胞核深染,胞浆嗜酸性增多和凋亡的表现形式TUNEL阳性细胞相平行,主要分布在椎体层、内颗粒层、内椎体层与多形层,CI/R损伤6 h~3 d脑皮层神经细胞凋亡数量并未随CI/R时相点而增加,提示抑制CI/R凋亡应愈早愈好。试验显示脑梗死面积与凋亡率变化不一致,与脑含水量趋势相似,提示脑梗死面积与神经细胞坏死和凋亡有关。CI/R各时相点病理组织学显示脑皮层组织损伤随着炎症级联反应和自由基过量而加重,最终因神经细胞坏死和凋亡形成软化区。归延组CI/R各时相点脑梗死面积降低,脑含水量下降,但CI/R 24 h无降低脑含水量作用。病理组织学显示归延明显减轻CI/R诱导脑组织损伤的程度,在皮层未见成片软化区,这与抑制脑皮层炎性反应和神经细胞凋亡有关。
细胞凋亡是一个十分复杂的过程,它需要蛋白合成与信号转导至核内,其过程是在多种相关基因的调控下进行的,具有复杂、多样性,应激不同、细胞不同、信号转导途径不同,这些信号通路之间相互作用,在体内构成一个复杂的信号网络。CI/R诱导神经细胞凋亡途径包括线粒体途径、死亡受体途径和内质网应激途径,这三种途径都通过激活Caspase家族成员,最终活化Caspase-3导致神经元降解死亡[7-9]。Fas是一种促凋亡外源性基因,在细胞凋亡过程中发挥着传导凋亡信号的作用,当细胞表面Fas过量表达时,可激活CTL细胞和神经胶质细胞过度表达其配体FasL,使两者结合并向细胞内传递信号,最终通过 Caspase-8及 Caspase-3的激活而诱导凋亡的发生[10-12]。RT-PCR 试验显示 CI/R 各时相点脑皮层损伤侧Fas、FasL mRNA表达明显增加,二者表达水平趋势一致,Fas mRNA表达水平高于FasL mRNA;Western Blod试验显示Fas蛋白表达与基因表达相似,脑组织FasL蛋白3 d后明显增加,表明CI/R激活缺血半影区神经细胞过量表达Fas mRNA,同时激活胶质细胞表达FasL mRNA,FasL结合Fas激活胞浆内Caspase级联反应促进神经细胞凋亡,试验重现了CI/R诱导死亡受体信号通路介导了再灌注皮层神经元凋亡,时间可持续数周。归延可降低 CI/R各时相点 Fas、FasL mRNA表达,FasL表达上调而Fas减少,两者结合减少受体凋亡信号通路被抑制,归延降低神经细胞凋亡的作用与减少Fas和FasL蛋白结合有关。
内源性基因Bax和Bcl-2 mRNA对局灶性CI/R后细胞凋亡起着重要调控作用[13-14]。Bax 是 Bcl-2蛋白家族中的凋亡因子,Bcl-2蛋白主要定位于线立体外膜,它可拮抗Bax的促凋亡作用。细胞一旦受到凋亡因子诱导,Bax可向线粒体转位,通过寡聚化在线立体外膜形成跨膜通道,或开启线立体PTP孔,线立体中细胞色素C释放并与脱氧腺苷三磷酸相互作用,与 Apaf-1结合激活下游的 Caspase-9酶原形成凋亡体。试验发现Bax蛋白表达水平与基因表达态势相似,Bcl-2蛋白表达与基因表达不一致,可能在蛋白翻译、合成过程存在下降,在CI/R时程内线粒体途径诱导神经细胞凋亡要早于Fas。归延组在CI/R早可增加Bcl-2拮抗Bax促神经细胞凋亡作用;Bax蛋白表达水平下降同时神经细胞凋亡率降低,提示归延降低CI/R诱导神经细胞凋亡是通过降低Bax蛋白表达而实现的。
Caspase酶原的活化途径主要包括死亡受体途径和线粒体/细胞色素C途径,Caspase-3、9为Fas/FasL和Bax共有的通路,是细胞凋亡执行阶段。归延降低了凋亡信号转导,使细胞凋亡率下降,试验还发现在CI/R时相点10 d凋亡率高出各时相点一倍,而 Bax/Bcl-2、Caspase-3、9 表达却下降,Fas、FasL表达明显增加,提示CI/R早期神经细胞凋亡的可能是通过线立体与死亡受体途径,中后期则是经由死亡受体途径。归延降低CI/R诱导脑皮层神经细胞凋亡的作用机制可能是通过调节Bcl-2/Bax、Fas/FasL和Caspase-3、9的活性而实现的。
[1]Danton G H,Dietrich W D.Inflammatory mechanisms after ischemia and stroke[J].Neuropathol Exp Neurol.2003,62(2):127-137.
[2]Borti R W,illiams A J,Moffett J R,et al.Quantitative real-time RTPCR analysis of inflammatory gene expression associated with ischemia-reperfusion brain injury[J].Cereb Blood Flow Metab,2002,22(9):1068-79.
[3]Endres M,Kaps M,Moskowitz MA.Apoptosis and ischemic infarct[J].Nervenarzt,1998,69(6):6459-6467.
[4]Li Y,Chopp M,Jiang N,et al.In situ detection of DNA fragmentation after focal cerebral ischemia in mice[J].Brain Res Mol Brain Res.1995,28(1):164-168.
[5]Gillardon F,Lenez C,Waschke K F,et al.Altered expression of bcl-2,Bcl-x,bax and c-fox colocalizes with DNA fragenttation and is chemic cell damage following middle cerebral artery occlusion in rats[J].Mol Brain Res,1996,40:254-261.
[6]Alessandrini A,Namura S,Moskowitz M A,et al.MEK1 protein kinase inhibition protects against damage resulting from focal cerebral ischemia[J].Proc Natl Acad Sci USA.1999,96(22):12866-12869.
[7]Li Y,Chopp M,Jiang N,et al.Temporal profile of in situ DNA fragmentation after transient middle cerebral artery occlusion in the rat[J].Cereb Blood Flow,1995,15(3):289-397.
[8]Jin K,Graham S H,Mao X,et al.Fas(CD95)may mediated delayed cell death in hippocampal CA1 sector after global cerebral ischemia[J].Cereb Blood Flow Metab,2001,21(12):1411-1421.
[9]Rosenbaum D M,Gupta G,D'Amore J,et al.Fas(CD95/APO1)play a role in the pathophysiology of focal cerebral ischemia[J].Neurosci Res,2000,61(6):686-692.
[10]Zou H,Li Y,Liu X,et al.APAF-1,cytochrome C multimeric complex is a functional apoptosame that activate procaspase-9 [J].Biol Chem,1999,274(17):11549-11556.
[11]Ashkenazi A,Dixit V M.Death receptors:signaling and modulation[J].Science,1998,281(5381):1305-1308.
[12]Rao RV,Hermel E,Castro-Obregon,et al.Coupling endoplasmic reticulum stress to the cell death program.Mechanism of caspase activation[J].Biol Chem,2001,276(36):33869-33874.
[13]Suhara T,Kim H S,Lorrie A,et al.Suppression of Akt signaling induces Fas ligand expression:involvement of caspase and Jun kinase activation in Akt-mediated Fas ligand regulation[J].Mol Cell Biol,2002,22:680-690.
[14]Martin-villaba A,Herr L,Jeremias L,et al.CD95 ligand(FasL/Apo-1L)and tumor necrosis factor-related apoptosis induced ligand mediate ischemia-induced apoptosis in neurons[J].Neurosci,1999,19(10):3809-3817.
