复肾颗粒对人肾小管上皮细胞TAK1表达的影响
2011-05-26刘明龙曾永祥卢守燕李建华刘天喜赵建雄
刘明龙, 曾永祥, 卢守燕, 李建华, 刘天喜, 赵建雄
(1.兰州大学第一医院肾病科,甘肃兰州 730000;2.甘肃省医疗器械检测中心,甘肃兰州 730000)
1 材料与方法
1.1 药品与试剂 复肾颗粒(兰州大学第一医院药剂科);优级胎牛血清(杭州四季青),F12/DMEM
(1∶1)培养液、Hepes、胰蛋白酶、Ⅳ型胶原酶(美国Gibco),人Ⅳ型胶原(ColⅣ)ELISA试剂盒(美国ADL),转化生长因子-β1(TGF-β1,美国 Sigma),Trizol(美国Invitrogen),兔抗大鼠TAK1多克隆抗体、鼠抗β-actin单克隆抗体(美国Cell Signaling),HRP标记羊抗兔、抗鼠IgG二抗(美国Santa Cruz),PVDF Western转印膜、ECL Plus化学发光试剂盒(美国Millipore),RIPA裂解液、脱脂奶粉(北京普利莱),PCR引物(上海生工)。
1.2 含药血清的制备 正常♂性Wistar大鼠给予复肾颗粒大、中、小剂量组分别是9 g/(kg·d)、4.5
g/(kg·d)、2.25 g/(kg·d)灌胃 7 d,制备含药血清,分别离体实验,对照组给予等体积生理盐水,于末次给药后1 h,心脏穿刺取血,3 000 r/min离心分离血清,56℃水浴30 min灭活,0.22 μm滤膜过滤除菌,-20℃冰箱保存备用。
1.3 细胞培养及分组 正常人近端肾小管上皮细胞系HK-2由兰州陆军总医院细胞实验室惠赠。细胞培养于含10%胎牛血清(FBS)的F12/DMEM(F/D 1∶1)培养液中,37℃ 5%CO2孵育,选取对数生长期的细胞进行实验,以105/mL接种于培养板和培养瓶,至细胞亚融合以无血清F/D孵育24 h使细胞同步化,进入静止期,然后加入不同浓度含药血清的10%胎牛血清F/D完全培养基培养。
1.4 检测指标
1.4.1 细胞增殖试验 细胞接种于96孔板,亚融合状态时同步后,弃细胞上清,多组加入不同浓度含药血清的培养液100 μL,对照组直接加入培养液100 μL。在各时间点分别加入含1 g/L MTT培养液100 μL孵育4 h,弃上清,加入 DMSO溶解,对照组直接加DMSO定零点值,充分震荡后,在酶标仪上用检测波长570 nm、参考波长630 nm作比色分析,测定吸光度值(A),实验重复3次。
1.4.2 ELISA法测定Col IV含量 各组细胞培养12、24、48 h,分别取培养上清液100 μL,加入酶标板孔内,按ELISA检测试剂盒说明书依次加入各种试剂,酶标仪492 nm处检测A值。
1.4.3 Western-bloting法检测细胞TAK1蛋白的表达 各组细胞培养12、24、48 h,弃上清,4℃预冷的PBS洗细胞3次,加入300 μL含有蛋白酶抑制剂的RIPA裂解液冰浴提取总蛋白,4℃ 12 000 g离心15 min,取上清BCA法测定总蛋白浓度。各组取50 μg总蛋白以10%SDS-PAGE 电泳90 min,0.8 mA/cm2条件半干电转移2 h至活化的PVDF膜上,5%脱脂奶粉室温封闭2 h,洗膜后加入一抗(TAK1、1∶500,β-actin、1 ∶1 000),摇床4 ℃过夜,再次洗膜用 HRP标记的二抗(1∶5 000)孵育2 h,暗室ECL化学发光准确显影,扫描图像,对照Marker确定特异性目的条带,以β-actin表达作为内参照,目的蛋白条带与内参条带的累积光密度(IOD)比值为最终结果[5]。
1.4.4 RT-PCR法检测细胞TAK1 mRNA的表达 Trizol提取HK-2细胞总RNA,用紫外分光光度法、吸光度260/280测定RNA纯度及浓度。TAK1 mRNA和β-actin mRNA用于RT-PCR扩增,两步法Real Time PCR反应在Rotor-Gene 3000荧光实时定量PCR仪(Corbett Research)上进行。利用反转录酶PrimeScriptTM Buffer将mRNA反转录合成cDNA,反应体积 20 μL:Buffer 4 μL,RT Enzyme Mix 1,Oligo dt Prime,Random 6 Primes 各 1 μL,总 RNA 13 μL,反应条件37℃ 15 min,85℃ 5 s;PCR扩增体系为 25 μL:SYBR Premix Ex Taq Ⅱ(2 × )12.5 μL,Forward primer,Reverse primer各0.25 μL,ddH2O 10 μL,含cDNA模板的 RT反应液2 μL,扩增条件:预变性95℃ 10 s,变性95℃ 5 s,退火、延伸60℃ 30 s,共40个循环。每个样本重复3次,利用系统分析软件,以β-actin为内参照,采用相对定量的2-△△CT法分析 PCR 结果[6]。

表1 RT-PCR引物序列及扩增片段
1.5 统计学方法 应用SPSS16.0软件,计量数据用±s表示。多组间数据比较采用单因素方差分析,其中两组间比较用t检验。
2 结果
2.1 HK-2细胞增殖情况 与对照组相比,TGF-β1 5 ng/mL能够显著诱导HK-2细胞增殖,并随着时间延长而增强(P<0.05,P<0.01),复肾颗粒干预后,
细胞增殖速度较同时间点TGF-β1组细胞减缓,其促细胞增殖作用受到显著抑制,尤以干预3组为甚(P<0.01)。见表2。
表2 不同时间MTT检测各组HK-2细胞增殖情况(A,± s,n=6)
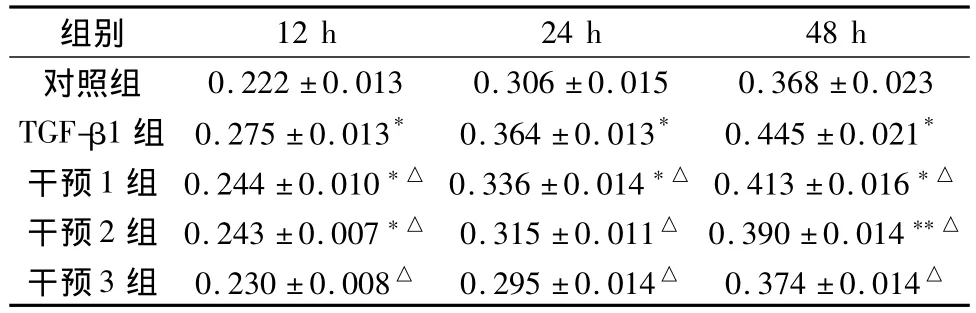
表2 不同时间MTT检测各组HK-2细胞增殖情况(A,± s,n=6)
注:与同时间点对照组比较,*P<0.01,**P<0.05;与同时间点 TGF-β1组比较,△P <0.01。
组别0.222±0.013 0.306±0.015 0.368±0.023 TGF-β1组 0.275±0.013* 0.364±0.013* 0.445±0.021*干预1组 0.244±0.010*△ 0.336±0.014*△ 0.413±0.016*△干预2组 0.243±0.007*△ 0.315±0.011△ 0.390±0.014**△干预3组 0.230±0.008△ 0.295±0.014△ 0.374±0.014 12 h 24 h 48 h对照组△
2.2 HK-2细胞培养上清中Col IV含量ELISA检测 随着培养时间的延长,各组细胞培养上清Col IV含量均有一定程度的增加,各时间点TGF-β1组细胞培养上清Col IV含量显著高于同时间点对照组,尤以24、48 h为甚(P<0.01);复肾颗粒干预后,Col IV含量显著低于同时间点 TGF-β1组(P<0.05,P<0.01)。见表3。
表3 不同时间各组HK-2细胞培养上清Col IV含量的比较(A,± s,n=8)

表3 不同时间各组HK-2细胞培养上清Col IV含量的比较(A,± s,n=8)
注:与同时间点对照组比较,*P<0.01,**P<0.05;与同时间点 TGF-β1组比较,△P <0.01,△△P <0.05。
组别12 h 24 h 48 h对照组0.333±0.013 0.363±0.015 0.379±0.023 TGF-β1组 0.366±0.013* 0.569±0.032* 0.837±0.0372*干预1组 0.350±0.009*△△ 0.484±0.015*△ 0.557±0.025*△干预2组 0.344±0.009**△ 0.415±0.015*△ 0.465±0.027*△△ △ △干预3组 0.340±0.0150.373±0.0120.409±0.021
2.3 各组细胞TAK1蛋白的表达 与同时间点对照组相比,HK-2细胞于TGF-β1诱导12 h时 TAK1蛋白表达开始上调,24 h和48 h时表达量进一步增加(P<0.01);与同时间点TGF-β1组相比,复肾颗粒各干预组TAK1蛋白表达均下降(P<0.01)。见表4。2.4 各组细胞TAK1 mRNA的表达 HK-2细胞于TGF-β1诱导12 h时TAK1 mRNA表达开始上调,且随着时间延长,表达逐渐增加,均显著高于同时间点对照组(P<0.05,P<0.01);复肾颗粒干预后,TAK1 mRNA表达显著低于同时间点TGF-β1组(P<0.01)。见表5。
表4 不同时间各组HK-2细胞TAK1蛋白的表达(TAK1/β-actin,± s,n=6)

表4 不同时间各组HK-2细胞TAK1蛋白的表达(TAK1/β-actin,± s,n=6)
注:与同时间点对照组比较,*P<0.01;与同时间点TGF-β1组比较,△P<0.01。
组别12 h 24 h 48 h 0.535±0.013 0.545±0.029 0.543±0.041 TGF-β1组 0.649±0.020* 1.338±0.130* 1.618±0.121*干预1组 0.605±0.016*△ 1.115±0.108*△ 1.357±0.094*△干预2组 0.583±0.015*△ 0.960±0.088*△ 1.057±0.135*△干预3组 0.543±0.017△ 0.832±0.070*△ 0.956±0.081对照组*△
表5 不同时间各组HK-2细胞TAK1 mRNA的表达(2-△△CT,± s,n=6)
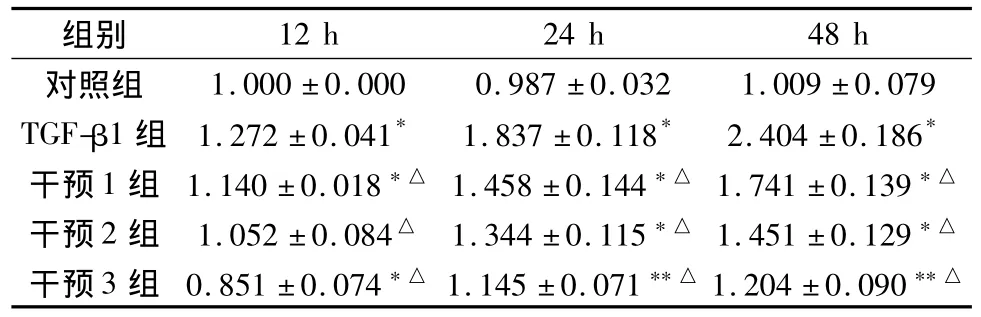
表5 不同时间各组HK-2细胞TAK1 mRNA的表达(2-△△CT,± s,n=6)
注:与同时间点对照组比较,*P<0.01,**P<0.05;与同时间点 TGF-β1组比较,△P <0.01。
组别1.000±0.000 0.987±0.032 1.009±0.079 TGF-β1组 1.272±0.041* 1.837±0.118* 2.404±0.186*干预1组 1.140±0.018*△ 1.458±0.144*△ 1.741±0.139*△干预2组 1.052±0.084△ 1.344±0.115*△ 1.451±0.129*△干预3组 0.851±0.074*△ 1.145±0.071**△ 1.204±0.090 12 h 24 h 48 h对照组**△
3 讨论
在各种慢性肾脏疾病中,肾小管上皮细胞不仅是疾病进展中的受损者,也是间质炎症、纤维化过程中的积极参与者,有研究表明,肾小管上皮细胞可通过表型转换生成肌成纤维细胞,也可过度增殖合成细胞外基质如Col IV,参与间质纤维化的形成[7]。近年研究表明,TGF-β1作为肾小管上皮细胞向成纤维细胞转分化的诱导因子之一[8-9]。TAK1 属于丝裂原活化蛋白激酶激酶激酶(MAPKKK)家族成员,是由TGF-β1参与转录调节而得名的,研究还表明,TAK1介导的信号转导通路参与了炎症反应、免疫反应、细胞凋亡和纤维化疾病等病理过程及细胞周期调节与细胞分化等过程[10-11]。
复肾颗粒是赵健雄教授研制的防治肾纤维化的验方,主要由生黄芪、丹参、川芎、大黄、鳖甲等药物组成。我们推测复肾颗粒可能通过改善慢性肾病的肾小管间质纤维化和肾小球硬化,而治疗慢性肾病。
本实验在体外用TGF-β1诱导HK-2细胞增殖,与对照组相比,TGF-β1组细胞增殖速度明显加快,细胞外培养上清Col IV含量明显增加,增殖过程中TAK1蛋白及mRNA表达上调,经不同剂量复肾颗粒血清药物干预后,细胞增殖速度和细胞外培养上清中Col IV含量均下降,TAK1表达下调,这表明复肾颗粒抑制了TGF-β1的诱导作用,从而使TAK1生成减少,进一步反映复肾颗粒可能影响TAK1这一重要的信号通路,从蛋白或基因水平上减少TAK1的生成而发挥抗纤维化作用。
[1]王 寅,童俊容,罗正茂,等.尿激酶对环孢素A慢性肾病大鼠肾间质纤维化及转化生长因子-β1的影响[J].南方医科大学学报,2009,29(12):2449-2452.
[2]白寿军,张亚敏,李彩霞,等.曲尼司特对TGF-β1刺激的人肾小管上皮细胞表达结缔组织生长因子的影响[J].华中科技大学学报,2009,38(4):477-480.
[3]宋锦叶,李 深,孟立强,等.黄芪当归合剂对5/6肾切除大鼠肾组织损伤的治疗作用[J].北京大学学报:医学版,2009,41(2):196-202.
[4]唐锦辉,占成业,周建华,等.影响丹参酮IIA对转化生长因子β1型Smads信号通路在肾间质成纤维细胞的影响[J].华中科技大学学报:医学版,2008,28(5):539-542.
[5]王琳娜,陶立坚,宁旺斌,等.依那普利对单侧输尿管梗阻大鼠肾间质纤维化的防治作用[J].中南大学学报:医学报,2008,33(9):841-848.
[6]于 力,郝志宏,王丽娜,等.IV型胶原和金属蛋白酶组织抑制剂-1在肾小球系膜细胞中的表达及福辛普利干预的意义[J].实用儿科临床杂志,2008,23(17):1330-1332.
[7]魏佳莉,王 畅,彭佑铭,等.黄芪对人肾小管上皮细胞细胞外基质分泌的影响及其机制探讨[J].中国中西医结合肾病杂志,2009,10(8):664-667.
[8]秦 岩,李学旺,文煜冰,等.罗格列酮对转化生长因子β1诱导的人肾小管上皮细胞结缔组织生长因子表达的影响[J].中华肾脏病杂志,2005,21(7):394-398.
[9]杨丽霞,任 彬,李 彧,等.姜黄素对 TGF-β1诱导人肾小管上皮细胞增殖的影响[J].北京中医药大学学报,2008,31(10):682-684.
[10]Shi Lijun,Zhang Zhengping,Fang Shuping,et al.Heat shock protein 90(Hsp90)regulates the stability of transforming growth factor beta-activated kinase 1(TAK1)in interleukin-1beta-induced cell signaling[J].Mollmmunol,2009,46(4):541-550.
[11]Shi-wen X,Parapuram SK,Pala D,et al.Requirement of transforming growth factor beta-activated kinase 1 for transforming growth factor beta-induced alpha-smooth muscle actin expression and extracellular matrix contraction in fibroblasts[J].Arthritis Rheum,2009,60(1):234-241.
