高效液相色谱法测定脊柱结核化疗后组织内利福平和去乙酰利福平的浓度
2011-05-25刘鹏江建明
刘鹏,江建明
(南方医科大学南方医院脊柱骨病外科,广州 510515)
抗结核药物不易渗入骨病灶[1,2],而在抗结核药物治疗的基础上实施手术清除病灶,有利于抗结核药物渗入病灶,可缩短疗程,提高治愈率。因此,在明确病灶切除范围、彻底清除病灶的前提下,最大限度减少手术创伤,是脊柱结核外科治疗的关键问题。利福平(rifampicin,RFP)是一线抗结核药物,国内外对RFP的血药浓度及原药检测已有报道[3,4]。本文利用高效液相色谱法(high performance liquid chromatography,HPLC)建立了测定患者病椎、血浆及正常骨组织中RFP及其代谢产物去乙酰利福平(25-desacetylrifampicin,De-RFP)的方法,并对不同节段亚健康骨中的原药及代谢产物进行了检测,以期为脊柱结核手术方法的改进及化疗方案的制定提供理论依据。
1 材料与方法
1.1 研究对象
1.1.1 最小样本量的估计:多样本均数的比较:
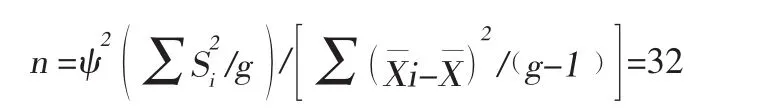
1.1.2 研究对象:选取我科2008年1月至12月期间应用2SHRZ/6H2R2Z2短程化疗方案(共8个月)[5](烟肼 0.3、RFP 0.45、链霉素 0.75、吡嗪酰胺 1.5)结合手术治疗的初治脊柱结核患者36例。男15例,女21例;年龄23~75岁,平均47岁;发病部位:颈椎2例,胸椎5例,胸腰椎10例,腰椎16例,腰骶椎3例。36例患者均具备手术指征,肝、肾功能均正常,入院抗结核治疗4周后行手术治疗。术前行CT了解病椎情况,其中23例病椎无硬化骨,归入非硬化骨组,13例含有病椎硬化骨,归入硬化骨组。
1.2 方法
1.2.1 样品的采集:术晨统一空腹服药并记录时间,术中取患者血液、病灶(包括死骨、干酪样坏死及脓液)、“亚健康骨”(病灶周围肉眼观察正常的骨组织)及髂骨。临床病理学研究证实,病灶周围4 mm范围内的亚健康骨中仍然存在微小病灶[6],故亚健康骨按病灶边缘4mm范围内(A段亚健康骨)、外(B段亚健康骨)取材。每次取样时间严格控制在服药后2 h以内,以保证各药血药浓度达到峰值,提高检出率。
1.2.2 样品预处理:静脉血5 mL置于肝素抗凝玻璃试管(每管加VC 1 mg抗氧化),4 000 r/min离心15 min得血浆,再转入eppendorf管,置于-70℃待测。病椎及髂骨用滤纸拭血后称质量(均>0.5 g),置液氮冷冻后,迅速取出研磨成粉,置于-50℃避光冷冻干燥,再称质量并计算组织样本的干湿质量比。分析天平精确称取200μg,加入甲醇提取液2 mL,涡旋10 min后离心,取上清液制成骨组织提取液,取1 mL放入eppendorf管中留待测定其中的血红蛋白(hemoglobin,Hb)含量。空白对照血浆为南方医科大学南方医院血库提供的近期健康人血浆,-40℃冷冻保存;空白对照骨取自非结核的脊柱骨折患者前路手术切取的椎体骨,与样本骨同法制备成空白对照骨组织匀浆。
1.2.3 实验部分:(1)色谱条件:色谱柱为分析柱shim-pack HRC-C8(250 mm×4.6 mm,5μm),保护柱Eclipse XDB-C18(125 mm×4.6 mm);流动相为 0.02 mol/L,庚烷磺酸钠溶液(pH 3.0)-乙腈-甲醇=20∶5∶75,流速为 0.8 mL/min,测试波长 254 nm。(2)试剂与仪器:RFP、VC(标准品由广州市药检所提供),De-RFP参照文献[7]进行配制,甲醇(色谱纯,美国Sigma公司),高效液相色谱仪(LC2010C,日本岛津公司),Lc-solution型色谱工作站。(3)建立标准曲线:将空白血浆(图1)加入标准品溶液稀释成含RFP 及 DE-RFP 分 别 为 0.1、0.2、0.4、1、2、4、8、16 μg/mL的标准血浆(图2),以2种药物的峰面积为X轴,3种药物的浓度为Y轴做线性分析。得2药回归方程:YRFP=3 007.2X+3 714.58,YDe-RFP=2 736.6X+3 380.27。(4)样本测试:将血浆200μL加入甲醇1 mL沉淀蛋白后离心取上清液,氮气吹干后甲醇定标到200μL,骨组织提取液则直接取200μL,氮气吹干后甲醇定标到200μL,进样体积为20μL。得色谱图(图3)后按照峰面积所得值代入标准曲线回归方程,求得血浆及骨匀浆中的药物浓度。再根据稀释比(1∶1 0)、组织的干湿质量比,换算得出髂骨与病椎中药物的浓度,再由所测的Hb含量(国际血液病学会推荐的HICN法[8])经校正公式计算求得各组分的校正组织浓度。组织样本中归因血污染的药物浓度由以下公式计算[9]:归因血污染的药物浓度[K为组织稀释因子,S为血浆药物浓度(μg/mL),Ht为血细胞比容(%)]。
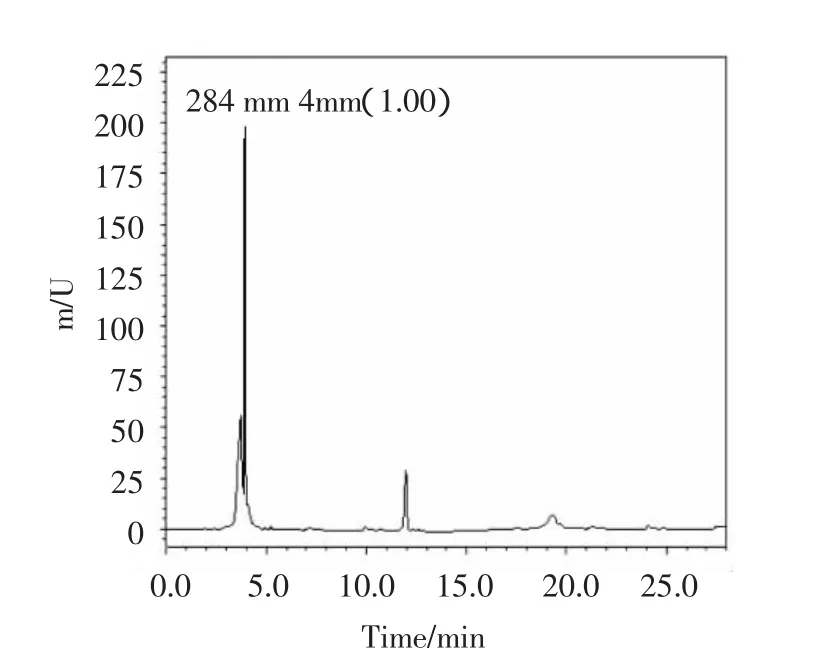
图1 空白血浆进样后色谱Fig.1 Chromatogram of blank plasma after injection
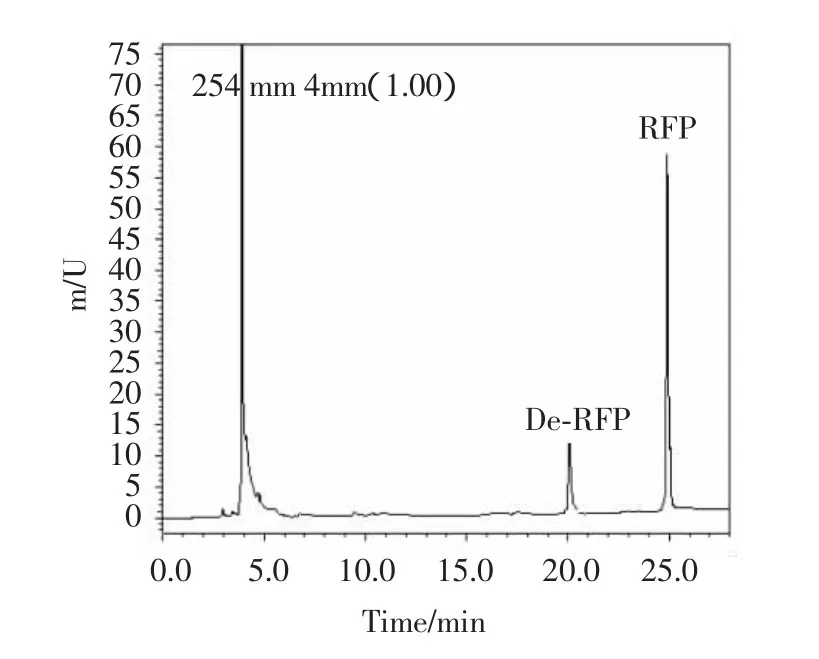
图2 空白血浆添加RFP、De-RFP后进样色谱图Fig.2 Chromatogram of plasma with RFP and De-RFP after injection
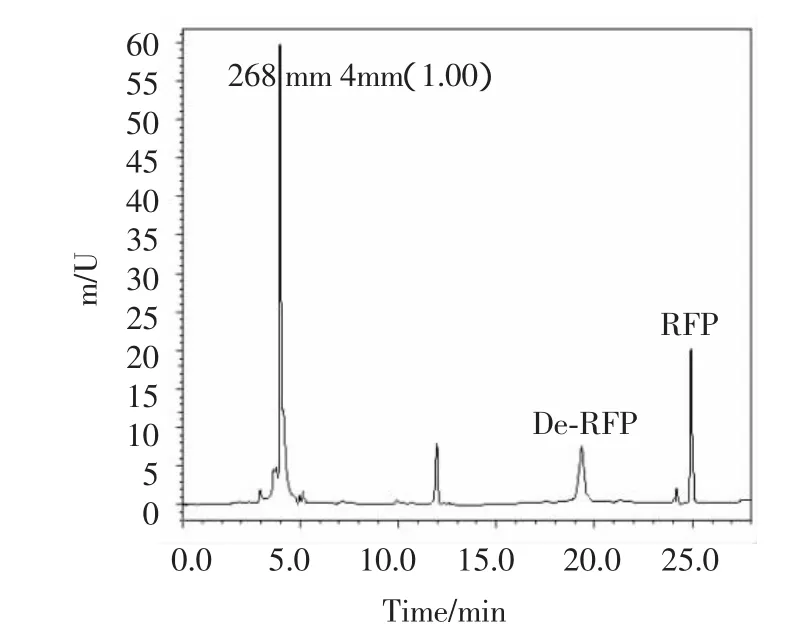
图3 组织样本进样后色谱图Fig.3 Chromatogram of tissue sample after injection
1.3 统计学分析
采用SPSS13.0统计学软件,各组实验数据以x±s表示,多样本均数比较采用LSD-t检验,检验水准 α=0.05。
2 结果
2.1 血浆样本测试结果
RFP和De-RFP血药浓度与文献报道健康人单次服药的药时数据相近,36例血液样本测试结果为:RFPmax=7.77 mg/L、RFPmin=2.70 mg/L、RFPmean=5.13 mg/L;De-RFPmax=7.84 mg/L、De-RFPmin=5.79 mg/L、De-RFPmean=3.74 mg/L。血浆中RFP原药及代谢产物De-RFP浓度高于髂骨、“亚健康骨”及病椎组织中的药物浓度,差异有统计学意义(P<0.01)。
2.2 硬化骨测试结果
含有硬化骨的13例病灶中(包括死骨、干酪样坏死及脓液)未能测出药物浓度,A段亚健康骨药物浓度比B段亚健康骨低,比髂骨中药物浓度低,差异有统计学意义(P<0.01);B段亚健康骨药物浓度与髂骨接近,差异无统计学意义,见表1。

表1 服药后2 h硬化骨组抗结核药物浓度检测结果(x±s)Tab.1 Concentration of antituberculosis drugs in sclerotic group 2 hours after medication(x±s)
2.3 非硬化骨测试结果
23例非硬化骨的病例病灶中(包括死骨、干酪样坏死及脓液)药物浓度明显低于A、B 2段亚健康骨,差异有统计学意义(P<0.01),而 A、B 2段亚健康骨与髂骨之间药物浓度无统计学差异,见表2。
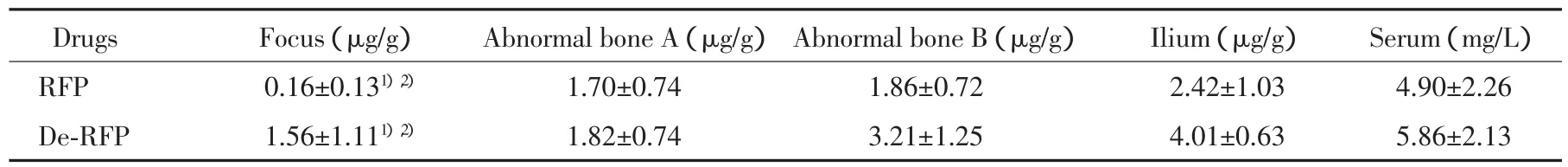
表2 服药后2 h非硬化骨组抗结核药物浓度检测结果(x±s)Tab.2 Concentration of antituberculosis drugs in non-sclerotic group 2 hours after medication(x±s)
2.4 临床治疗结果
全部患者采用2SHRZ/6H2R2Z2(共8个月)方案化疗结合结核病椎部分切除、植骨、内固定治疗。术中结核病椎切除范围包括全部的硬化壁及其空洞内的肉芽、坏死干酪样组织及距病灶边缘4 mm以内“亚健康骨”。随访8~20个月,36例患者术后3个月内结核病全身症状消失,血沉(erythrocyte sedimentation rate,ESR)、C 反应蛋白(C-reactive protein,CRP)转为正常或基本正常,平均植骨界面融合时间5个月,随访1.5年后,除1例因术后3个月内自行停药复发以外,其余无复发。
3 讨论
利福平仍是当今一线抗结核药物,目前已知RFP的体外最低抑菌浓度(MIC)为0.025~0.05 μg/mL[10],公认的有效杀菌浓度应为试管内MIC的10倍以上[11]。RFP口服吸收可达 90%~95%,于 1~2 h血药浓度达峰值,易渗入机体组织、体液(包括脑脊液)中,有效浓度可维持约6 h。RFP在肝脏中可在自身诱导微粒体氧化酶的作用下迅速去乙酰化,成为具有抗菌活性的代谢产物De-RFP。t1/2为2~5 h,服药后1.5~4 h血药浓度达峰值。以往已有采用液相色谱法检测血液及骨骼中RFP的报道[12],而本研究采用HPLC法建立了可检测患者病椎各部位、血浆、正常骨组织及不同节段的亚健康骨中RFP原药及其代谢产物De-RFP的方法。13例硬化骨病灶中未能检测出药物浓度,B段亚健康骨中RFP药物浓度达到MIC的10倍以上(即达到有效杀菌浓度水平),与自身对照的髂骨浓度相当;而A段亚健康骨中的RFP药物浓度却在MIC的10倍以下。23例非硬化骨的病灶中药物浓度均在MIC的10倍以下,A、B 2段亚健康骨中RFP的药物浓度均达到MIC的10倍以上。结果提示,硬化骨可能起阻隔药物渗透的屏障作用,外围健康椎体骨组织中高浓度的RFP及其代谢产物De-RFP难以穿越此层结构渗透到病灶当中,而距硬化骨较近的A段亚健康骨中的药物浓度仍较低,较远的B段亚健康骨中的药物浓度相对较高。
目前我国结核病人数居世界第2位,耐药率从20世纪90年代渐呈上升趋势,并有难治的耐多药(MDR-TB)出现[13,14]。据文献报道,获得性耐多药占79.4%,其中又以医源性不规则用药史者为多[15]。化疗配合脊柱结核病灶清除术治疗不仅直接清除了坏死的病灶,还打通了阻碍血液运载药物进入病灶的板障,提高了病灶局部的血药浓度。及时检测患者化疗后的血液及骨骼中的药物浓度,不仅是化疗本身的重要参考,也是清除病灶的依据。本研究所建立的HPLC检测方法有助于明确术中亚健康骨切除的范围,为脊柱结核病灶清除术治疗提供定量依据。本方法不仅可检测RFP原药血药浓度,还可检测其代谢产物De-RFP的浓度,检测这种具有杀菌活性和肝脏毒性的物质对结核化疗患者的药物浓度监测及安全用药有一定的临床意义。本研究结果表明,包裹在硬化壁内的病灶难以达到有效的药物浓度,手术应彻底清除包括死骨、肉芽、坏死、干酪样组织的病灶;邻近的亚健康骨内药物浓度亦相对较低,这一部分亚健康骨也应予以清除;而对无硬化骨的病例手术清除病灶时直达亚健康骨,亦可取得良好的疗效。
[1]Tuli SM,Kumar K,Sen PC.Penetration of antitubercular drugs in clinical osteoarticular tubercular lesions [J].Acta Orthop Scand,1977,48(4):362-368.
[2]Kumar K.The penetration of drugs into the lesionsof spinal tuberculosis[J].Int Orthop,1992,16(1):67-68.
[3]He X,Wang J,Liu X,et al.High-performance liquid chromatography assay of rifapentine in human serum [J].Chromatographia,1996,681(2):412-415.
[4]Panchagnula R,Sood A,Sharda N,et al.Determination of rifampicin and its main metabolite in plasma and urine in presence of pyrazinamide and isoniazid by HPLCmethod [J].JPharm Biomed Anal,1999,18(6):1013-1020.
[5]马远征.脊柱结核的治疗应遵循个体化综合治疗原则[J].中华外科杂志,2007,45(18):1227-1229.
[6]Zhang G,Wu Q,Guan Y,et al.Spinal tuberculosis [M].Beijing:People′s Military Medical Press,2007:266-267.
[7]Maggi N,Vigevani A,Pallanza R.Desacetyl-rifamycins:preparation and antibacterial properties[J].Experientia,1968,24(3):209-211.
[8]Van Assendelft OW,Zijlstra WG,Buursma A,et al.Theuseof atomic absorption spectrophotometry for the measurement of haemoglobiniron,with special reference to the determination of epsilon(540)(HiCN)[J].Clin Chim Acta,1968,22(2):281-289.
[9]Roncoroni AJ,Manuel C,Nedjar C,et al.Cefamandolebonediffusion in patients undergoing total hip replacement [J].Chemotherapy,1981,27(3):166-172.
[10]谢惠安,阳国太,林善梓,等.现代结核病学[M].北京:人民卫生出版社,2000:510-527.
[11]徐叔云.中华临床药理学[M].北京:人民卫生出版社,2003:384-399.
[12]戈朝晖,王自立,魏敏吉.利福平在脊柱结核患者不同组织分布的实验研究[J].中国脊柱脊髓杂志,2004,14(12):741-744.
[13]Mukherjee JS,Rich ML,Socci AR,et al.Programmesand principles in treatment of multidrug-resistant tuberculosis [J].Lancet,2004,363(9407):474-481.
[14]全国结核病流行病学抽样调查技术指导组.2000年全国结核病流行病学抽样调查报告[J].中国防痨杂志,2002,24(2):65-108.
[15]Yagui M,Perales MT,Asencios L,et al.Timely diagnosis of MDRTB under program conditions:is rapid drug susceptibility testing sufficient?[J].Int JTuberc Lung Dis,2006,10(8):838-843.
