外源性硫化氢对嗜铬细胞瘤细胞β位淀粉样前体蛋白裂解酶1表达的影响
2011-05-25代政伟张华孟涛晏宁李洁颖晏勇
代政伟,张华,孟涛,晏宁,李洁颖,晏勇
(重庆医科大学1.附属第一医院神经内科,重庆市神经病学重点实验室,重庆 400016;2.附属第二医院神经内科,重庆400010)
β位淀粉样前体蛋白裂解酶1(β-site amyloid precursor protein cleaving enzyme 1,BACE1) 是淀粉样前体蛋白(amyloid precursor protein,APP)产生 β淀粉样蛋白(β-amyloid,Aβ)的限速酶[1],其活性或表达增加是阿尔茨海默病(Alzheimer’sdisease,AD)发病的中心环节,因此对BACE1的调节干预成为AD治疗研究领域的热点问题。近来发现,生理浓度下的硫化氢(hydrogen sulfide,H2S)能够激活包括磷脂酰肌醇3-激酶/丝氨酸苏氨酸蛋白激酶(phosphatidylinositol-3 kinase/serine threonine kinase,PI3-K/Akt)及丝裂酶原活化蛋白激酶/细胞外信号调节激酶 1/2(mitogen-activated protein kinase/extracellular singal-regulated kinase 1/2,MAPK/ERK1/2) 在内的多种信号通路,发挥广泛的调节功能[2],而AD患者脑及血浆中内源性H2S含量明显降低[3],且降低的水平与患者病情严重程度呈正相关[4],表明H2S减少与AD发病有着密切的关联。但是,H2S与BACE1的关系目前尚未见报道。因此,本文旨在探讨外源性H2S对BACE1表达的影响及可能涉及的细胞信号机制。
1 材料与方法
1.1 细胞和试剂
大鼠肾上腺髓质嗜铬细胞瘤(PC12)细胞株由重庆医科大学重庆市神经病学重点实验室提供;RPMI 1640培养基、胎牛血清、NGF(GIBCO公司);NaHS(Sigma公司);RT-PCR试剂盒[宝生物(大连)有限公司];BACE1抗体(Merck公司);小鼠抗Akt1、兔抗大鼠Ser473位点磷酸化Akt1/2/3(pAkt1/2/3)、ERK1/2、Thr202 位点磷酸化 ERK1/2(pERK1/2)抗体(Santa Cruz公司);PI3-K 抑制剂 LY294002、MEK抑制剂PD98059(Cayman Chemical公司);大鼠Aβ42酶联免疫吸附测定试剂盒(武汉优尔生科技有限公司)。
1.2 细胞培养及处理
PC12细胞株接种于6孔细胞培养板,RPMI 1640完全培养基(含10%的胎牛血清,100 IU/mL青霉素和100μg/mL链霉素)在37℃、5%CO2的培养箱中培养,传代24 h后换液,加入终浓度为50 ng/mL的NGF,诱导其向神经元样PC12细胞分化,3周左右至完全,取对数生长期细胞用于实验。将细胞随机分为空白对照组、NaHS 组 (NaHS 50、100、200 μmol/L组)、LY294002预处理组(LY 25μmol/L+NaHS 200 μmol/L、LY 50 μmol/L+NaHS 200 μmol/L组)和PD98059预处理组(PD 25μmol/L+NaHS 200 μmol/L、PD 50μmol/L+NaHS200μmol/L组)。处理时吸弃旧培养基,洗涤后加入不含胎牛血清的新鲜培养基,并分别加入终浓度为分组剂量浓度的NaHS或通路抑制剂,预处理组抑制剂先于NaHS30 min加入。处理完成的各组细胞在相同培养箱中继续孵育24 h后,分别收获细胞及培养液用于指标检测,完全重复实验3次。
1.3 RT-PCR检测BACE1 mRNA的表达
按试剂说明书操作步骤抽提RNA,逆转录cDNA。Primer Premier 5.0软件设计 BACE1及 β-actin引物,由上海生工科技公司合成。BACE1上游引物:5′TTTCCCAGTCATTTCACTTTAC 3′, 下 游 引 物 :5′GCCGTCCTGAACTCATCG 3′。β-actin 上游引物:5′CCACTGCCGCATCCTCTT 3′,下游引物:5′GGACTCATCGTACTCCTGCT 3′。BACE1 PCR反应条件:94 ℃,5 min;94 ℃,30 s;54 ℃,30 s;72 ℃,1 min,35个循环;72℃,10 min。BACE1与β-actin终产物片段长度分别为267 bp和413 bp,行1.5%琼脂糖凝胶电泳,Bio-Rad凝胶成像系统扫描图像,光密度分析,计算BACE1/β-actin光密度比值为目的基因的相对表达水平。
1.4 Western blot检测 BACE1、pAkt、pERK1/2 蛋白的表达
PBS洗涤细胞2次,加入全蛋白提取液及PMSF缓冲液,冰浴裂解细胞,提取蛋白,BCA法定量。取样品25μg行SDS-PAGE电泳,将凝胶中蛋白湿法电转移至PVDF膜,5%脱脂奶粉TBST液封闭。分别加入兔多抗 BACE1(1∶250)、pAkt1/2/3(1∶500)、ERK1/2(1∶250)、pERK1/2(1∶300)抗体和小鼠抗 Akt1(1∶250)、β-actin 单抗(1∶200),4 ℃孵育过夜,洗涤后孵育二抗(羊抗兔和羊抗小鼠抗体1∶2 000)。ECL试剂发光显影成像,X线片拍照保存。光片置于凝胶成像系统白光下扫描,蛋白的相对表达 水 平 分 别 用 BACE1/β-actin、pAkt1/Akt1 和(pERK1/2)/(ERK1/2)的光密度比值来表示。
1.5 ELISA法检测细胞培养液中Aβ42水平的变化
离心并取细胞培养液上清。室温下配制标准品、检测溶液、洗涤液、TMB底物溶液以及反应终止液。设标准孔、待测样品孔和空白孔,按试剂盒说明书操作步骤加液、甩干、洗涤及孵育。TMB底物溶液,37℃避光显色。适时终止反应。酶标仪450 nm波长测量光密度值,以标准品浓度与光密度对数值为坐标绘制标准曲线,计算蛋白表达水平。
1.6 统计学分析
采用SPSS13.0软件包进行统计学处理。计量数据以x±s表示,各组均数间比较采用单因素方差分析,两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 不同浓度的外源性H2S对BACE1表达的影响(图 1)
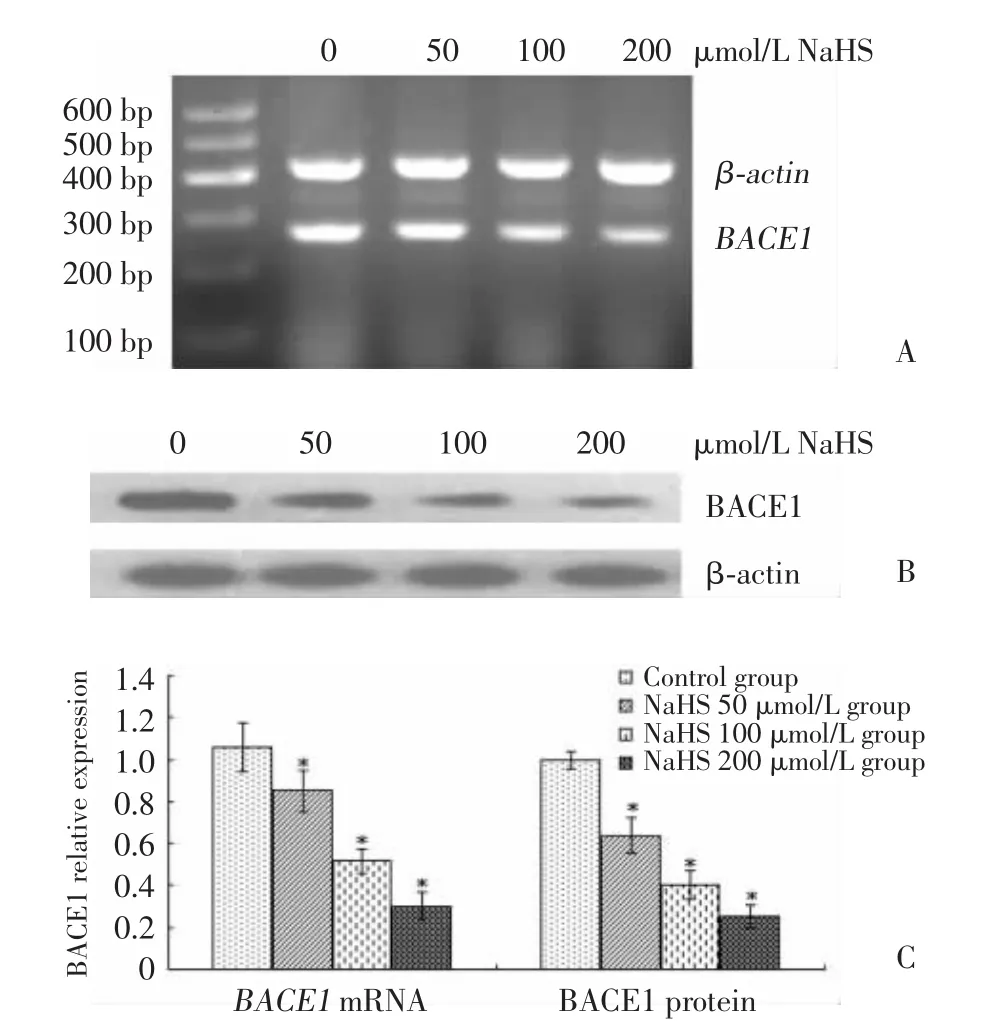
图1 不同浓度NaHS对BACE1 mRNA及蛋白表达的影响Fig.1 Effects of different concentrations of NaHS on the expressions of BACE1 mRNA and protein
RT-PCR结果显示,对照组内有自发的BACE1 mRNA表达(1.059±0.114),各NaHS组其表达随NaHS浓度增加而减少[分别为(0.850±0.096)、(0.517±0.060)和(0.303±0.065)],组间比较差异有统计学意义(F=45.523,P=0.000),且各 NaHS 组分别与对照组比较差异也有统计学意义(分别为t=2.947,P=0.019;t=7.669,P=0.000;t=10.689,P=0.000);Western blot结果与PCR相似,自对照组至各NaHS组蛋白表达依次下调[分别为(0.999±0.041)、(0.638±0.085)、(0.404±0.071)、(0.251±0.054)],差异有统计学意义(F=75.446,P=0.000),各 NaHS 组与对照组比较差异有统计学意义(分别t=6.820、11.235、14.109,均 P=0.000)。
2.2 LY294002对外源性H2S诱导的PI3-K/Akt通路下游蛋白Akt1磷酸化的影响及BACE1表达变化的调节(图2)
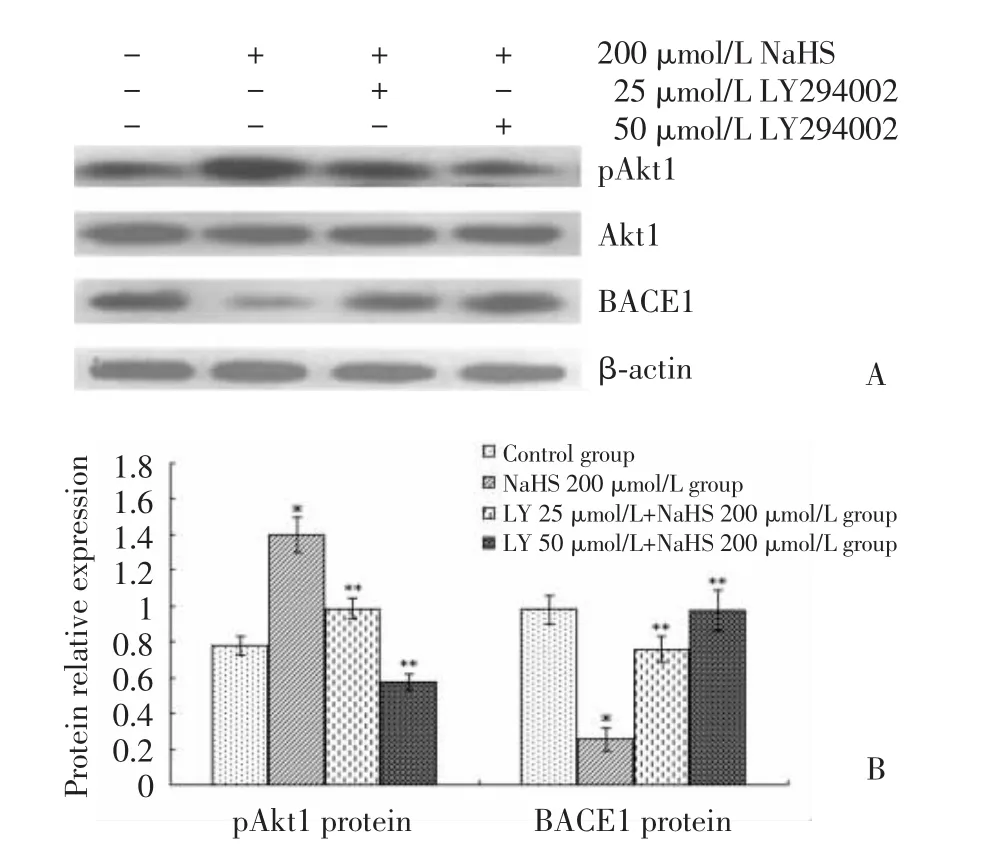
图2 pAkt1蛋白在各细胞组中的表达及LY294002对NaHS诱导的BACE1表达变化的影响Fig.2 Expression of pAkt1 protein in different groups and the effect of LY294002 on the change in BACE1 expression induced by NaHS
Western blot结果显示,NaHS 200μmol/L组pAkt1蛋白表达上调(1.398±0.100),较对照组(0.780±0.053)有统计学差异(t=11.267,P=0.000);与NaHS 200μmol/L组相比,LY294002预处理组NaHS诱导的Akt1磷酸化被不同程度抑制,pAkt1表达随抑制剂浓度增加而降低[分别为(0.986±0.565)和(0.571±0.045)],差异有统计学意义(F=100.845,P=0.000;t=7.074,P=0.000;t=14.202,P=0.000);而 200 μmol/L NaHS下调BACE1的作用被削弱,BACE1蛋白表达[分别为(0.759±0.070)和(0.976±0.113)]较 NaHS 200μmol/L 组(0.257±0.064)上调,差异有统计学意义(F=56.277,P=0.000;t=7.214,P=0.000;t=10.344,P=0.000)。
2.3 PD98059对外源性H2S诱导的MAPK/ERK1/2通路下游蛋白ERK1/2磷酸化的影响及BACE1表达变化的调节(图3)
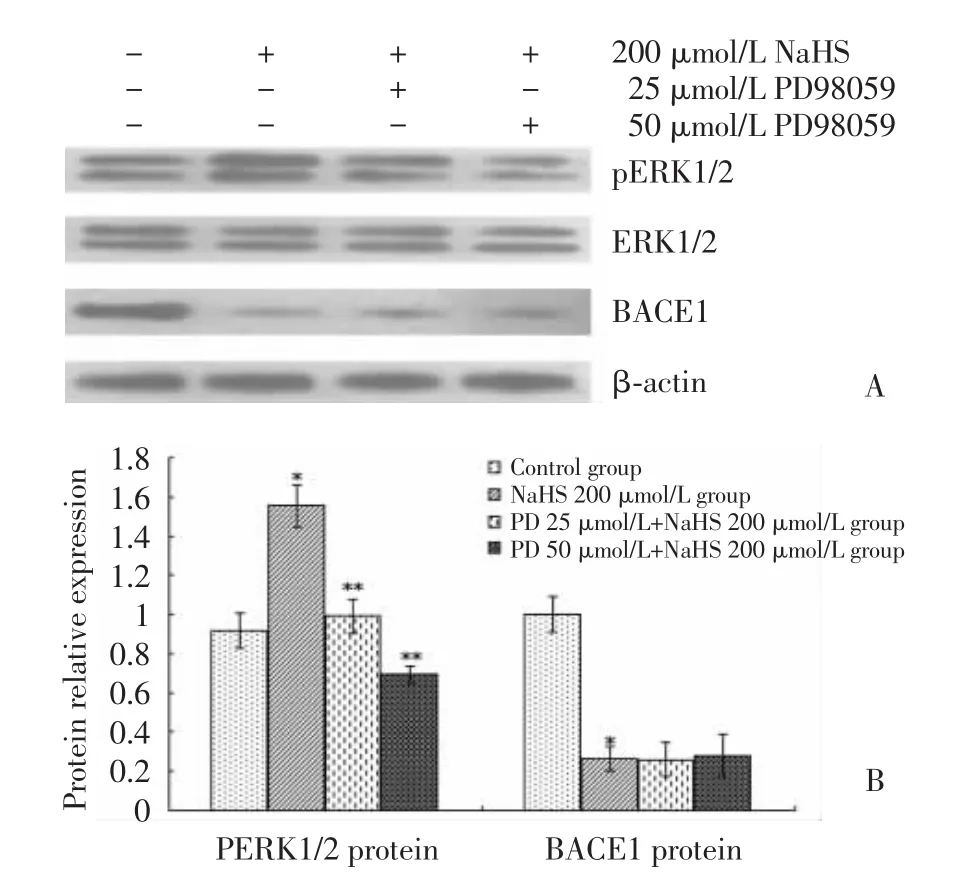
图3 Western blot法检测pERK1/2蛋白在各细胞组中的表达及PD98059对NaHS诱导的BACE1表达变化的影响Fig.3 Expression of pERK1/2 protein in different groups and the effect of PD98059 on the change in BACE1 expression induced by NaHS
Western blot结果显示,NaHS 200μmol/L组pERK1/2蛋白表达水平较对照组上调[分别为(1.554±0.107)和(0.917±0.092)],差异有统计学意义(t=9.053,P=0.000);PD98059 预处理组中 NaHS 诱导的pERK1/2表达上调被抑制,且pERK1/2表达随PD98059浓度增加而下降[分别为(0.990±0.088)和(0.693±0.045)],与 NaHS 200μmol/L 组比较差异有统计学意义(F=80.970,P=0.000;t=8.204,P=0.000;t=12.527,P=0.000);但 PD98059 预处理未能削弱NaHS下调BACE1的作用,预处理组[分别为(0.259±0.086)和(0.280±0.106)]与 NaHS200 μmol/L组(0.266±0.064)比较,BACE1水平无明显改变,差异无统计学意义(F=0.047,P=0.954;t=0.190,P=0.855;t=0.114,P=0.913)。
2.4 外源性 H2S对 Aβ42蛋白表达的调节及LY294002和PD98059对其影响(图4)
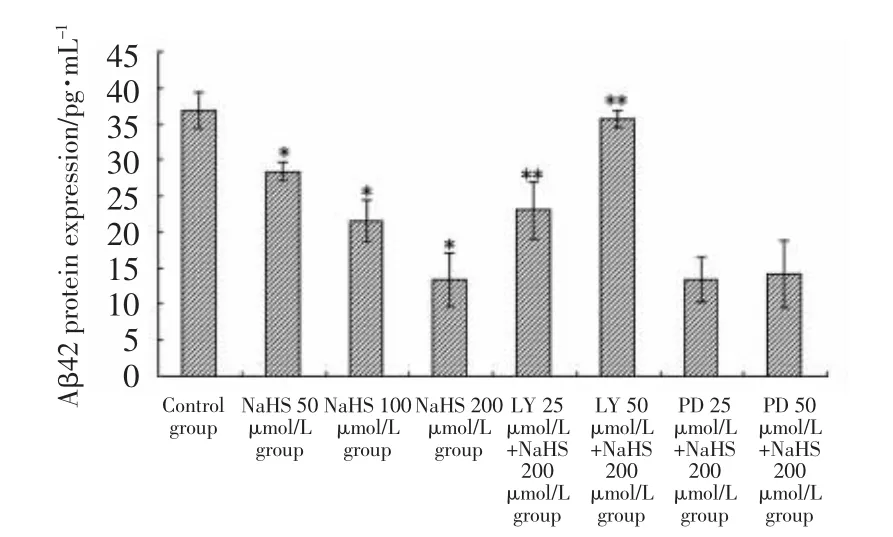
图4 各细胞组Aβ42蛋白表达的ELISA结果Fig.4 Expression of Aβ42 protein in different groups detected by ELISA
ELISA结果显示,与对照组(36.812±2.480)相比,各NaHS处理组培养液中Aβ42表达水平随NaHS浓度增加依次下调[分别为(28.409±1.337)、(21.537±2.964)和(13.313±3.664)],在 LY294002 预处理组,Aβ42表达又增加至 23.040±4.001和 35.682±1.205,在 PD98059预处理组,Aβ42表达仍在较低的水平[分别为(13.394±3.051)和(14.214±4.633)],其中各NaHS处理组与对照组比较均有统计学差异(F=39.768,P=0.000;t=3.749,P=0.006;t=6.815,P=0.000;t=10.483,P=0.000),LY294002 预处理组与NaHS 200μmol/L组比较,差异有统计学意义 (F=36.572,P=0.000;t=3.709,P=0.010;t=8.528,P=0.000),而PD98059预处理组与NaHS200 μmol/L组比较,差异无统计学意义(F=0.051,P=0.951;t=0.026,P=0.980;t=0.288,P=0.783)。
3 讨论
Aβ沉积形成老年斑是AD最主要的病理改变,其产生的神经毒性作用可导致AD发病。研究发现,淀粉样蛋白斑块周围的神经元内BACE1水平增高[5],而BACE1基因缺失可以减少Aβ的产生及沉积,挽救认知和海马胆碱能神经功能障碍[6],所以大部分学者认为BACE1在Aβ生成中扮演着关键性角色,是AD病理过程的重要因素。作为继NO、CO之后第3种气体信号分子,H2S对神经系统的调节十分重要,其浓度过高可导致机体中毒,过低也可能引起疾病的发生与进展。H2S参与AD发病的可能机制目前认为主要与血清H2S水平降低影响海马长时程形成及突触活动而损害学习和记忆,H2S减少影响其抗氧化的神经保护作用以及H2S减少引起的脑血管张力增加致使脑组织长期慢性缺血等原因有关[6]。但H2S水平的改变能否影响BACE1表达进而参与AD病理过程尚不清楚,所以我们对此进行了研究。
据报道,NaHS在溶液中解离可提供原始浓度33%左右的H2S,较直接泵入H2S气体更稳定,因此我们采用NaHS作为外源性H2S的供体取代直接泵入H2S。选取PC12细胞作为研究对象,是因其被NGF诱导分化后具有神经细胞特性,又可稳定传代,是国际上公认的体外研究神经生物、化学及神经疾病的理想模型。本实验结果显示,50~200μmol/L NaHS处理PC12细胞,从基因与蛋白水平上呈剂量依赖性下调BACE1的表达。因此我们认为,实验浓度范围内的NaHS释放的H2S因远远低于哺乳动物脑内H2S的生理浓度(50~160μmol/L)上限,对PC12细胞没有毒性,却有抑制BACE1表达的作用。脑和血浆中内源性H2S降低的AD患者病理效应的产生可能与BACE1表达增加有关。
PI3-K/Akt与MAPK/ERK1/2通路是细胞内重要的信号转导通路,其下游关键蛋白Akt及ERK1/2磷酸化增加时,通路被激活。动物实验已经证实pAkt水平降低与AD有必然的联系[7],而MAPK/ERK1/2通路的激活也从多方面参与了学习、记忆的形成过程[8]。因此,为了进一步探讨H2S调节BACE1的细胞信号机制,我们分别用不同浓度的特异性抑制剂预先阻断上述2条通路,然后与200μmol/L NaHS共同培养细胞。结果发现,单纯的NaHS处理使pAkt1、pERK1/2表达上调,同时BACE1表达下降,阻断PI3-K/Akt通路使NaHS的这种作用被削弱,而阻断MAPK/ERK1/2通路其表达无明显变化。因此,我们推测外源性H2S调节PC12细胞BACE1的表达可能是通过PI3-K/Akt通路及其下游信号蛋白的激活实现的,与MAPK/ERK1/2通路激活无关。我们的前期研究结果显示,PI3-K/Akt信号通路受损明显上调BACE1表达[9],也支持我们的推测。有学者在采用NT2细胞研究MAPK/ERK1/2通路对BACE1的影响时发现,通路有负性调节BACE1活性与表达的作用[10],与我们的实验结果不一致,这是否与不同细胞系内活化的pERK1/2出现转运或其在细胞亚结构的定位聚集不同而失作用于下游目的蛋白有关,仍需结合其它可能因素做进一步分析。
Aβ是APP经BACE1裂解途径代谢的终产物,脑内有病理意义的 Aβ 包括 Aβ40和 Aβ42,Aβ40水平远远高于Aβ42,但后者更易沉积,是形成老年斑的主要成分,故我们对Aβ42进行了检测。发现NaHS同样下调了Aβ42表达,并且这种作用被阻断PI3-K/Akt通路所拮抗,而与阻断MAPK/ERK1/2通路无关。一般认为,Aβ的神经毒性主要是通过氧化应激引起的,但氧化应激本身又会促进Aβ的产生、聚集和沉积,有研究指出,H2S能对抗谷氨酸[11]和HOCL[12]引起的氧化应激,所以基于上述理论我们有理由认为,外源性H2S可能正是通过其抗Aβ产生的氧化应激作用负性调节BACE1表达进而反馈下调Aβ的,但目前尚难定论。然而本实验应用外源性H2S从病理起源上减少了Aβ的产生,为AD的临床治疗提供了合理的设想。
总之,我们的研究表明,外源性H2S具有下调PC12细胞BACE1表达的作用,其信号机制可能涉及PI3-K/Akt通路的激活,与MAPK/ERK1/2通路激活无关。用外源性H2S调节BACE1,为临床上防治AD开辟了新的思路,也为进一步研发具有释放H2S功效的药物提供了新的理论依据。
[1]Stockley JH,O’Neill C.Understanding BACE1:essential protease for amyloid-beta production in Alzheimer’s disease [J].Cell Mol Life Sci,2008,65(20):3265-3289.
[2]Hu Y,Chen X,Pan TT,et al.Cardioprotection induced by hydrogen sulfide preconditioning involves activation of ERK and PI3-K/Akt pathways[J].Pflugers Arch,2008,455(4):607-616.
[3]Eto K,Asada T,Arima K,et al.Brain hydrogen sulfideisseverely decreased in Alzheimer’s disease[J].Biochem Biophys Res Commun,2002,293(5):1485-1488.
[4]Liu XQ,Jiang P,Huang H,et al.Plasmalevels of endogenous hydrogen sulfide and homocysteine in patients with Alzheimer’s disease and vascular dementia and the significance thereof[J].Zhonghua Yi Xue Za Zhi,2008,88(32):2246-2249.
[5]Zhao J,Fu Y,Yasvoina M,et al. β-Site amyloid precursor protein cleaving enzyme Ilevels become elevated in neurons around amyloid plaques:implications for Alzheimer's disease pathogenesis [J].J Neurosci,2007,27(14):3639-3649.
[6]Ohno M,Sametsky EA,Younkin LH,et al.BACE1 deficiency rescues memory deficits and cholinergic dysfunction in a mouse model of Alzheimer'sdisease[J].Neuron,2004,41(1):27-33.
[7]Jolivalt CG,Lee CA,Beiswenger KK,et al.Defective insulin signaling pathway and increased glycogen synthase kinase-3 activity in the brain of diabetic mice:parallels with Alzheimer’s disease and correction by insulin[J].JNeurosci Res,2008,86(15):3265-3274.
[8]Kim SW,Ha NY,Kim KI,et al.Memory-improving effect of formulation-MSSby activation of hippocampal MAPK/ERK signaling pathway in rats[J].BMBRep,2008,41(3):242-247.
[9]李洁颖,晏勇,蔡志友,等.胰岛素信号通路磷脂酰肌醇-3/丝氨酸苏氨酸蛋白激酶对海马神经元β-淀粉样前体蛋白裂解酶1表达的影响[J].中华神经科杂志,2009,42(11):737-741.
[10]Tamagno E,Guglielmotto M,Giliberto L,et al.JNK and ERK1/2 pathways have a dual opposite effect on the expression of BACE1[J].Neurobiol Aging,2009,30(10):1563-1573.
[11]Kimura Y,Kimura H.Hydrogen sulfide protects neurons from oxidativestress[J].FASEBJ,2004,18(10):1165-1167.
[12]Whiteman M,Cheung NS,Zhu YZ,et al.Hydrogen sulphide:a novel inhibitor of hypochlorous acid-mediated oxidative damage in the brain?[J].Biochem Biophys Res Commun,2005,326 (4):794-798.
