microRNA-24对人喉鳞癌Hep2细胞增殖及侵袭的影响
2011-05-25郭艳尚超孙开来钟鸣富伟能
郭艳,尚超,孙开来,钟鸣,富伟能
(中国医科大学1.口腔医学院中心实验室,沈阳 110002;2.基础医学院医学遗传学教研室,沈阳 110001)
喉癌是原发于上皮的最常见的头颈部恶性肿瘤,其中绝大多数组织类型是鳞状细胞癌(laryngeal squamouscell carcinoma,LSCC)。尽管科研工作者从多个层面致力于喉鳞癌的研究,但其生存率和治疗策略一直没有显著的提高。近年来,微小RNA(microRNAs,miRNAs)的发现为肿瘤治疗靶点的研究带来了新的曙光,它是一类长约22个核苷酸的非编码小RNA,通过降解靶基因mRNA或抑制其翻译而在肿瘤的发生、发展过程中发挥着类似于癌基因和抑癌基因的功能[1]。Li等[2]应用 miRNAs芯片建立LSCCmiRNAs表达谱,发现微小RNA-24(microRNA-24,miR-24)表达水平显著低于癌旁组织,且与淋巴结转移相关,提示miR-24在LSCC发生、发展中可能发挥着抑癌基因的功能。因此,本研究中我们将以LSCCHep2细胞系为研究对象,体外生物合成miR-24前体(pre-miR-24),通过转染、MTT 和 Transwell小室法进一步探讨miR-24对LSCC细胞增殖、侵袭能力的影响,以期为miR-24介导的LSCC分子机制研究乃至LSCC有效分子靶标的开发提供依据。
1 材料与方法
1.1 细胞培养
人LSCCHep2细胞系和鼠NIH3T3细胞系由本室保存,常规培养于RPMI 1640培养基(Gibco)中,取对数生长期的细胞用于后继实验。
1.2 miR-24前体合成与细胞转染
miRNA-24前体(pre-miR-24)由 Ambion公司合成,cotrol miR为阴性对照。Hep2细胞于转染前24 h接种于 24孔板中(4×104/孔),按照脂质体 LipofectamineTM2000操作说明将50 nmol/L pre-miR-24和control miR分别转入Hep2细胞中,单独转染脂质体组为空白对照。37℃5%CO2培养箱中重新培养后进行相关检测。
1.3 荧光定量PCR检测转染效果
用mirVana miRNA分离试剂盒(Ambion)提取总miRNA。QuantiMir反转录试剂盒(System Biosciences)逆转录成小RNA的cDNA。根据操作说明应用SYBR荧光染料(Ambion)检测pre-miR-24的表达,U6-snRNA为内参。miR-24特异性上游引物为:5′-TGGCTCAGTTCAGCAGGAACAG-3′,通用下游引物为:5′-CGAATTCTAGAGCTCGAGGCAGGCGACATGGCTGGCTAGTTAAGCTTGGTACCGAGCT CGGATCCACTAGTCC(T)25VN-3′。反应体系为 30 μL,反应条件为:95 ℃ 10 min,然后按 95 ℃ 15 s,60℃1 min进行40个循环。应用的仪器是ABI公司的7500荧光定量PCR仪,使用的软件是7500 Software V2.0.5。3次独立样本经过3次独立实验后得到的数据通过比较 CT 值法(2-ΔΔCT)进行相对定量分析。
1.4 相差显微镜下观察细胞生长情况
Pre-miR-24转染Hep2细胞36 h后,分别在相差显微镜下观察各组细胞的生长情况并拍摄照片。
1.5 细胞增殖检测
Hep2细胞转染pre-miR-24及其对照control miR 1、3、5、7 d 后,细胞增殖检测同参考文献[3]。
1.6 体外细胞侵袭能力检测
[3]。
1.7 统计学分析
所有实验重复3次,应用SPSS13.0统计分析软件对实验数据进行t检验,结果表示为x±s,P<0.05为有统计学意义。
2 结果
2.1 荧光定量PCR验证转染效果
为了确定pre-miR-24是否已经成功导入Hep2细胞中,我们在转染36 h后,用荧光定量PCR相对定量的方法检测了miR-24的表达情况,结果发现,转染36 h时,pre-miR-24转染组中miR-24的表达较对照组明显升高(图1A、1B),该结果表明瞬时转染成功,后继实验可以采用pre-miR-24转染36 h的细胞进行分析。
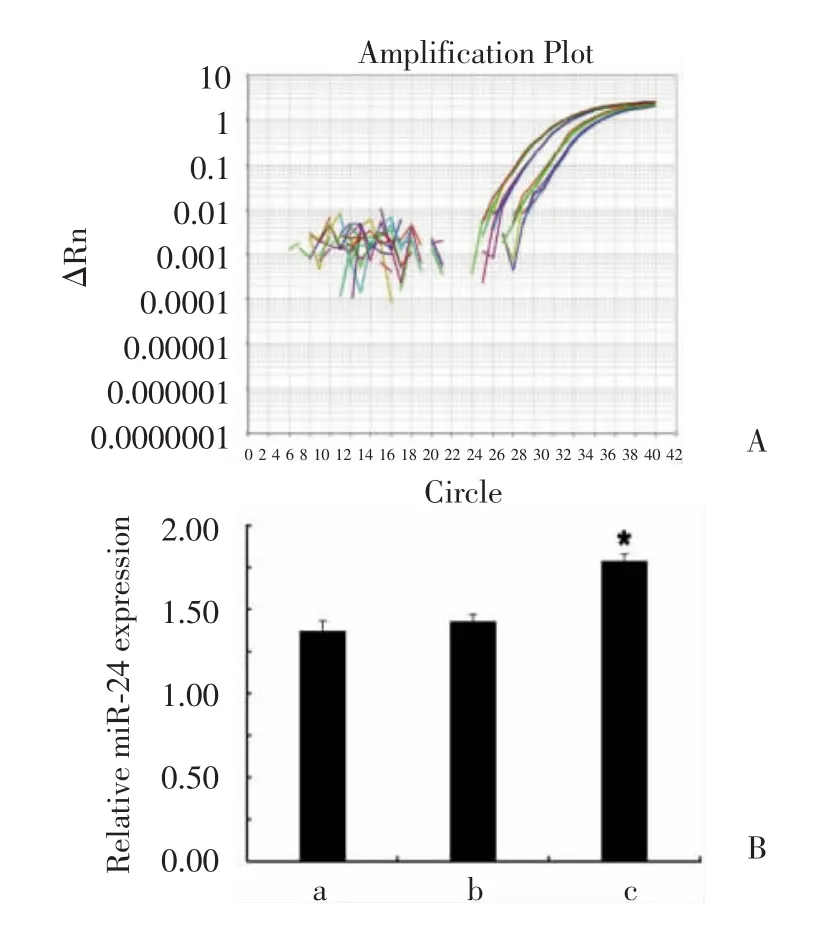
图1 荧光定量PCR检测miR-24表达结果。Fig.1 Result of miR-24 expression assayed by real-time quantitative PCR
2.2 miR-24抑制LSCCHep2细胞增殖
为了了解miR-24在LSCC Hep2细胞中的作用,我们在Hep2细胞中转染pre-miR-24 36 h后,通过相差显微镜观察pre-miR-24对Hep2细胞形态的影响,结果发现转染pre-miR-24组Hep2细胞明显变圆、细胞数量明显减少(图2A-2C),提示pre-miR-24能抑制Hep2细胞的生长;同样MTT实验表明,与转染control组相比,pre-miR-24转染组Hep2细胞增殖能力显著降低(图2D),进一步证实了miR-24具有抑制Hep2细胞增殖的能力。
2.3 miR-24降低LSCCHep2细胞体外侵袭能力
Hep2细胞转染pre-miR-24 36h后,通过Transwell小室侵袭实验观察各组细胞侵袭能力的变化,结果显示pre-miR-24转染组的跨膜细胞数为(12.37±0.52),明显低于control miR转染组和空白对照组的跨膜细胞数[(32.48±0.95);(34±1.25)],差异有统计学意义(P<0.05),提示miR-24具有抑制Hep2细胞侵袭的作用。
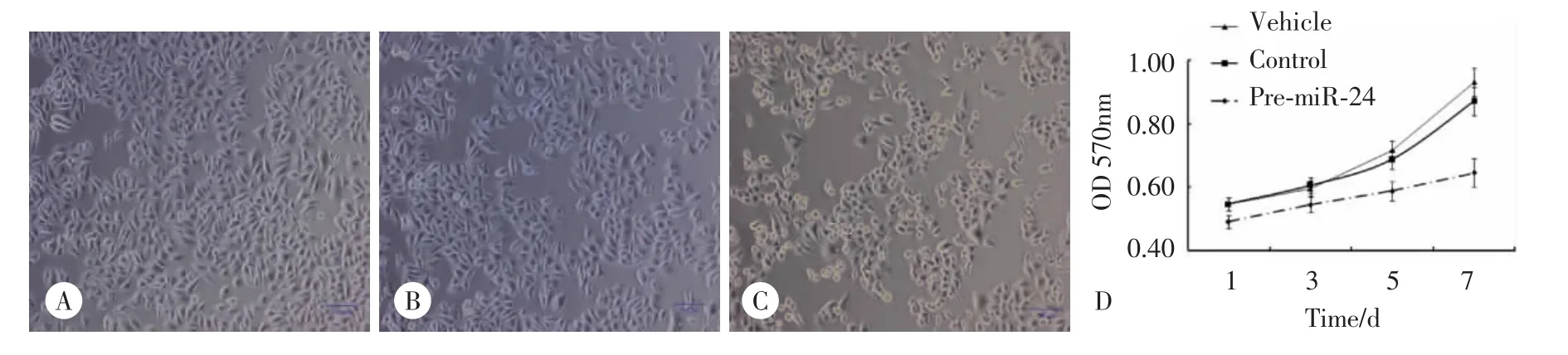
图2 miR-24对Hep2细胞增殖能力的影响Fig.2 Effects of miR-24 on Hep2 cell proliferation
3 讨论
miRNAs是一种广泛存在的对基因表达进行转录后水平调控的分子,具有控制基因表达及细胞增殖、分化和凋亡等多种功能,几乎在所有肿瘤的发生或发展过程中均可检测到miRNAs的过表达或表达缺失,而且这些异常表达的miRNAs通常超过半数定位于癌基因或抑癌基因的相关遗传区域,从而表现出类似癌基因或抑癌基因的作用[4,5]。研究表明,miR-24定位于染色体的EST区域,且该区域为染色体上的不稳定区域,在头颈鳞状细胞癌(HNSCC)中经常发生改变[6]。
关于miR-24异常表达与肿瘤生物学行为的关系目前仍然存在争议。有的学者认为miR-24在肿瘤的发生、发展中发挥着类似于肿瘤抑制基因的功能,而有的学者认为miR-24发挥着癌基因的作用。如在宫颈癌Hela细胞中,miR-24表达下调,细胞增殖能力明显增强;在肺癌A549细胞中,miR-24表达下调导致细胞生长水平的下调[7]。尽管2种观点存在矛盾之处,但2者一致性认为miR-24在肿瘤中发挥重要的功能,并且目前尚没有关于miR-24与LSCC发生、发展及生物学功能的研究。本研究发现,通过体外人为的上调miR-24的表达能明显改变Hep2细胞形态,使细胞数量明显减少,细胞的增殖和侵袭能力明显降低,证实miR-24能够减慢LSCC的发展速度,抑制LSCC的细胞增殖和侵袭能力。另外,由于miRNAs在血液中稳定性很好,而且轻微的miRNAs表达降低即可在患者外周血中检测到很高水平的miRNAs表达变化[8],并且血液标本的采集损伤性小,进一步揭示血液中miR-24的表达变化亦可能成为临床上极具价值的非侵入性LSCC诊断材料之一。
但为什么miR-24在不同组织类型中的表达不一样,并且发挥的作用也不尽相同,甚至完全相反呢?我们推测这一现象的主要原因在于不同类型细胞中的miR-24调控的靶基因存在差异,导致参与的细胞信号转导通路差异,进而对细胞生长、增殖等生物学活性产生不同的调控效应。因此,在未来的研究中,我们将分析LSCC中miR-24的靶基因,进一步探讨miR-24抑制细胞增殖和侵袭的分子机制。
参考文献:
[1]Farazi TA,Spitzer JI,Morozov P,et al.miRNAsin human cancer[J].JPathol,2011,223(2):102-115.
[2]Li L,Zhang ZM,Liu Y,et al.DNA microarrays-based microRNA expression profiles derived from formalin-fixed paraffin-embedded tissue blocks of squammous cell carcinoma of larynx [J].Zhonghua Bing Li Xue Za Zhi,2010,39(6):391-395.
[3]郭艳,富伟能,尚超,等.HLA-B对喉癌Hep2细胞生物学行为的影响[J].山东医药,2011,51(11):21-22,33.
[4]Lal A,Navarro F,Maher CA,et al.miR-24 Inhibits cell proliferation by targeting E2F2,MYC,and other cell-cycle genes via binding to"seedless"3′UTRmicroRNA recognition elements[J].Mol Cell,2009,35(5):610-625.
[5]Sevignani C,Calin GA,Nnadi SC,et al.MicroRNA genes are frequently located near mouse cancer susceptibility loci [J].Proc Natl Acad Sci USA,2007,104(19):8017-8022.
[6]Yu YH,Kuo HK,Chang KW.Theevolvingtranscriptome of head and neck squamous cell carcinoma:a systematic review [J].PLoSOne,2008,3(9):e3215.
[7]Cheng AM,Byrom MW,Shelton J,et al.Antisense inhibition of human miRNAs and indications for an involvement of miRNA in cell growth and apoptosis [J].Nucleic Acids Res,2005,33(4):1290-1297.
[8]Lin SC,Liu CJ,Lin JA,et al.miR-24 up-regulation in oral carcinoma:positive association from clinical and in vitro analysis [J].Oral Oncol,2010,46(3):204-208.
