喉鳞状细胞癌中STK15蛋白和BUBR1蛋白的表达及相互作用
2011-05-25马洪峰郭星李晓瑜
马洪峰,郭星,李晓瑜
(中国医科大学附属第一医院耳鼻咽喉科,沈阳 110001)
中心体异常及纺锤体检控点缺陷导致的基因组不稳定被认为是肿瘤发生的重要因素。丝氨酸/苏氨酸激酶 15(serine/threonine kinase-15,STK15)基因,又称BTAK或aurora2基因,定位于20q13,基因已克隆,有9个外显子,全长cDNA 1.8 kb,编码一种(403个氨基酸,分子量46 kDa)中心体相关激酶,对染色体分离和中心体功能都至关重要;已证实STK15是一种癌基因,在多种肿瘤中都出现了扩增,其mRNA和蛋白过表达[1]。BUBR1基因定位于15q15区域,cDNA全长3 702 bp,含有23个外显子和22个内含子,编码BUBR1蛋白,分子量为120 kDa,由1 050个氨基酸组成;该蛋白是纺锤体检控点处的一个重要功能蛋白,BUBR1的缺陷可引起染色体的不稳定[2]。已有文献报道喉鳞状细胞癌中存在STK15和BUBR1蛋白的异常表达,而关于两者相互作用的研究尚未见报道。本研究通过免疫组织化学方法证实STK15和BUBR1蛋白的表达与喉鳞状细胞癌具有相关性,并应用免疫荧光共定位实验探讨喉鳞状细胞癌中STK15和BUBR1蛋白的相互作用。
1 材料与方法
1.1 标本的来源及制备
40例喉癌组织标本及癌旁正常组织标本均来源于中国医科大学附属第一医院2006年9月至2009年6月间的住院患者。患者均经病理诊断为喉鳞状细胞癌,均为首发病例,术前未经放疗和化疗。术后取一组标本固定于4%多聚甲醛中,送交喉癌研究室制成蜡块。另一组标本立即储存在-70℃冰箱中,待制备冰冻切片。所取标本均经患者及家属知情同意。
1.2 试剂及方法
1.2.1 主要试剂:小鼠抗人BUBR1蛋白质抗体,山羊抗人STK15蛋白质抗体,驴抗鼠IgG-FITC(绿光),兔抗山羊IgG-TRITC(红光),均购于Santa Cruz公司;SP免疫组织化学染色试剂盒(小鼠、山羊)、DAB显色剂,购于福州迈新生物公司。
1.2.2 试验方法:免疫组织化学SP法检测STK15和BUBR1蛋白的表达水平:组织石蜡块切片,厚度4μm,分别进行苏木精—伊红染色和SP免疫组织化学染色。实验按SP免疫组织化学染色试剂盒的指导步骤进行,采用柠檬酸高压煮沸2 min,进行抗原修复,STK15抗体工作浓度1∶500,BUBR1抗体工作浓度1∶80,以STK15和BUBR1均阳性表达的乳腺癌标本做阳性对照,PBS代替一抗做阴性对照。免疫荧光共定位试验:取-70℃冰冻标本(免疫组织化学实验中STK15和BUBR1均阳性表达的喉癌组织标本)制作冰冻切片,丙酮-20℃固定,一抗STK15(1∶500)、BUBR1(1∶100)混育,4 ℃过夜。二抗兔抗山羊 IgG-TRITC(1∶100)、驴抗鼠 IgG-FITC(1∶100)37 ℃混育40 min。荧光显微镜下观察。
1.3 结果判定
1.3.1 免疫组织化学结果观察及判定:与阴性对照相比,STK15和BUBR1蛋白阳性表达为棕黄色或棕褐色细颗粒,主要定位于细胞质,细胞核少量表达。光学显微镜下进行图像采集,所得图像经光密度图像分析仪分析平均光密度,平均光密度值用来量化蛋白表达的强度,平均光密度值越大蛋白表达越强。
1.3.2 免疫荧光共定位结果观察及判定:选择免疫组化实验中STK15和BUBR1蛋白表达均阳性的喉癌组织标本进行冰冻切片免疫荧光共定位实验。荧光染色切片在荧光显微镜下观察,荧光染色主要定位于细胞质,细胞核少量。STK15蛋白标记为红色荧光,BUBR1蛋白标记为绿色荧光。若2种标记重叠为黄色荧光,可认为2种蛋白共定位,提示可能存在相互作用。
1.4 统计学处理
数据采用x±s表示。应用SPSS13.0统计软件,两样本均数比较进行t检验。P<0.05为差异有统计学意义。
2 结果
2.1 喉癌组织和癌旁正常组织中STK15和BUBR1蛋白的表达水平
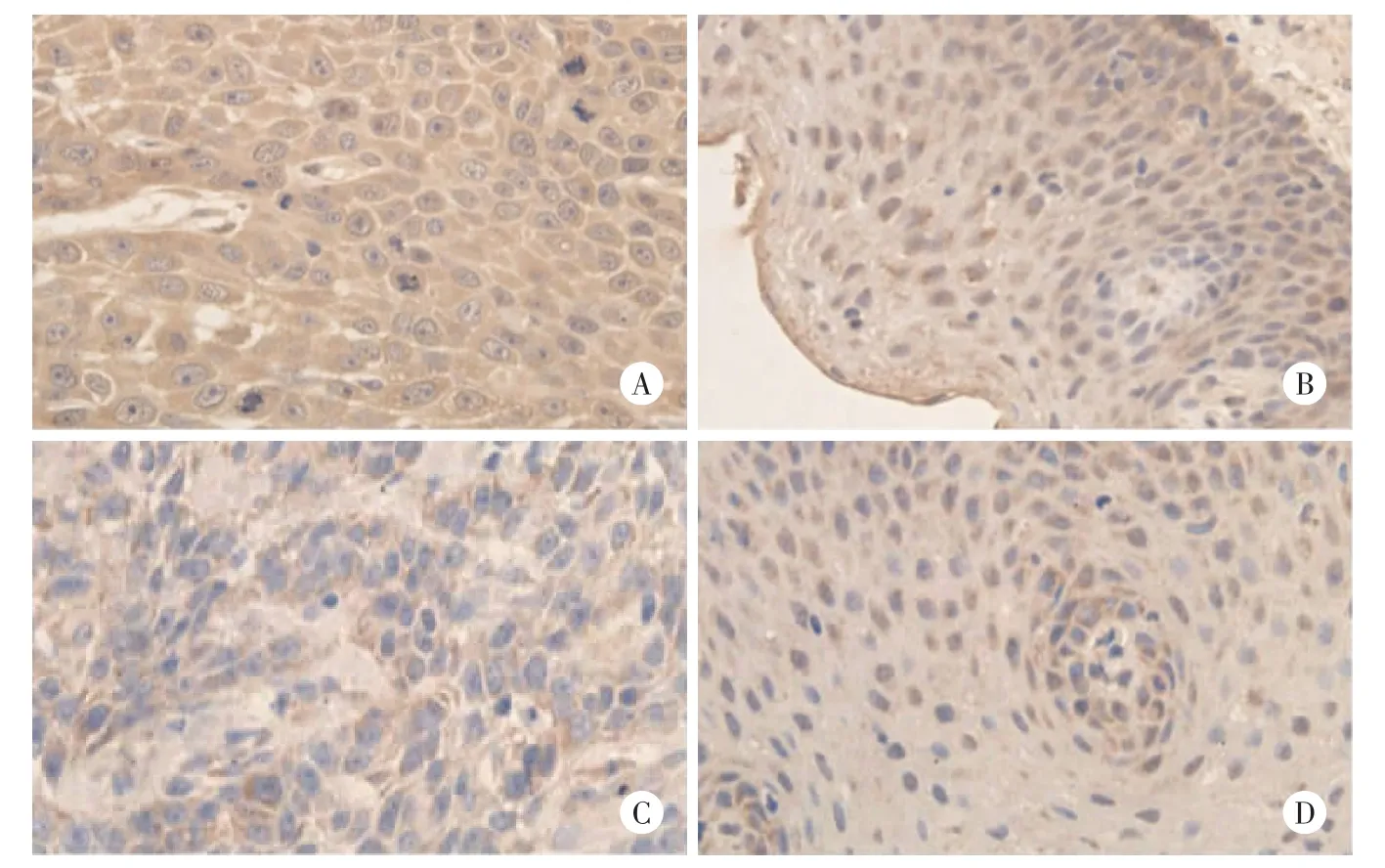
图1 喉癌和癌旁组织中STK15蛋白和BUBR1蛋白的阳性表达×400Fig.1 Positive expression of STK15 and BUBR1 in LSCCtissue and paired normal tissue×400
免疫组化结果表明,喉癌组织和癌旁正常组织中STK15和BUBR1蛋白均可见阳性表达(图1)。喉癌组织和癌旁正常组织中STK15蛋白平均光密度值分别为(159.2±3.96)×10-3和(156.5±2.24)×10-3(t=3.722,P<0.05),BUBR1蛋白平均光密度值分别为(117.1±1.95)×10-3和(118.6±1.71)×10-3(t=3.464,P<0.05),喉癌组织中STK15蛋白表达水平高于癌旁正常组织,BUBR1蛋白表达水平低于癌旁正常组织。
2.2 免疫荧光共定位结果
喉癌组织中STK15蛋白和BUBR1蛋白均在细胞质及细胞核中表达。荧光显微镜观察,红色荧光为STK15蛋白表达标记,细胞质中荧光亮度较强,细胞核次之(图2A);绿色荧光为BUBR1蛋白表达标记,仍为细胞质中荧光亮度较强,细胞核次之(图2B)。荧光照相系统整合重叠后的图像中,胞质和胞核内红、绿2种荧光标记重叠为黄色荧光(图2C),可认为STK15和BUBR1蛋白在喉鳞状细胞癌中的细胞质及细胞核中共定位,提示两者可能存在相互作用。
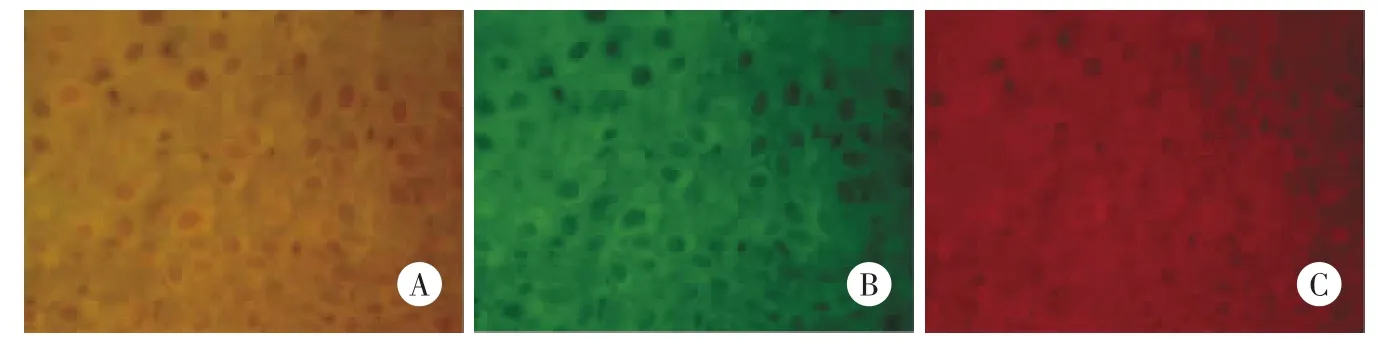
图2 喉癌组织中STK15蛋白和BUBR1蛋白的免疫荧光共定位×400Fig.2 Immunofluorescence of STK15 and BUBR1 protein in LSCCtissue×400
3 讨论
STK15和BUBR1都在细胞有丝分裂过程中扮演重要角色。STK15是一类广泛存在于真核细胞中的丝氨酸/苏氨酸激酶,参与细胞DNA合成后期/有丝分裂期(G2/M)转换,通过促进中心体成熟及微管晶核形成确保双极纺锤体的形成,从而保持基因组稳定[1]。BUBR1是存在于哺乳动物中的有丝分裂检控点基因家族MAD3的同源基因,BUBR1可以通过自身或作为有丝分裂检查点复合物的成分抑制泛素联接酶—后期促进复合体的活性,激活有丝分裂检控点信号级联放大。近年来的研究表明,在多种恶性肿瘤中存在着STK15基因扩增、过表达及BUBR1 基因表达下调[2]。
本研究显示,喉癌组织中STK15蛋白表达水平明显高于癌旁正常组织(P<0.05),而BUBR1蛋白表达水平喉癌组织明显低于癌旁正常组织(P<0.05)。提示喉癌中存在STK15蛋白过表达及BUBR1蛋白表达下调,他们可能与喉癌发生、发展密切相关。1998 年 Bischoff等[3]运用 Southern blot发现原位结肠直肠癌细胞中有 STK15 DNA扩增,2004年Rojanala等[4]运用免疫组织化学方法发现28例胰腺癌标本中26例有STK15高水平表达。Tong等[5]运用免疫组织化学、Western blot发现食管鳞状细胞癌中STK15蛋白量明显高于正常食管黏膜组织。研究提示,STK15过表达可能有以下几种原因:(1)STK15基因本身的扩增造成mRNA及蛋白质增加[6];(2)STK15蛋白的抑制因子—p53基因突变,导致p53蛋白对STK15蛋白抑制作用减弱,导致STK15蛋白无论活性还是表达量均明显上升[7]。因此,无论什么原因造成STK15在恶性肿瘤中出现的过表达,均可导致中心体异常扩增,引发染色体在分裂中的多极分配及不稳定,进而激活癌基因或使抑癌基因失活,导致肿瘤产生。已经有关于BUBR1突变引发肿瘤的报道,如结肠直肠癌细胞中检测到BUB1和 BUBR1的突变[2]。Fang等[8]报道了 BUBR1 缺陷也导致对DNA损伤的妥协反应。Futamura等[9]报道BRCAZ基因在一些乳腺癌家族中具有遗传易感性,它被BUBR1磷酸化后在体内参与有丝分裂检查点作用。这些发现表明BUBR1基因可能在人类癌症中有丝分裂检查点控制和有丝分裂检查点修复中扮演重要角色。
本研究中免疫荧光共定位实验表明,喉癌组织中STK15蛋白与BUBR1蛋白在细胞质及细胞核中共定位,提示两者可能存在相互作用。STK15蛋白与BUBR1蛋白都定位于中心体;这2种蛋白功能失调都可以导致中心体扩增,引起有丝分裂检控点反应途径障碍;STK15蛋白过表达和BUBR1蛋白表达下调可促进细胞恶性转化;恶性肿瘤和实体瘤中经常观测到G1/S期﹑M期调节蛋白的异常[10]。以上均提示STK15蛋白与BUBR1蛋白可能通过某些作用途径共同调控有丝分裂检控点和中心体复制。Morrow等[11]通过蛋白质印迹法﹑时差显微成像技术等方法研究认为BUB1和STK15共同维持BUBR1介导的对泛素联接酶—后期促进复合体的抑制作用,但未阐明他们之间的作用机制。STK15蛋白C端含有具备催化活性的保守区域,N端包含一激酶特征性区域称为Aurora盒,参与激酶与其他蛋白质的相互作用及自身活性调节[1];BUBR1蛋白是1个对着丝粒张力起反应的多结构域蛋白激酶,有文献报道[2]使用3步表达策略获得了1个可溶BUBR1结构,表明BUBR1包括1个KEN盒模体、1个Mad3样域、1个Bub3连接域和1个激酶域。从蛋白质结构看STK15蛋白N端包含1个Aurora盒,BUBR1蛋白包含1个激酶域。这2个结构都参与激酶与其他蛋白质间的相互作用,故STK15蛋白与BUBR1蛋白存在相互作用的结构基础。对于蛋白质相互作用的研究,免疫荧光共定位的优点是蛋白质之间的相互作用发生在完整的细胞里,可以反映蛋白质在生理状态的活动。通过荧光能够观察到蛋白质在细胞内的共定位,但免疫荧光共定位存在一定的假阳性率,所以还需免疫共沉淀、酵母双杂交等其他方法进一步鉴证其可靠性。本课题研究尚未结束,我们下一步将继续验证该结论的可靠性及努力探讨2种蛋白相互作用的部位及机制。
总之,我们的研究发现,STK15蛋白高表达、BUBR1蛋白低表达可能与喉癌的发生具有相关性,且这2种蛋白在胞质、胞核中共定位,提示两者可能存在相互作用,共同诱导喉癌的发生,但具体的作用部位及作用机制还需进一步研究。
[1]Vankayalapati H,Bearss DJ,Saldanha JW,et al.Targeting aurora2 kinase in oncogenesis:a structural bioinformatics approach to target validation and rational drug design [J].Mol Cancer Ther,2003,2(3):283-294.
[2]Shi HK,Lu ZY.The latest progress in studies of mitotic checkpoint gene BUBR1[J].Prog Mod Biomedcine,2007,7(7):1110-1115.
[3]Bischoff,Anderson L,Zhu Y.A homologue of Drosophila aurora kinase is oncogenic and amplified in human colorectal cancers[J].EMBOJ,1998,17(11):3052-3065.
[4]Rojanala S,Han H,Munoz RM.The mitotic serine threonine kinase,Aurora-2,is a potential target for drug development in human pancreatic cancer[J].Mol Cancer Ther,2004,3(4):451-457.
[5]Tong T,Zhong Y,Kong J.Overexpression of Aurora-A contributes to malignant development of human esophageal squamous cell carcinoma[J].Clin Cancer Res,2004,10(21):4-10.
[6]Kamada K,Yamada Y,Hirao T,et al.Amplification/overexpression of Auror-A in human gastric carcinoma:potential role in differentiated typegastric carcinogenesis[J].Oncol Rep,2004,12(3):593-599.
[7]Chen SS,Chang PC,Cheng YW,et al.Suppression of the STK15 oncogenic activity requires a transactivation independent p53 function[J].EMBOJ,2002,21(17):4491-4499.
[8]Fang Y,Liu T,Wang X,et al.BubR1 is involved in regulation of DNA damageresponses[J].Oncogene,2006,25(25):3598-3605.
[9]Futamura M,Arakawa H,Matsuda K,et al.Potential role of BRCA2 in a mitotic checkpoint after phosphroylation by BUBR1[J].Cancer Res,2000,60(6):1531-1535.
[10]Lengauer C,Wang Z,From spindle checkpoint to cancer[J].Nat Genet,2004,36(11):1144-1145.
[11]Morrow CJ,Tighe A,Johnson VL,et al.Bub1 and aurora B cooperate to maintain BubR1-mediated inhibition of APC/CCdc20[J].J Cell Sci,2005,118(Pt 16),3639-3652.
