HPLC法测定双花颗粒中绿原酸的含量Δ
2011-05-23徐玲张继芬吴芳洲张辉徐晓玉西南大学药学院西南大学中药研究所重庆市400715
徐玲,张继芬,吴芳洲,张辉,徐晓玉(西南大学药学院/西南大学中药研究所,重庆市 400715)
双花颗粒系西南大学中医药学院徐晓玉教授在中医药理论的指导下精心研制的中药复方制剂。其主要成分为山银花,具有抑菌、消炎、保肝的功效[1,2]。2005年版《中国药典》中记载山银花含绿原酸,为其公认的主要有效成分,因此本研究采用绿原酸作为双花颗粒含量测定的指标成分。
有关绿原酸含量测定的方法有高效液相色谱(HPLC)法[3]、薄层色谱-紫外分光光度(TLC-UV)法[4]、毛细管区带电泳法[5]、薄层扫描法[6]等。本试验采用HPLC法测定双花颗粒中绿原酸的含量,方法准确、简便、可靠,可用于双花颗粒的质量控制。
1 仪器与试药
1200 series HPLC仪(美国Agilent公司);KQ5200E型超声波清洗器(江苏昆山市超声仪器有限公司);JA2003N电子天平(上海精密科学仪器有限公司)。
绿原酸对照品(中国药品生物制品检定所,批号:110753-200413);双花颗粒(西南大学中药研究所研制,规格:每袋2 g,批号:2009102502、2009102601、2009102701);乙腈为色谱纯,磷酸、甲醇为分析纯,水为超纯水。
2 方法与结果
2.1 溶液的制备
2.1.1 对照品溶液 精密称取绿原酸对照品10.8 mg,置于100 mL容量瓶中,加50%甲醇稀释至刻度,摇匀,即得108µg·mL-1的对照品溶液。
2.1.2 供试品溶液 称取双花颗粒约2 g,研细,精密称取约0.3 g,置25 mL容量瓶中,用50%甲醇20 mL超声(功率:200 W,频率:40 kHz)溶解30 min,放冷,加50%甲醇稀释至刻度,摇匀,滤过,精密量取续滤液1 mL,置10 mL容量瓶中,加50%甲醇稀释至刻度,摇匀,用微孔滤膜(0.22µm)滤过,取续滤液作为供试品溶液。
2.1.3 阴性对照溶液 取不含山银花的颗粒作为阴性样品,按“2.1.2”项下方法制备阴性对照溶液。
2.2 色谱条件
色谱柱:Shimpack VP-ODS(150 mm×4.6 mm,5µm);流动相:乙腈-0.2%磷酸(10∶90);流速:1.0 mL·min-1;检测波长:326 nm;柱温:30℃;进样量:20µL。采用外标法进行定量。
2.3 系统适用性试验
分别吸取供试品溶液、对照品溶液和阴性对照溶液,按“2.2”项下色谱条件分别进行检测。结果可得,绿原酸峰形良好,与其他组分能较好分离,阴性对照在绿原酸相应的保留时间附近无干扰峰。色谱见图1。
2.4 标准曲线的制备
分别精密吸取对照品溶液(108 µg·mL-1)0.5、1.0、2.0、4.0、5.0 mL,置10 mL棕色容量瓶中,加50%甲醇稀释至刻度,摇匀,用微孔滤膜(0.22µm)滤过,按上述色谱条件进样20µL,记录峰面积。以绿原酸进样浓度(c)为横坐标,峰面积积分值(A)为纵坐标,进行线性回归,得回归方程为A=33.795c-34.767(r=0.9997,n=5)。结果表明,绿原酸进样浓度在5.4~54.0µg·mL-1范围内与峰面积积分值呈良好线性关系。
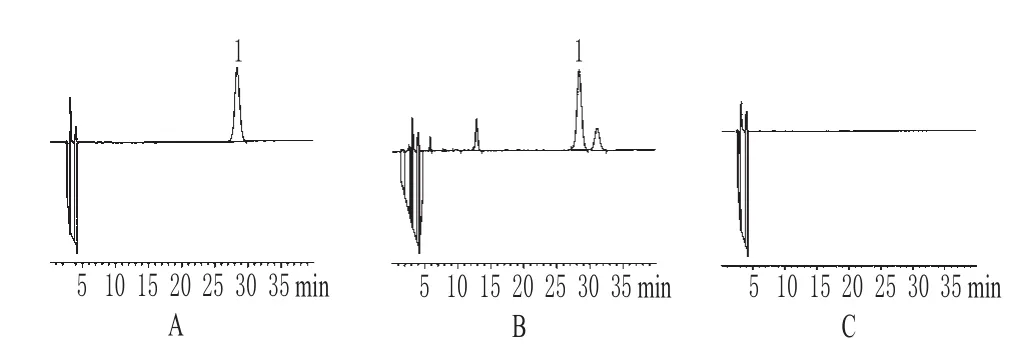
图1 高效液相色谱图A.对照品;B.供试品;C.阴性对照;1.绿原酸Fig 1 HPLC chromatogramsA.substance control;B.test samples;C.negative control;1.chlorogenic acid
2.5 精密度试验
取对照品溶液适量,重复进样6次,测定绿原酸的峰面积。结果,RSD=0.15%(n=6),表明仪器精密度良好。
2.6 稳定性试验
取同一供试品溶液适量,分别于0、2、4、6、8、12、24 h进样,测定绿原酸的峰面积。结果,RSD=0.67%(n=7),表明供试品溶液在24 h内稳定。
2.7 重复性试验
精密称取同一批样品(批号:2009102701)适量,共6份,分别按“2.1.2”项下方法制备供试品溶液,测定绿原酸的含量。结果,绿原酸的平均含量为10.01 mg·g-1,RSD=1.4%(n=6),表明方法重复性良好。
2.8 加样回收率试验
称取9份已知含量(10.12 mg·g-1,批号:2009102701)的样品约0.15 g,精密称定,分别加入对照品3个浓度梯度共9份,按“2.1.2”项下方法制备供试品溶液,按上述色谱条件测定,计算加样回收率,结果见表1。
2.9 样品含量测定
取3批样品(批号:2009102502、2009102601、2009102701)适量,分别按“2.1.2”项下方法制备供试品溶液,取20µL进样,按上述色谱条件测定峰面积,计算含量。结果,3批样品中绿原酸的含量分别为 9.95、10.01、10.12 mg·g-1。
3 讨论
3.1 检测波长的确定
取绿原酸对照品在200~400 nm波长范围内进行扫描。结果表明,其最大吸收值在326 nm波长处,因此选用326 nm作为检测波长。
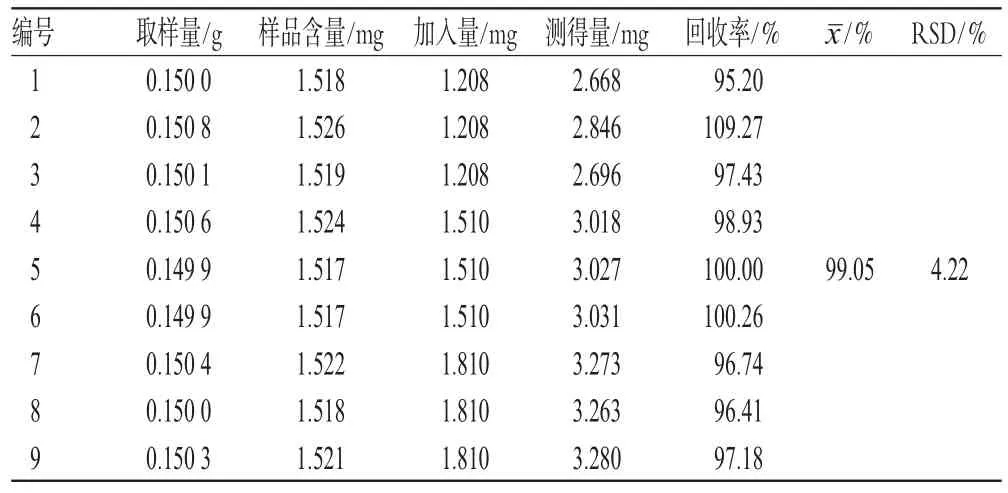
表1 加样回收率试验结果(n=9)Tab 1 Results of recovery tests(n=9)
3.2 流动相的选择
试验在检测波长为326 nm、进样量为20µL、流速为1.0 mL·min-1的条件下,分别以乙腈-0.4%磷酸溶液(13∶87)、乙腈-0.1%磷酸溶液(17∶83)、甲醇-水-冰醋酸(7∶92∶1)、乙腈-0.2%磷酸溶液(10∶90)为流动相,测定绿原酸对照品溶液和供试品溶液。结果表明,流动相为乙腈-0.2%磷酸溶液(10∶90)时,绿原酸的保留时间为28.4 min,且峰形良好。在此条件下对样品进行分析,绿原酸与其他组分能较好分离,故选其作为流动相。
[1]林 都,王 荣,徐晓玉,等.双花颗粒对小鼠肝损伤的保护作用[J].西南大学学报(自然科学版),2010,32(6):48.
[2]王 荣,林 都,徐晓玉.双花颗粒体外抑菌效果观察[J].西南大学学报(自然科学版),2010,32(6):85.
[3]陈 黎,王启斌,朱海涛,等.HPLC法测定风湿Ⅱ号合剂中绿原酸的含量[J].中国药房,2010,21(31):143.
[4]张 军,庄桂东,韩荣伟,等.TLC-UV法测定金银花中绿原酸[J].食品研究与开发,2008,29(3):122.
[5]刘志梅,韩丹丹,李彩瑞,等.毛细管区带电泳法测定中草药中的有机酸[J].河北农业大学学报,2007,30(6):114.
[6]王瑞明,靳秋萍,郝旭亮,等.薄层扫描法测定口腔宝中绿原酸含量[J].时珍国医国药,2003,14(6):334.