我院2009年2月-2010年2月107例患者应用尼妥珠单抗分析
2011-05-23方青芳裘友好方罗叶晓春林能明浙江省肿瘤医院药剂科杭州市30022浙江省肿瘤医院中西医结合科杭州市30022
方青芳,裘友好,方罗,叶晓春,林能明(.浙江省肿瘤医院药剂科,杭州市 30022;2.浙江省肿瘤医院中西医结合科,杭州市 30022)
近年来,随着药学与分子生物学的飞速发展,恶性肿瘤细胞内的信号转导、细胞凋亡诱导、血管生成及细胞与胞外基质的相互作用等各种基本过程正逐渐被阐明,越来越多的选择作用于特定靶位的高效、低毒、特异性强肿瘤靶向治疗药被研发并用于临床,显示了良好的应用前景。尼妥珠单抗(商品名泰欣生)是首个国内生产的人源化单克隆抗体靶向治疗药(于2008年2月批准上市)。国家食品药品监督管理局(SFDA)批准用于与放疗联合治疗表皮生长因子受体(EGFR)表达阳性的Ⅲ/Ⅳ期鼻咽癌。目前,该药正逐渐被用于其他类型的肿瘤患者[1,2],但该药说明书之外用法的疗效及安全性如何还有待进一步观察。本文调查我院2009年2月-2010年2月尼妥珠单抗的应用状况,分析其临床应用与药品说明书规定适应证相符率,并对近期疗效和不良反应进行评价,为临床用药提供参考。
1 资料与方法
1.1 资料来源
收集我院2009年2月-2010年2月107例患者尼妥珠单抗的应用情况,记录患者的基本信息、诊断、治疗情况、治疗效果和不良反应。其中,男性79例,女性28例,年龄21~82岁,平均50.3岁,所有病例均经组织学或细胞学确诊。
1.2 界定标准
检索国内、外文献,界定文献资料提供的参考适应证。分别按“符合国内说明书用法”、“符合国内、外指南及文献推荐用法”、“其他用法”统计。计算临床诊断与药品说明书适应证、国内外指南及文献推荐用法的相符率。
1.3 疗效评价标准
疾病分期按照国际抗癌联盟(UICC)实体瘤疾病分期标准。按世界卫生组织(WHO)实体肿瘤客观疗效评价标准,分为完全缓解(CR)、部分缓解(PR)、稳定(SD)和进展(PD)。以CR+PR计算客观有效率(ORR),以CR+PR+SD计算临床获益率(CBR)。不良反应按美国国立癌症研究所(NCI 3.0)抗癌药物毒性分级标准及放射治疗肿瘤学组(RTOG)急性放射损伤标准分为0(无)、Ⅰ(轻度)、Ⅱ(中度)、Ⅲ(重度)、Ⅳ(危及患者生命)。剔除使用频次<2的患者5例(鼻咽癌初治2例、下咽癌1例、贲门癌1例、宫颈癌1例),进行近期疗效与不良反应评价。
2 结果
2.1 尼妥珠单抗应用情况统计
2.1.1 疾病分布。107例患者,除鼻咽癌初治组外,其他各组都是晚期经综合治疗后复发或有远处转移的患者,应用尼妥珠单抗患者的疾病分布情况统计见表1。
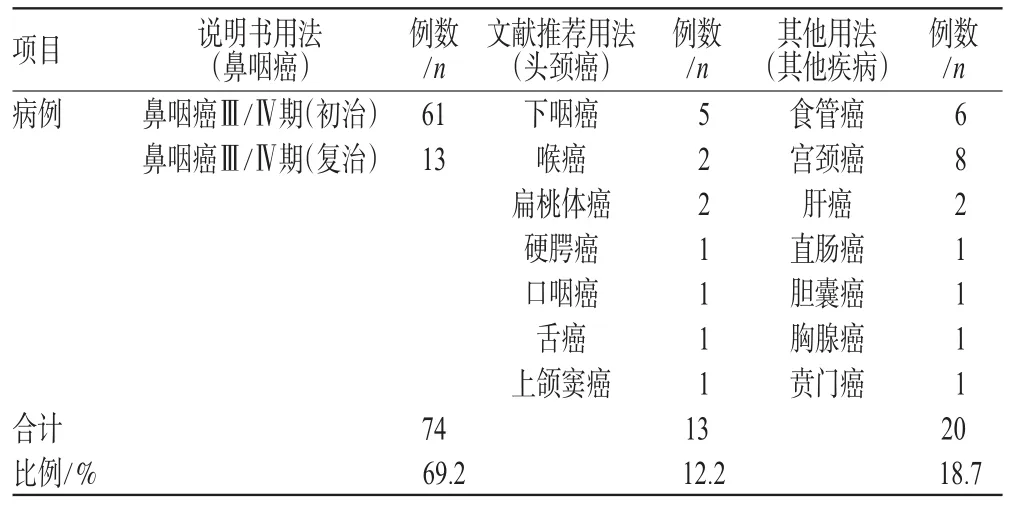
表1 患者的疾病分布情况Tab 1 Disease distribution of patients
2.1.2 治疗情况。鼻咽癌初治患者均采用尼妥珠单抗联合根治性放射疗法,有6例(4例年岁太高,分别为71、76、77、79岁,1例肾功能不全,1例有高血压、糖尿病等多种基础疾病)除外,放射治疗前均接受1~2次PF/TPF/DPF诱导化疗(PF/TPF/DPF:铂类化合物+5-氟尿嘧啶或紫杉醇+铂类化合物+5-氟尿嘧啶或多西他赛+铂类化合物+5-氟尿嘧啶),放射治疗过程中同期铂类化合物化疗增敏。其他患者接受尼妥珠单抗联合姑息性放化疗。同时给予最佳支持治疗。尼妥珠单抗剂量为100 mg或200 mg,每周1次。
2.1.3 尼妥珠单抗使用频次。有88.8%(95/107)的患者完成4周及以上疗程,74.8%(80/107)的患者完成6周及以上疗程。按照尼妥珠单抗在各疾病的分布情况,分为“鼻咽癌组”、“头颈癌组”和“其他疾病组”统计使用频次,结果见表2。
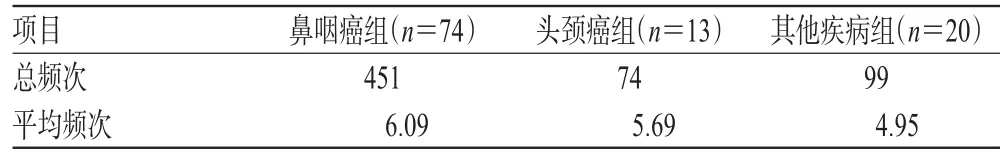
表2 尼妥珠单抗在各组的使用频次统计Tab 2 Frequency of nimotuzumab use in each group
2.2 近期疗效
以治疗结束时为观测点评价各组近期疗效。鼻咽癌初治组有2例因经济原因未完成治疗周期,头颈癌组有1例喉癌因手术切除、1例因经济原因未完成治疗,其他疾病组有2例因疾病进展未完成治疗周期,可评价疗效3组分别为59、11和18例。各组近期疗效情况统计见表3。

表3 各组近期疗效情况统计(n,%)Tab 3 Short-term response of nimotuzumab in each group(n,%)
2.3 不良反应
1例变态反应在第1次用药时出现,临床表现为静脉滴注尼妥珠单抗后约10 min主诉喉咙稍有不适,40 min后患者双眼结膜水肿明显,口唇肿胀,全身发红,停药后用地塞米松+异丙嗪症状缓解,后该患者应用前先用地塞米松+异丙嗪抗过敏,完成4周的治疗未发生变态反应。观察到1例Ⅰ度皮疹,2例发热分别为38.0℃和38.2℃,2例患者诱导化疗后出现腹泻。口腔黏膜反应、皮肤反应、乏力以及骨髓抑制等放、化疗相关的不良反应常见,经积极处理后均可控制。患者不良反应情况统计见表4。

表4 患者不良反应情况统计(n,%)Tab 4 Adverse drug reactions of patients(n,%)
3 讨论
EGFR为一种具有酪氨酸活性的跨膜受体,可由多种配基包括表皮生长因子(EGF)和转化生长因子-α(TGF-α)激活,在多种肿瘤的形成和播散中起到重要作用,鼻咽癌、头颈癌、结直肠癌、胰腺癌、神经胶质瘤、非小细胞肺癌、乳腺癌等多种肿瘤细胞中常可检测到EGFR的过度表达。作为新型的抗体靶向药,尼妥珠单抗可竞争性地抑制内源性配体与EGFR的结合,进而阻滞EGFR二聚体的形成、酪氨酸激酶磷酸化及其信号转导,由此抑制癌细胞的增殖、新生血管生成、转移,促进凋亡等。然而,对于尼妥珠单抗的临床应用情况和临床疗效的报道甚少,本文通过对107例应用尼妥珠单抗患者的临床信息进行调研,系统分析尼妥珠单抗的临床疗效、不良反应和临床应用情况。
3.1 治疗效果
尼妥珠单抗疗效和生存受益方面,国外的研究取得了令人鼓舞的结果。在古巴[3]进行的一项随机双盲临床试验,收集了106例不适合放、化疗的头颈部鳞状细胞癌患者,对照组给予安慰剂和放疗。与对照组比较,治疗组(尼妥珠单抗加放疗)CR非常明显,为59.5%,而对照组仅为34.2%,用Harrington-Fleming检验患者生存趋势,治疗组的生存率明显提高。所有患者的生存质量都得到明显的改善并减少了疾病的一般和特殊症状。西班牙的Rojo F等[4]报道了尼妥珠单抗200/400 mg连续8周联合放疗治疗晚期头颈部肿瘤,结果ORR为80%(2例CR,6例PR)。另外,有研究者报道,在神经胶质瘤[5]、非小细胞肺癌[6]等多种说明书之外的肿瘤治疗中,尼妥珠单抗也显示了良好的疗效和生存受益。本次调研以治疗结束时为观测点评价各组近期疗效。鼻咽癌初治组ORR为96.6%。除初治组外,其他各组都是晚期经综合治疗后复发或有远处转移患者,鼻咽癌复治组、头颈癌组、其他疾病组ORR分别为61.5%、36.4%、22.2%。鼻咽癌复治组、头颈癌组、其他疾病组的CBR分别为100%、100%、66.7%。对于晚期进展的头颈癌、直肠癌等EGFR高表达的恶性肿瘤,尼妥珠单抗显示了良好的临床获益。
3.2 不良反应
尼妥珠单抗总体的不良反应较轻,患者均可耐受,本研究观察到1例变态反应,但对症治疗后患者仍完成治疗周期,没有发生因不良反应而中止治疗的病例。其他的不良反应如口干、口腔黏膜炎、照射部位的皮肤反应、疼痛反应以及骨髓抑制等与其他放疗和/或化疗相仿,可以认为是放、化疗相关的不良反应。值得一提的是,尼妥珠单抗皮肤毒性反应轻微,本次调研中出现皮疹1例,这与文献报道的皮肤毒性发生率较少相一致[3],表现为颈部、胸前区皮肤多发皮疹,全身皮肤发痒,皮肤无破损,无胸闷气促不适。而其他EGFR抑制剂如西妥昔单抗,与其相关的皮肤毒性发生率高达49%~88.6%[7~9]。国外学者Rojo F等[10]正在寻找存在差异的进一步的理论基础。另外,本文观察到的2例腹泻患者为诱导化疗后出现,其他单克隆抗体[11,12]应用中出现的3~4级胃肠道反应在尼妥珠单抗的给药过程中没有发生。
3.3 超说明书范围应用情况
药品说明书是药物用于疾病预防、诊断和治疗时的有效法律依据,国家规定临床医师必须依照药品说明书进行规范应用药物以确保医疗安全。本文调研尼妥珠单抗的临床应用情况,结果显示符合国内说明书适应证范围的相符率为69.2%,符合国内、外文献资料提供的参考适应证为12.2%,有18.7%用于“说明书适应证、国内外指南及文献推荐”之外的用法,略高于国内文献报道的水平(11.0%)[13]。分析超药品说明书适应证范围存在的原因,可能有以下几点:(1)从药理学作用机制分析,对EGFR高表达的其他肿瘤,EGFR抑制剂应该也有治疗效果;(2)部分超说明书的用法有文献支持,并且符合相应的循证学证据;(3)在经过经典的、标准的治疗方案治疗后,给病情进展的肿瘤患者提供新的、未经证实有效的治疗方法符合伦理学要求,也有利于医学的发展和提高;(4)药品说明书相对于国内、外开展的临床试验和出台的治疗指南有一定的滞后性,无法完全涵盖该药目前的治疗信息。有学者提出“为了更深刻地认识药品,更深入地研究药品,药品说明书之外的用药不可避免,也不可能杜绝”[14]。但是,药品说明书具有法律效力,超药品说明书用药不受法律保护,由此产生的法律责任,应由医师、药师承担。对于新上市的新药,医师和药师必须做到谨慎行事和充分履行告知义务,以减少医疗纠纷。
综上,在本研究中尼妥珠单抗总体不良反应较轻,与放疗合用可使临床获益。此外,尼妥珠单抗临床存在超说明书适应证范围应用现象,部分超说明书适应证应用的情况虽也能使患者受益,但仍需更为确切的循证学证据和临床实践的依据,从而保证其临床应用的安全性和有效性。
[1]吴润叶,高 黎,杨伟志,等.头颈部癌表皮生长因子受体表达及对预后判断价值[J].肿瘤学杂志,2007,13(5):384.
[2]Judith L,Ilona S,Georg MS,et al.EGFR inhibition as a therapy for head and neck squamouscell carcinoma expert opin[J].Investig Drugs,2008,17(10):1517.
[3]Marta O,Teresa C,Ramondel C,et al.Nimotuzumab plus radiotherapy for unresectable squamous-cell carcinoma of the head and neck[J].Cancer Biol Ther,2010,9(5):343.
[4]Rojo F,Gracias E,Villena N,et al.Pharmacodynamic study of nimotuzumab,an anti-epidermal growth factor receptor(EGFR)monoclonal antibody(mAb),in patients with unresectable squamous cell carcinoma of the head and neck(SCCHN):A SENDO foundation study[J].J Clin Oncol,2008,26(20 Suppl):6070.
[5]Bode U,Buchen S,Warmuth-Metz M,et al.Final report of a phaseⅡtrial of nimotuzumab in the treatment of refractory and relapsed high-grade gliomas in children and adolescents[J].J Clin Oncol,2007,25(20 Suppl):2006.
[6]Bebb G,Smith C,Rorke S,et al.PhaseⅠ clinical trial of the anti-EGFR monoclonal antibody nimotuzumab with concurrent external thoracic radiotherapy in Canadian patients diagnosed with stageⅡb,Ⅲ orⅣ non-small cell lung cancer unsuitable for radical therapy[J].Cancer Chemother Pharmacol,2011,67(4):837.
[7]Vermorken J,Trigo J,Hitt R,et al.Open-label,uncontrolled,multicenter phaseⅡstudy to evaluate the efficacy and toxicity of cetuximab as a single agent inpatients with recurrent and/or metastaticsquamous cell carcinoma of the head and neck who failed to respond toplatinum-based therapy[J].J Clin Oncol,2007,25(16):2171.
[8]Burtness B,Goldwasser M,Flood W,et al.PhaseⅢ randomized trial of cisplatinplus placebo compared with cisplatin plus cetuximab in metastatic/recurrent headand neck cancer:an Eastern Cooperative Oncology Group study[J].J Clin Oncol,2005,23(24):8646.
[9]Francisco R,George B,Roy SH,et al.PhaseⅠ/Ⅱa study of cetuximab with gemcitabine plus carboplatin in patients with chemotherapy-naive advanced non-small-cell lung cancer[J].J Clin Oncol,2005,23(36):9089.
[10]Rojo F,Gracias E,Villena N.Pharmacodynamic trial of nimotuzumab in unresectable squamous cell carcinoma of the head and neck:a SENDO Foundation study[J].Clin Cancer Res,2010,16(8):2474.
[11]Tejpar S,Piessevaux H,Claes K,et al.Magnesium wasting associated with epidermal-growth-factor receptor-targeting antibodies in colorectal cancer:a prospective study[J].Lancet Oncol,2007,5(5):387.
[12]Giusti RM,Cohen MH,Keegan P,et al.FDA review of a panitumumab(Vectibix)clinical trial for first-line treatment of metastatic colorectal cancer[J].Oncologist,2009,4(3):284.
[13]薛丽萍,汪 琪.儿科超药品说明书用药的调查分析[J].中国药房,2008,19(4):315.
[14]昝日增,宋霄宏.《处方管理办法(试行)》新规定与药品说明书之外用药的矛盾及对策[J].中国药房,2006,17(2):1750.
