微绿苎麻玻璃化超低温保存初步研究
2011-05-23陈建华栾明宝王晓飞孙志民
许 英,陈建华,栾明宝,王晓飞,孙志民
(中国农业科学院麻类研究所,湖南 长沙410205)
苎麻(Boehmeria nivea(L.)Gaud.)属于荨麻科(Urticaceae)苎麻属(Boehmeria),素有“中国草”之称。根据瓦维洛夫的观点,苎麻起源于中国的中部和西部[1]。中国是世界上苎麻种植历史最久、种植面积最大的国家。苎麻种质资源是育种、科研、教学及生产的物质基础,历年来采用田间种植集中保存,这种保存方式难以切断各种质间病害的传播和有效地抵御自然灾害。如国家种质苎麻圃1963年的苎麻青枯病害,资源全部感染,最后焚烧重新建圃;1996年的沅江洪水灾害,圃中1000多份种质丢失[2]。为了安全、稳定地保存种质,对苎麻资源的保存方式进行创新显得非常必要。超低温保存能够减少植物间病毒传播,抵御外界自然环境变化的影响,而且植物材料的代谢和生长活动在液氮液相(-196℃)或液氮雾相(-150℃)的超低温条件下几乎停止,植物材料处于相对稳定的生物学状态,能够有效保持材料的遗传稳定性,同时又不会丧失其形态发生的潜能,理论上能够无限期地保存植物材料[3-10]。迄今为止在国内外进行过超低温保存的植物材料已达200多种,有谷类、豆类、薯类、花卉等[11-16],本试验以苎麻近缘野生种微绿苎麻为研究材料,通过PVS2保护试剂玻璃化包埋,进行超低温保存技术研究,目的为苎麻种质资源保存方式创新提供新的思路。
1 材料与方法
1.1 材料
供试材料为从广西那坡县定业乡征集的苎麻近缘野生种微绿苎麻,它种植于国家种质苎麻圃。从圃中取材消毒,进行无性繁殖培养,得到组培苗。
1.2 方法
1.2.1 培养条件
组织培养温度控制在26℃左右,光照强度为1500Lux左右,每天光照时间14h。超低温保存之后,先暗培养3-7天。
1.2.2 培养基的设计
根据以前报道的苎麻组织培养研究结果和笔者多年苎麻组织培养实践[17],发现改良后的MS培养基即1/2MS培养基最适合苎麻的外值体生长,故本研究中的基本培养基为1/2MS培养基,通过添加不同种类和浓度的激素来调节培养基,对“微绿苎麻”外植体进行快繁,每天对外植体生长情况进行记载、对比及分析,以此筛选合适的培养基。
1.2.3 玻璃化超低温保存流程
微绿苎麻玻璃化超低温保存的流程为:预培养、装载、冷冻、解冻、TTC检测、恢复培养。玻璃化超低温保存具体操作如下:将微绿苎麻的腋芽和茎尖分别置于添加了30~60g/L的蔗糖含量的1/2MS+6BA(0.5mg/l)和1/2MS+6BA(1.0mg/l)的培养基中预培养1-4天;超净工作台上,取外植体置入2 mL冷冻管中,用1/2MS+0.4 mol/L蔗糖+2 mol/L甘油溶液装载,转入冰冻保护剂PVS2中(30%甘油+15%乙二醇+1 5%D MS O+0.4 mol/L蔗糖),置入程序降温盒(每分钟降1℃),在-80℃的超低温冰箱中预冷,再放于-196℃的液氮中进行保存,保存1-2天之后,立即置于40℃的水浴锅中进行快速化冻;吸去PVS2保护试剂溶液,经过消毒的1/2MS液体培养基洗涤3-4次,置于筛选好的1/2MS培养基上进行复活培养和TTC细胞活力检测。
1.2.4 细胞活力检测
超低温保存后的微绿苎麻外植体采用氯化三苯四氮唑(TTC)法检测活力[18],它的试剂配比是1%氯化三苯四氮唑:0.4mol/L琥珀酸钠:pH7.0的0.1mol/L磷酸缓冲液=1:5:4。取冷冻洗涤后的苎麻外植体,滤纸吸去水分,加入TTC试剂,在黑暗下于37℃培养箱中培养3小时后,吸去TTC溶液,用蒸馏水洗涤3次。在解剖显微镜下观察,计算染色率。
2 结果与分析
2.1 微绿苎麻的组织培养研究
取微绿苎麻组培苗的腋芽和茎尖,以1/2MS培养基为基本培养基,通过添加不同的激素进行培养,得到茎尖或腋芽直接生长的苗,每个配比都为50个外植体,三次重复。经过大量的试验发现,在仅添加6BA的情况下,两个外植体的出苗率最高。然后对添加不同含量的6BA进行比较研究,结果见表1。从表中可见,微绿苎麻在6BA为0.5mg/l的激素配比下腋芽的出苗率最高,达到94.7%,在6BA为1.0mg/l的激素配比下茎尖的出苗率最高达到75.10%。在外植体获得方面,腋芽的操作相对于比较简单,而茎尖需要借助解剖镜才能获得,操作比较复杂;在出苗率方面,腋芽的成苗能力强于茎尖,腋芽增殖的苗为丛生苗,茎尖成苗为单株,并且茎尖在直接成苗的过程中容易长愈伤。
2.2 不同的装载时间和PVS2处理时间对微绿苎麻超低温保存的影响

表1 在6BA影响下腋芽和茎尖的出苗百分率情况Table 1 The effect of6BAon propagations ofaxillarybuds and shoot tips
在植物超低温保存研究过程中,通常玻璃化溶液(PVS)快速脱水之前,有一个所谓装载(1oading)的过程,即用一个较高浓度的混合液于室温下预处理一定时间,进一步降低植物组织含水量,避免由于渗透压变化剧烈对研究材料造成的伤害。本试验采用研究者常用的1/2MS+0.4mol/L蔗糖+2 mol/L甘油溶液为装载液体,以腋芽为研究的外植体,采用了0min,10min,20min,30min,40min5个时间段进行比较研究,从图1中结果可以发现装载20min时成活率明显高于其它装载时间。装载之后的外植体添加PVS2保护剂,进一步脱去水份,PVS2保护剂缓慢的渗透到植物的组织中,当外植体表现为玻璃化状态的时候,在液氮中可以有效的保护细胞的结构,但是由于保护剂中含有剧毒的二甲基亚砜,如果处理时间太久会使外植体中毒或产生变异,处理时间太短难以有效的保护外植体免受冻伤。在本实验中采用了5个不同的时间对外植体进行了处理,结果发现在处理10分钟后,TTC检查的成活率最高,随着处理的时间增加成活率急剧下降,在30分钟的时候成活率只有1.06%。
2.3 不同预处理时间和蔗糖含量对超低温保存后成活率的影响
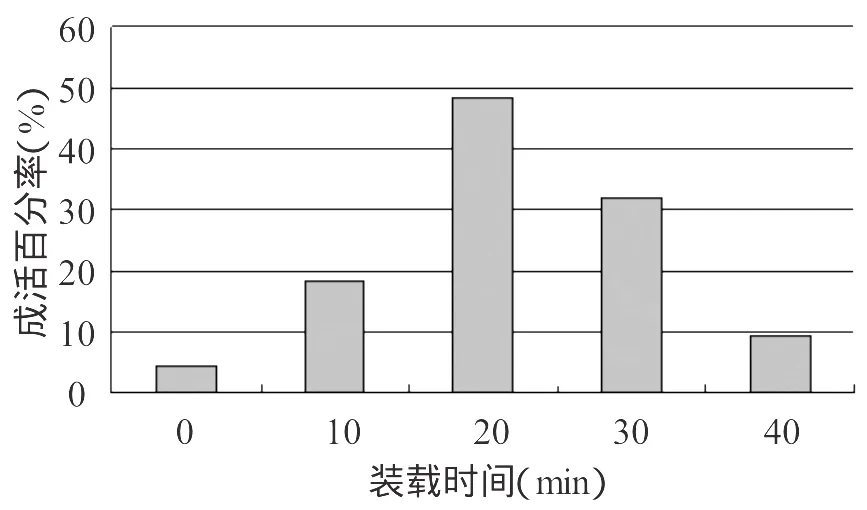
图1 不同的装载时间对微绿苎麻超低温保存的影响Fig.1 Effects of different loading time on the survival rate after cryopreservation
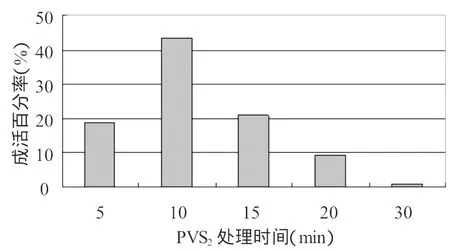
图2 不同的PVS2溶液处理时间对微绿苎麻超低温保存的影响Fig.2 Effects of different treating time with PVS2on the survival rate after cryopreservation
在使用1/2MS+0.4mol/L蔗糖+2mol/L甘油装载20min,添加PVS2处理10min后,梯度降温到-70℃,转入液氮中保存。具体结果见表2。从表2中可以发现在蔗糖含量和预培养时间两种因素的影响下,腋芽在培养基中蔗糖含量为40g/L,预培养2天的状态下TTC检测成活率最高为48.67%。茎尖在培养基中蔗糖含量为50g/L,预培养2天的成活率最高为21.38%。
2.4 超低温保存后恢复性培养研究
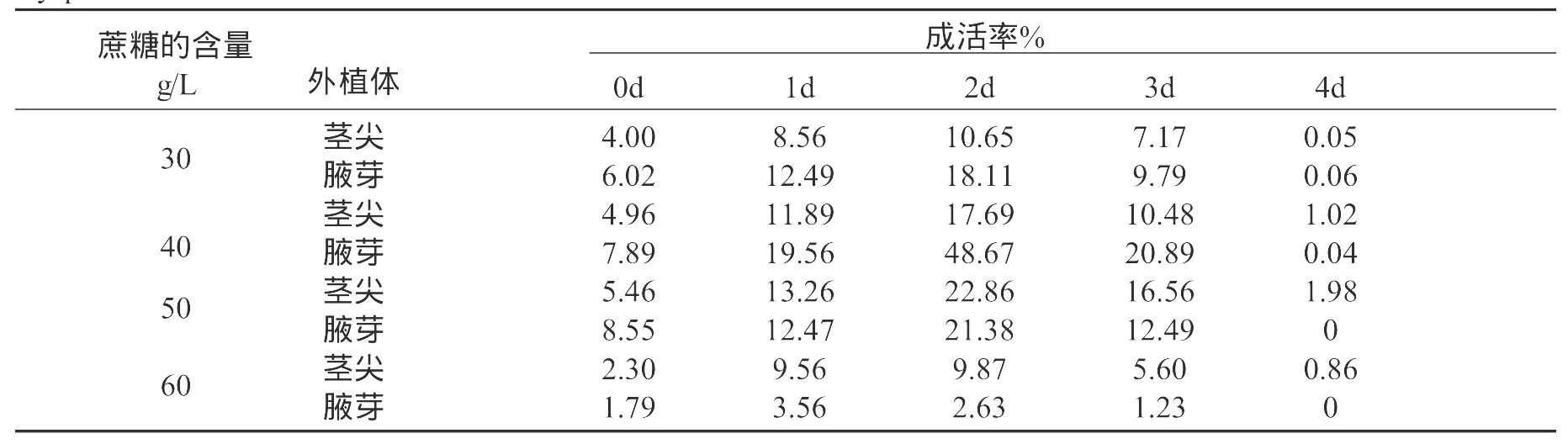
表2 不同预培养时间和蔗糖含量对微绿苎麻超低温保存成活率的影响Table 2 Effect of different preculture time and different contents of sucrose in culture medium on the survival rate after cryopreservation
超低温保存后从液氮中取出后,在40℃水浴锅中迅速解冻2分钟,再用1/2MS液体培养基清洗3次,吸干水置于筛选好的1/2MS培养基(见2.1)中,置于26℃培养箱中暗培养3-7天,取出置于人工培养箱常规培养。通过培养发现,开始的时候外植体部分变褐,10天左右慢慢的变绿,直接长苗;有些变黄软化失去活力。目前为止,获得完整的恢复苗11株,并且全部为腋芽生长出来的。
3 讨 论
从本试验结果可以看出,腋芽和茎尖两种外植体经过玻璃化超低温保存之后,都可以通过TTC检测到活力。在其它植物超低温试验中,试管苗的茎尖作为超低温保存的外植体比其它器官或组织具有易于再生、脱水损伤小等优势。但是从本试验中的结果可以看出,增殖培养的时候腋芽出苗率最高达94.7%,茎尖出苗率为75.10%,腋芽出苗率明显高于茎尖出苗率,经过超低温保存之后的TTC检测成活率腋芽同样优于茎尖,在超低温保存后,恢复培养的时候只有腋芽得到苗,笔者认为对于微绿苎麻采用腋芽作为超低温保存的材料最适合,并且在菊花、柿和君迁子的超低温保存中有同样的情况[19]。
适应微绿苎麻外植体的预培养时间为2天,预培养蔗糖的含量腋芽为40g/L,茎尖为50g/L,装载的时间为20min,PVS2处理的时间为10min。在其最佳配比之下腋芽的TTC检测活力最高达到了48.67%,茎尖达到了21.38%,在恢复培养试验中只有腋芽生长出了11株苗。通过分析和查阅资料,笔者认为有可能和微绿苎麻这种植物不耐渍和酚类物质含量高易氧化有关,尽管在PVS2保护剂中加入了PVP来防止氧化,但是在恢复培养的过程还是慢慢的褐化。恢复生长是一个复杂的过程,并不是TTC检测出有多少活力它就生长出多少苗,它只是个初步评价,仅表现为超低温保存后被检测出有活力的外植体有可能长出苗,没有活力的一定不能够生存。
迄今为止,超低温保存被科学家认为是无性繁殖植物长期保存的理想方法,它的原理是植物材料的代谢和生长活动在液氮液相(-196℃)或液氮雾相(-150°C)的超低温条件下几乎停止,植物材料处于相对稳定的生物学状态,因此能够有效保持材料的遗传稳定性,同时又不会丧失其形态发生的潜能,理论上能够无限期地保存植物材料。它属于室内保存技术,相对于田间保存需要的空间比较小,劳动力强度小,使用方便,不受外界环境条件的影响,并且可以隔离各个种之间的病毒传播。尽管在此研究中获得了TTC检测活力最高达到48.67%,恢复培养中获得了11株苗,离实际的应用要求还有很大的距离,笔者觉得作为无性繁殖的植物苎麻来说超低温保存的研究和应用意义重大,下一步将更加深入的对苎麻超低温保存进行研究,特别是恢复培养的方法,提高出苗率。
[1] 中国农业科学院麻类研究所.中国苎麻品种志[M].北京:农业出版社,1992:2-3.
[2] 中国农业科学院麻类研究所.中国农业科学院麻类研究所所志(1958-1997)[M].北京:中国农业科技出版社,2008.
[3] 卢新雄,等.农作物种质资源保存技术规程[M].北京:中国农业出版社.2008.
[4] 刘丽芳,等.甘薯种质超低温保存研究进展[J].植物遗传资源学报.2009,10(2):324-327.
[5] 苗琦,谷运红,等.植物组织培养物的超低温保存[J].植物生理学通讯.2005,41(3):350-354.
[6] Engelmann F.Plant cryopreservation:progress and prospects.In VitroCellular&Developmental[J].Biologyof Plant,2004,409(5):427-433.
[7] Mitsuteru S,Pramod T,Masaya I,Takayuki T.Development of a new vitrification solution,VSL,and its application to the cryopreservation ofgentian axillarybuds[J].Plant Biotechnol Rep,2008(2):123-131.
[8]Leena Ryynänen,Tuija Aronen.Verifications,a complementarycryopreservation method for Betula pendula Roth[J].Cryobiology,2005(51):208-219.
[9] 陈珊.花粉超低温保存的研究和应用进展[J].安徽农学通报,2007,13(7):39-40.
[10] 王培忠,裴崎君,等.植物种质资源超低温保存原理与研究进展[J].吉林农业科技,2007,36(4):17-20.
[11] 李广武,郑从艺,唐兵.低温生物学[M].长沙:湖南科技出版社.1998:289-295.
[12] 陈辉,陈晓玲,等.切花百合离体茎尖玻璃化法超低温保存研究[J].植物遗传资源学报.2007,8(2):170-173.
[13] 石思信,曹心如.草莓丛生芽超低温(-196℃)保存[J].园艺学报.1992,19(1):83-84.
[14] 刘剑锋,阎秀峰,等.高山红景天愈伤组织的超低温保存[J].林业科学.2007,43(6):57-60.
[15] 张演义,孙仲序等.超低温保存果树种质资源研究进展.山东林业科技.2002,138(1)45-47
[16] 刘亚军,高丽萍,等.茶悬浮培养细胞玻璃化超低温保存研究[J].茶叶科学,2009,29(2):120-126.
[17] 许英,陈建华,等.中苎1号组织培养及无性快繁的研究[J].中国麻业科学,2010,32(2):89-93.
[18] http://bbs.biogo.net/simple/t154131.html
[19] 刘艳霞,刘杜长,等.菊花茎尖的玻璃化超低温保存研究[J].植物遗传资源学报,2009,10(2):249-254.
