亚麻脱胶菌HW201的培养条件优化
2011-05-23曹亚彬奚新伟吴皓琼郭立姝牛彦波
曹亚彬,奚新伟,吴皓琼,郭立姝,牛彦波,殷 博
(黑龙江省科学院微生物研究所,哈尔滨 150010)
自上世纪50年代,我国的科技工作者就开展了加菌温水沤麻方面的研究与应用工作,随后进行的工作对技术进行了补充和创新,高性能的菌株不断涌现,应用效果不断提高。现有的研究报道中,使用的菌株集中在芽孢杆菌属,分别使用了厌氧芽孢杆菌、枯草芽孢杆菌、费氏芽孢杆菌、环状芽孢杆菌、地衣芽孢杆菌等。在使用效果上达到了缩短沤麻周期、提高出麻率、改善纤维质量及减少污水排放等目的。加菌温水沤麻技术能够解决亚麻原料企业生产中的实际问题,但菌剂的高成本也是限制该项技术应用的因素之一。在本文中,以降低生产成本为目的,研究了适合工业化生产的培养基配方组成和培养条件。
1 材料与方法
1.1 试验材料:本单位分离保藏的枯草芽孢杆菌(Bacillus subtilis)HW201,化学试剂为分析纯,玉米面、豆粕粉市场采购,生产试验用磷酸氢二钾、碳酸钙为市场采购的工业产品。
1.2 测定方法:菌体计数采用平板计数法[1];使用数显型酸度计PHS-3C直接测定培养液的pH;采用DNS比色法测定总糖[2]。
1.3 芽孢率测定方法:待测样品1.0mL,加入到9mL的90℃以上水中,迅速混匀后加入到沸水浴中处理10min,取出迅速冷却到室温。以此为基础样本进行平板培养计数,统计代表样品中芽孢数量。以未经热处理的原始样品为对照测定菌体总数,两者的百分比为芽孢率。
1.4 杂菌率测定方法:在平板培养基上生长的非目的菌落,视为杂菌,杂菌占菌落总数的百分比即为杂菌率。
1.5 培养基优选试验[3]:依据34正交表中的要求配制培养基,培养基100mL装入250mL三角瓶中,1.0kgf/cm2压力下灭菌。接种枯草芽孢杆菌HW201菌悬液1.0mL,摇床120r/min、32℃下培养48hr。试验数据利用Latin统计学软件进行处理。
1.6 生产试验:在黑龙江省生物技术工程中心的2m3和5m3的发酵设备中进行。以玉米面1.5%,豆粕粉1.5%,磷酸氢二钾0.4%,碳酸钙0.4%和适量的消泡剂组成生产用培养基,培养条件为温度32±1℃、通风量 1:0.8、时间 60hr。
1.7 固体菌剂制备:以液体方式生产的菌液,以2.5:1的固液比,用80目稻壳粉吸附,60℃低温烘干24hr后备用。
2 结果与讨论
2.1 培养基组成优选
2.2 培养条件
表1 正交表的试验设计(水:100mL)Table 1 The orthogonal experimental design(water:1000mL)
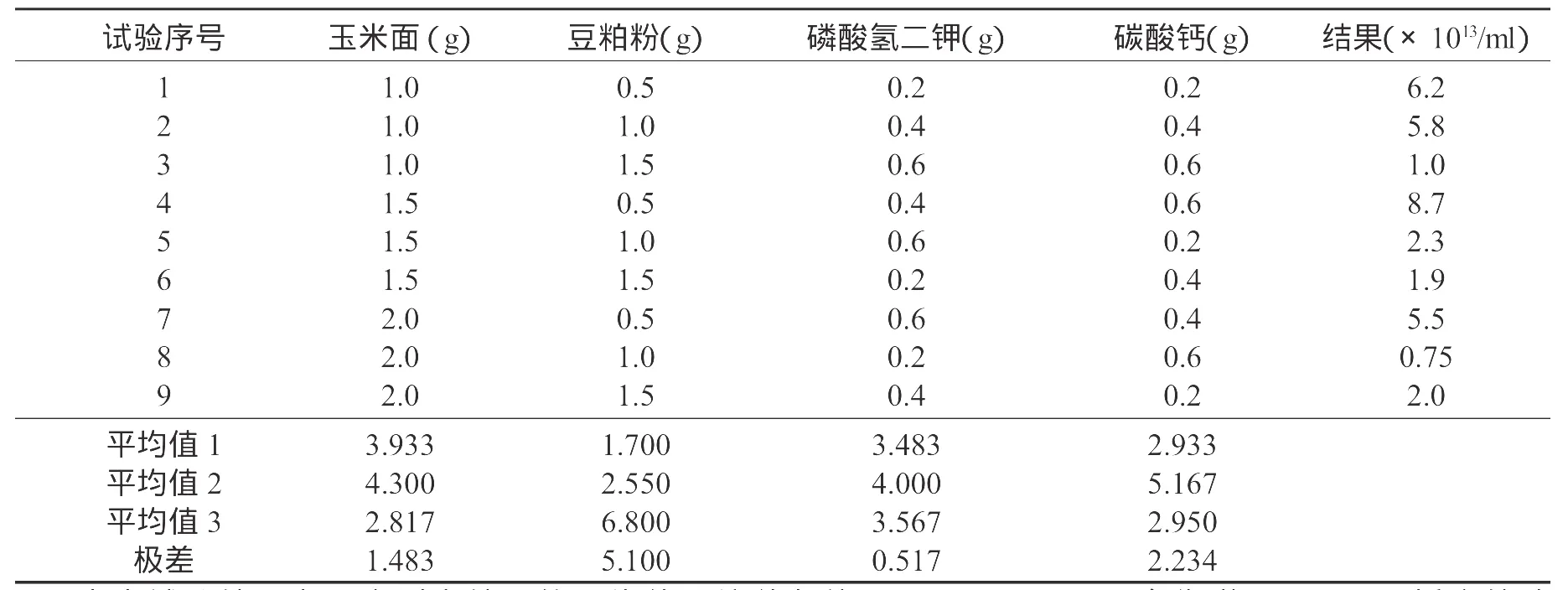
表1 正交表的试验设计(水:100mL)Table 1 The orthogonal experimental design(water:1000mL)
表中试验结果为三次测定结果的平均值;培养条件:31±1℃,250mL三角瓶装量100mL,摇床转速120r/min,48hr。
?
以正交试验得到的最佳培养基进行培养条件试验,具体的培养条件根据试验要求进行调整,试验的结果列于图2。试验结果表明,枯草芽孢杆菌HW201的最佳培养温度36℃,在30~38℃之间生长良好,在26℃时也有一定的生长能力;枯草芽孢杆菌HW201适宜在中性(pH6.5~7.5)条件下生长,超出此范围生长受到明显影响,相比较而言,碱性条件的影响较弱。对摇床转速的试验结果表明,随转速的提高,菌体浓度呈上升趋势,说明增加通气提高培养基中氧含量有利于菌体的生长,总体上分析,转速对菌体生长的影响小于温度和pH。培养过程中菌体数量、pH、总糖的变化列于图3中,在培养过程中,随菌体数量的生长,总糖不断下降,在48hr后两者达到稳定,菌体数量达到1014个/mL以上。培养液颜色在36hr~48hr内开始出现变化,逐渐由黄、青、青灰、灰褐至黑褐色。由于培养基中使用碳酸钙作为pH缓冲剂,培养过程中pH比较平稳,保证了菌体在适宜的pH下快速生长。
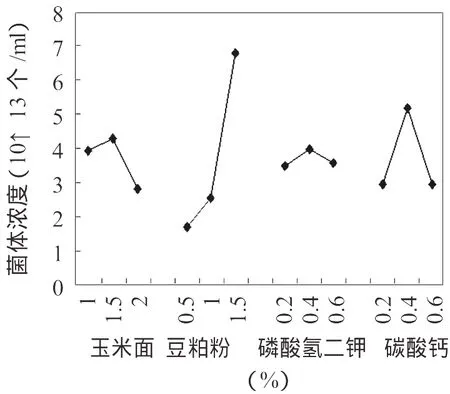
图1 单因子直观分析Figure 1 The visual analysis ofsingle factor

图2 枯草芽孢杆菌HW201的培养条件Figure 2 The culture condition ofBacillus subtilis HW201
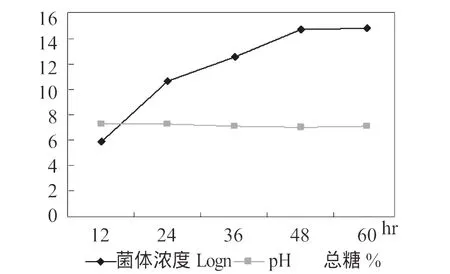
图3 枯草芽孢杆菌HW201培养过程中成分变化Figure 3 The changes ofcomponents in the trainingprocess for Bacillus subtilis HW201
2.3 生产试验结果
以玉米面1.5%,豆粕粉1.5%,磷酸氢二钾0.4%,碳酸钙0.4%和适量的消泡剂组成生产用培养基,控制培养条件为温度32±1℃、通风量1:0.8,分别在2m3和5m3的发酵罐中进行生产试验(表2)。菌体生长在24hr后进入旺盛生长期,培养进行到48hr时进入稳定生长期,菌体浓度分别达到1.1×1014cfu/mL和2.3×1014cfu/mL,芽孢率分别为12.4%和10.1%;在60hr培养结束,芽孢率分别达到22.3%和21.5%,菌体的浓度分别达到2.4×1014cfu/mL与4.8×1014cfu/mL。在产品分装后的液体贮存过程中,菌体浓度在15d内迅速下降,由2.4×1014cfu/mL下降到7.6×1011cfu/mL,芽孢率迅速上升,由22.3%上升到64.6%,也开始出现轻微的污染,杂菌率为1.37%。此后菌液保存到30d时,菌体浓度、芽孢率变化不大,杂菌率显著上升达到7.33%。发酵罐生产出的菌液以2.5:1的固液比,用80目稻壳粉吸附,60℃低温烘干24hr后,水分降低到4.3%。以此作为固体菌剂进行贮存试验,初始固体菌剂的菌体数量达到8.4×1013cfu/g,芽孢率达到86.4%;在贮存过程中,菌体数量呈下降趋势,芽孢率呈上升趋势,但幅度不大;在试验的过程中无杂菌污染发生。两种菌剂相比,固体菌剂有明显的优势,有利于菌体的贮存和使用。
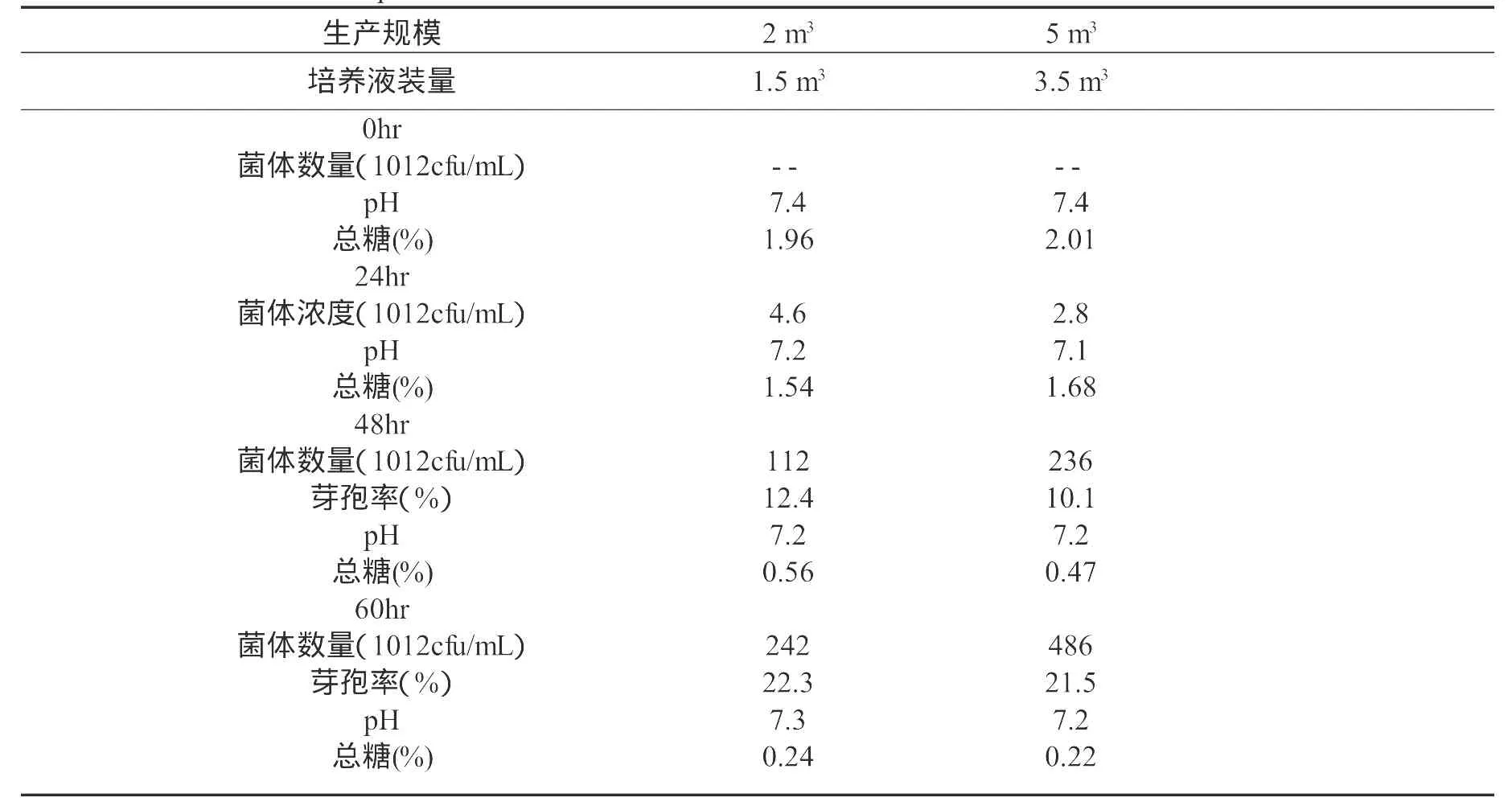
表2 枯草芽孢杆菌HW201生产试验培养结果Table 2 The culture result ofproduction test for Bacillus subtilis HW201
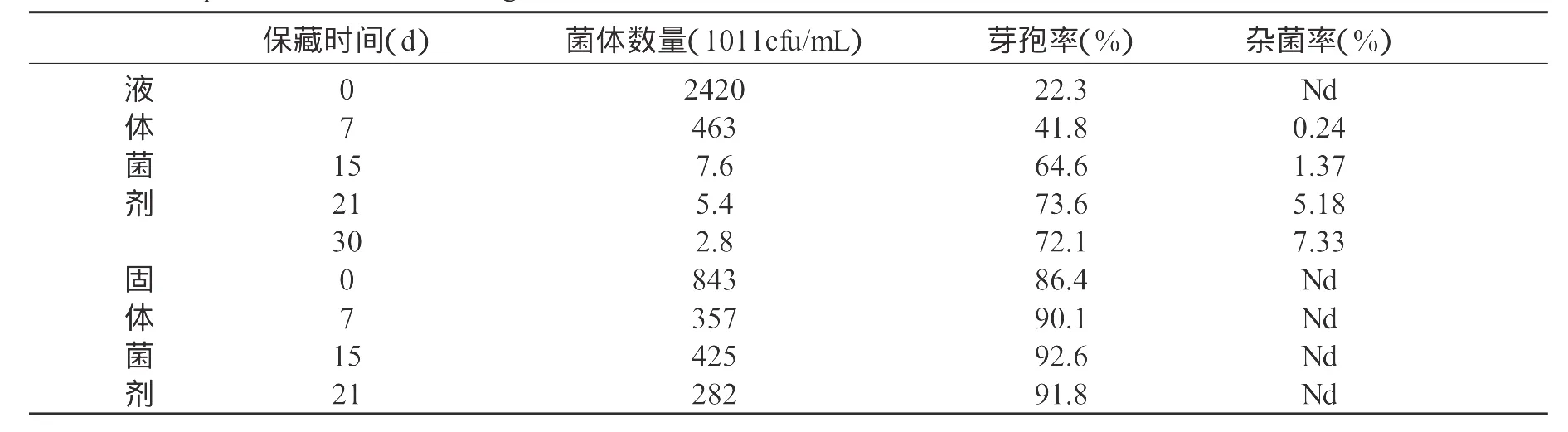
表3 枯草芽孢杆菌HW201菌剂贮存试验Table 3 The preservation test for the agent ofBacillus subtilis HW201
3 讨 论
枯草芽孢杆菌(Bacillus subtilis)是比较常见的微生物菌群,在工农业生产中有较多应用,对该属微生物的研究很深入。本文研究的用于沤麻的枯草芽孢杆菌,在培养方式上与其他的芽孢杆菌基本一致,无特殊的营养要求,可以用常规的发酵技术和低成本的培养基对其进行大规模的培养。在贮存过程中,液体中菌体出现大量的死亡,数量急剧下降,其原因是⑴密闭包装造成的厌氧环境,不适合这种芽孢杆菌的生长,出现生理性死亡;⑵在液体条件下有利于各种自溶酶发挥作用,不利于菌体的休眠,加速了菌体的死亡速度。而固体菌剂中的菌体处于休眠状态,有利于产品保存,对整体技术的推广使用有重要作用。
[1] 周德庆.微生物学实验手册[M].上海:上海科学技术出版社,1986.
[2] 宁正祥.食品成分分析手册[M].北京:中国轻工业出版社,1997.
[3] 栾军.现代实验设计优化方法[M].上海:上海交通大学出版社,1995.
[4] 刘晓兰,郑喜群,等.生物法亚麻原茎脱胶过程及新工艺[J].应用与环境工程学报.2001,4:392-395.
[5] 彭源德,刘正初,等.亚麻快速生物脱胶技术研究I亚麻快速脱胶菌株的选育[J].中国麻业,2003,25(3):135-138.
[6] 葛菁萍,凌宏志,等.果胶酶产生菌的分离及培养条件研究[J].中国生物工程杂志,2004,24(8):93-95.
[7] 黄小龙,孙焕良,等.南方亚麻微生物脱胶技术及其理论研究Ⅱ主要外界因子对果胶酶及亚麻脱胶效果的影响[J].中国麻业,2003,25(4):193-195.
[8] 郑喜群,刘晓兰,等.亚麻生物脱胶新方法及其比较[J].纺织学报,2001,22(4):231-234.
[9] 何连芳,孙玉梅,等.亚麻微生物脱胶优势菌的选育及其应用[J].工业微生物,2005,35(4):25-28.
[10]黄小龙,孙焕良,等.南方亚麻微生物脱胶技术及其理论研究Ⅳ酶法脱胶菌种的分离与鉴定 [J].湖南农业大学学报,2004,30(1):14-16.
[11] 田英华,刘晓兰,等.果胶酶高产菌Aspergillus niger HYA4的选育[J].齐齐哈尔大学学报,2005,21(1):12-14.
[12] 王玉富.我国亚麻生物技术的研究现状及发展[J].中国麻业,2005,27(2):11-14.
[13] 陈灿,孙焕良,等.南方亚麻微生物脱胶技术及其理论研究2麻茎特性对亚麻脱胶的影响 [J].中国麻作,2000,22(2):37-40.
[14] 黄小龙,孙焕良,等.南方亚麻天然水沤法脱胶影响因子的研究[J].湖南农业大学学报,2003,29(4):271-274.
[15] 江洁,刘晓兰,等.添加NH4HCO3对亚麻生物脱胶的影响[J].应用与环境生物学报,2004,10(1):53-55.
[16] 贾新禹,李明,等.脱胶过程中亚麻纤维品质变化特点研究[J].东北农业大学学报,2007,382(5):598-601.
[17] 吴丽艳,段继强.等,亚麻脱胶茵的分离、筛选和鉴定[J].云南大学学报,2007,29(4):419-423.
