坎地沙坦抑制小鼠视网膜新生血管的实验研究
2011-05-21王嘉俊刘鹤南陈晓隆
李 迅,王嘉俊,刘鹤南,陈晓隆
在增殖性视网膜病变的发生、发展过程中,肾素-血管紧张素系统中主要效应介质AngⅡ可能与特异性生长因子(特别是VEGF)相互作用来影响视网膜的发育和功能,最终共同导致视网膜新生血管形成[1]。因此,抑制AngⅡ可能会成为预防和治疗视网膜新生血管的临床方法。本实验探讨RNV发生发展过程中,血管紧张素Ⅱ受体拮抗剂坎地沙坦抑制RNV的作用。
1 材料和方法
1.1 材料 (1)实验动物:鼠龄为7 d的健康C57BL/6J清洁级新生小鼠(中国医科大学动物部)40只,体质量4.0~5.0 g,性别不限,与哺乳母鼠共同饲养,所有动物均具有动物检疫合格证,无任何眼疾。实验动物及实验条件符合国家科学技术委员会的《实验动物管理条例》。(2)药品试剂:坎地沙坦、BCA蛋白定量试剂盒(美国Pierce公司)、ECL发光试剂盒(美国Pierce公司)、异硫氰酸葡聚糖荧光素(美国Sigma公司)、兔抗小鼠AngⅡ多克隆抗体(美国Sigma公司)、兔抗小鼠VEGF多克隆抗体(美国 Sigma公司)、羊抗兔IgG-HRP(美国Sigma公司)。
1.2 方法 (1)动物分组和模型建立:将40只7 d龄C57BL/6J清洁级新生小鼠随机分为2组:高氧组和坎地沙坦组,每组20只。参照 Smith等[2]的方法建立氧诱导视网膜病变模型,高氧组和坎地沙坦组小鼠及哺乳母鼠置于密闭氧箱中,控制氧浓度为(75% ±2%),5 d(鼠龄12 d)后回到正常空气环境中。小鼠出氧箱后,坎地沙坦组和高氧组每日分别腹腔注射缬沙坦40 mg/kg和等量生理盐水,连续5 d。所有动物保持温度(21±1)℃,光照-黑暗循环/12 h。荧光素血管灌注视网膜铺片:两组鼠龄17 d的小鼠各取3只,将异硫氰酸葡聚糖荧光素溶于1 mL的4%多聚甲醛中,经左心室灌注(0.03 mL/g),摘取眼球,于4%多聚甲醛中固定1 h,游离视网膜,以视盘为中心呈放射状对称切开,用抗荧光衰退封片剂将视网膜封片,采用荧光显微镜(日本Olympus公司)观察视网膜血管形态的变化。突破视网膜内界膜的血管内皮细胞核计数:两组鼠龄17 d的小鼠各取5只,摘除眼球后,于4%多聚甲醛中固定24 h,常规脱水,石蜡包埋,平行于角膜至视盘的矢状位连续4 μm切片,苏木素-伊红染色。每只眼球取10张切片,每组50张,由同一操作者采用随机、盲法在光学显微镜(日本Olympus公司)下对切片样本计数每张切片突破视网膜内界膜的血管内皮细胞核数。选取切片时,注意避开视盘周围,计数血管内皮细胞核时,仅计数与内界膜有紧密联系的细胞核,不包括玻璃体腔内其他与内界膜无联系的血管内皮细胞核。Western blot检测AngⅡ及VEGF蛋白表达:两组鼠龄17 d的小鼠各取12只,提取视网膜组织蛋白质,用BCA蛋白定量试剂盒定量视网膜组织蛋白质含量,每个样品上样含量30 μg,以10%SDS-PAGE 电泳(4 ℃,120 V,2 h)分离蛋白质,电转移法将蛋白质转移至硝酸纤维素滤膜上,用4%脱脂奶粉,于4℃下过夜封闭硝酸纤维素滤膜的非特异性蛋白质结合位点,将滤膜于兔抗小鼠AngⅡ多克隆抗体(1∶400)、兔抗小鼠VEGF多克隆抗体(1∶400)在37℃下孵育2 h,TBS-T缓冲液冲洗滤膜3次后,将滤膜转移至二抗羊抗小鼠 IgG-HRP(1∶1 000),37℃下孵育1 h,TBS-T缓冲液再次冲洗滤膜后,ECL化学发光显影。采用 β-actin(1∶400)作为内参照。应用Quantity One 4.2软件分析,分别比较各组AngⅡ、VEGF条带灰度值与β-actin条带灰度值的比值,表示各组蛋白相对表达水平。
1.3 统计学分析 所有数据应用SPSS 16.0进行统计学分析,结果以±s表示,计量资料组间比较采用独立样本t检验,两变量间相关性采用Pearson相关分析,以P<0.05为差异有统计学意义。
2 结果
2.1 荧光素血管灌注视网膜铺片 高氧组视盘周围可见大片无灌注区,视网膜血管不规则扩张,走行迂曲,无灌注区周围可见大量新生血管丛,伴明显荧光渗漏;坎地沙坦组与高氧组比较,血管迂曲和不规则扩张减轻,新生血管丛减少,荧光渗漏减轻。
2.2 突破视网膜内界膜的血管内皮细胞核数高氧组可见较多突破视网膜内界膜的血管内皮细胞核,有些单独出现,有些成簇出现;坎地沙坦组与高氧组比较,平均每张切片中突破视网膜内界膜的血管内皮细胞核数减少,差异有统计学意义(P <0.05,见图1)。
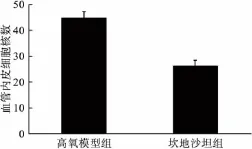
图1 突破视网膜内界膜血管内皮细胞核比较
2.3 视网膜AngⅡ和VEGF蛋白表达的变化Western blot检测发现,两组视网膜均有AngⅡ蛋白表达,AngⅡ蛋白在坎地沙坦组视网膜中表达较高氧组显著下降,差异有统计学意义(P<0.01,见表1);Western blot检测发现,两组视网膜中均有VEGF蛋白表达,VEGF蛋白在坎地沙坦组视网膜中表达较高氧组显著下降,差异有统计学意义(P<0.01,见表1)。经Pearson相关分析,在氧诱导视网膜病变中,AngⅡ和VEGF蛋白的表达呈明显正相关(r=0.77,P <0.01)。
表1 视网膜AngⅡ和VEGF蛋白相对含量的比较(±s)
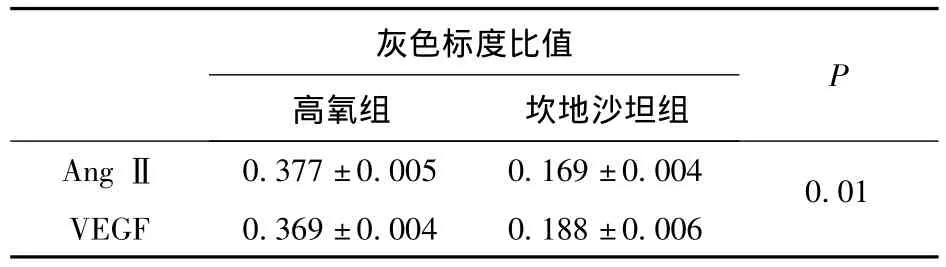
表1 视网膜AngⅡ和VEGF蛋白相对含量的比较(±s)
灰色标度比值高氧组 坎地沙坦组P AngⅡ 0.377±0.005 0.169±0.0040.01 VEGF 0.369±0.004 0.188±0.006
3 讨论
本研究利用氧诱导视网膜病变模型,目的在于探讨坎地沙坦对RNV的抑制作用。结果表明,AngⅡ通过上调VEGF参与增殖性视网膜病变中RNV的形成,早期应用坎地沙坦均可一定程度抑制RNV形成。
本文研究显示,在视网膜新生血管发生发展过程中,AngⅡ和VEGF蛋白水平升高,且两者呈正相关。AngⅡ作为肾素-血管紧张素系统的主要成分和效应分子,由血管紧张素I在血管紧张素转换酶和丝氨酸蛋白酶的作用下转化生成,通过AngⅡ受体发挥作用[3]。事实上,AngⅡ的绝大多数生物学效应包括:血压调节、细胞生长、血管生成和生长因子诱导等,均通过AngⅡ受体介导,因此,AngⅡ不仅是一种血管活性物质,而且还是一种生长因子,可以促进多种血管细胞的扩散、转移以及合成,从而引起血管生成和重建[3-4]。AngⅡ受体是一种七跨膜结构域G蛋白偶联受体,并通过以下3种途径发挥作用:①AngⅡ受体和异三聚体G蛋白相互作用,激发不同的信号级联反应,包括磷脂酶C、磷脂酶A2、磷脂酶D、蛋白激酶C和丝裂原活化蛋白激酶的激活。②AngⅡ通过AngⅡ受体激活许多非受体酪氨酸激酶类的磷酸化作用,包括磷脂酶cγ、Src家族蛋白激酶、Janus激酶、粘着斑激酶、富脯氨酸蛋白酪氨酸激酶。③AngⅡ对某些酪氨酸激酶受体也具有反式激活[5]。VEGF是一种有效的促血管生成的活性因子,在增殖性视网膜病变中,VEGF表达上调并参与血-视网膜屏障的破坏[6]。在视网膜周细胞和血管内皮细胞中,AngⅡ通过血管紧张素Ⅱ受体介导VEGF表达,刺激VEGF产生,影响视网膜微血管系统的发育[7]。坎地沙坦通过选择性阻断血管紧张素Ⅱ受体和AngⅡ结合发挥拮抗作用。
本文实验结果表明,坎地沙坦减少AngⅡ生成,从而抑制VEGF,短期内对以RNV为特征的增殖性视网膜病变的防治和转归有重要意义。但长期疗效还需进一步的实验和临床研究来证实。
[1] 刘鹤南,朱颖,陈晓隆,等.肾素-血管紧张素系统阻滞剂预防早产儿视网膜病变研究[J].中华眼底病杂志,2010,28(3):291-293.
[2] Smith LE,Wesolowski E,McLellan A,et al.Oxygen-induced retinopathy in the mouse[J].Invest Ophthalmol Vis Sci,1994,35(1):101-111.
[3] Suzuki Y,Ruiz-Ortega M,Lorenzo O,et al.Inflammation and angiotensin Ⅱ[J].Int J Biochem Cell Biol,2003,35(6):881-900.
[4] Nouet S,Nahmias C.Signal traneduction from the angiotensinⅡ AT2 receptor[J].Trends Endocrinol Metab,2000,11(1):l-6.
[5] Yin G,Yan C,Berk BC.Angiotensin Ⅱ signaling pathways mediated by tyrosine kinases[J].Int J Biochem Cell Biol,2003,35:780-783.
[6] Wang X,Wang G,Wang Y.Intravitreous vascular endothelial growth factor and hypoxia-inducible factor 1a in patients with proliferative diabetic retinopathy[J].Am J Ophthalmol,2009,148(6):883-889.
[7] Tee LB,Penrose MA,O'Shea JE,et al.VEGF-induced choroidal damage in a murine model of retinal neovascularisation[J].Br J Ophthalmol,2008,92(6):832-838.
