银杏外种皮多糖对人宫颈癌细胞系Siha增殖及侵袭的影响
2011-05-21娄晓明吴春丽李婉萍
杨 滨,娄晓明,吴春丽,李婉萍
银杏(Ginkgo biloba L.)是木本孑遗植物,其叶、果和外种皮皆可入药。银杏外种皮是银杏种子的外皮层,包含有大量的银杏多糖、银杏内酯、黄酮及被称作银杏酚、酸的化合物等多种物质。有报道表明,银杏外种皮多糖(Ginkgo biloba exocarp polysaccharides,GBEP)对胃癌、肺癌及肝癌细胞的生长具有一定的抑制效果[1-3],但其在宫颈癌方面的研究较少。本文研究体外银杏外种皮对人宫颈癌细胞增殖及迁移的影响,探讨其对宫颈癌的治疗作用。
1 实验材料
1.1 细胞株及培养方法 细胞株:Siha细胞株购自中科院,由本实验室传代保存。细胞培养:用含有10%小牛血清的高糖RPMI1640培养基,37℃饱和湿度、5%CO2培养箱中培养,细胞贴壁生长,每2~3天传代1次。
1.2 实验仪器及试剂 酶标仪(BIOTEKElx800);AE30/31倒置相差显微镜(麦克奥迪实业集团有限公司);HF90 CO2细胞培养箱(上海力申科学仪器有限公司)。细胞培养用试剂购自Hyclone公司,RNA prep pure动物组织总RNA提取试剂盒,TIANScript cDNA第一链合成试剂盒,2×Taq Real Master Mix(SYBR Green)购自天根生物科技(北京)有限公司,引物由上海生工生物工程技术服务有限公司合成,抗体购自Abcam公司,噻唑蓝(MTT)购自Sigma公司,ELISA检测试剂盒购自RB公司,其他试剂为国产分析纯。
2 实验方法
2.1 银杏外种皮粗多糖的制备 称取适量银杏外种皮,置于圆底烧瓶中,按料液比1∶10、沸水浸提1 h,在热水浴中回流浸提3次,冷却后过滤,合并上清液。上清液经减压浓缩,三氯乙酸脱蛋白,离心,调pH至中性,加入一定体积的95%乙醇,使终浓度为80%。充分搅动,静置沉淀,所得沉淀依次用无水乙醇、丙酮、无水乙醚洗涤,真空干燥即可得粗多糖。经计算,得到外种皮原料中多糖含量为6.684 g/100 g。
2.2 MTT法检测GBEP对Siha细胞的增殖影响
将GBEP用PBS溶出,调pH至中性,过滤除菌,于4℃冰箱中保存备用,GBEP稀释为 10、20、40、80、160、320 μg/mL 浓度梯度。取对数生长期细胞,调节细胞浓度为5×104个/mL,将细胞以每孔200 μL接种于96孔培养板,培养12 h,使其充分贴壁,然后换为无血清的RPMI-1640培养,加入含GBEP的无血清RPMI-1640培养液培养,每个浓度设3个复孔。对照组为不含GBEP的RPMI-1640 培养基,5%CO2,37 ℃ 中孵育 24、48、72 h。每孔加入5 mg/mL MTT 20 μL,继续放入CO2培养箱中染色4 h,吸去上清,加入200 μL DMSO溶解细胞内形成的结晶,用酶标仪测定490 nm处吸光度(OD)值,计算GBEP对Siha细胞生长的抑制率。抑制率(%)=(空白孔OD值-实验孔OD值)/空白孔OD值×100%,同时计算IC50值,并确定合适的3个实验计量和实验时间,用于后续实验。
2.3 检测GBEP对Siha细胞的侵袭抑制作用应用铺有Matrigel的Transwell小室法测定GBEP对Siha细胞迁移情况的影响,将铺胶后的Transwell小室放入24孔板中,下室加入含10%FBS的 RPMI-1640培养液 500 μL;在上室加入含GBEP 终浓度为 0、10、20、40、80、160、320 μg/mL的100 μL细胞悬液,细胞数为1×105个/孔。常规培养24、48、72 h,取出 Transwell小室,PBS 轻轻冲洗,擦去微孔膜上层的细胞,甲醛室温下固定15 min,苏木素染液染色,倒置显微镜下(×400)对迁移至微孔膜下层的细胞计数。每个样本选取5个视野计数细胞,取其均数。迁移率(%)=实验孔细胞数/空白孔细胞数×100%。
2.4 Siha细胞中人基质金属蛋白酶2(MMP-2)基因Real Time PCR检测 经MTT实验确定的实验条件,取不同浓度(0~320 μg/mL)GBEP处理下对数生长期的Siha细胞,加入裂解液收集,提取RNA,并测得浓度,逆转录后,进行Real Time PCR检测,以GAPDH作为内参,进行相对表达量分析。MMP2基因引物为:Forward primer:TGGTTTTCCTCCATCCAGTGG,Reverseprimer:CAGGTTGTCTGAAGTCACTGC。
2.5 GBFP对Siha细胞MMP-2蛋白分泌表达的影响 经MTT实验确定的实验条件,收集不同浓度GBEP处理下的 Siha细胞培养液上清,4 000 rpm离心10 min,取上清,用MMP-2 ELISA测定试剂盒检测肿瘤细胞上清中MMP-2含量。
2.6 统计方法 实验数据应用SPSS 13.0统计软件包进行统计分析,各指标用均数±标准差表示,P<0.05为差异有统计学意义。
3 实验结果
3.1 MTT法检测GBEP对Siha细胞增殖的影响
MTT检测正常Siha细胞与GBEP处理后的Siha细胞在处理后24、48、72 h后的增殖情况,并绘制生长曲线,见表1、图1。结果显示,GBEP处理后的细胞较正常培养的Siha细胞增殖速度明显减缓,经计算,得到 24 h、48 h、72 h的 IC50值分别为78.09、58.25 和48.63 μg/mL,48 h 为适合实验。

表1 不同浓度及时间GBEP对Siha细胞增殖的抑制情况
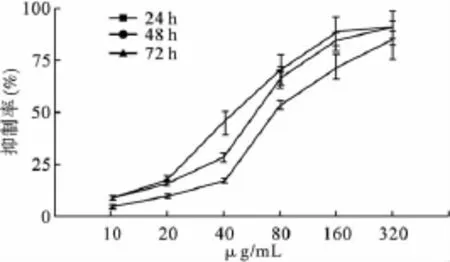
图1 GBEP对Siha细胞的增殖抑制曲线
3.2 GBEP对Siha细胞侵袭的影响 利用Transwell细胞培养小室测定GBEP处理后细胞迁移能力的变化,见图2。结果显示,GBEP处理后,Siha细胞迁移细胞数明显低于正常培养细胞(P<0.05);随着GBEP浓度的增加,细胞迁移率逐渐降低,随着药物处理时间的增加,细胞迁移率降低。
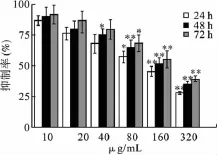
图2 GBEP对Siha细胞迁移的影响
3.3 Real Time PCR检测Siha细胞中MMP-2基因表达情况 应用Real Time PCR方法检测未经处理Siha细胞和GBFP处理后的细胞中MMP-2基因的表达情况,结果如图3所示,随着GBFP浓度的增加,Siha细胞中MMP-2基因的表达量降低,浓度为40 μg/mL时,差异有统计学意义(P<0.05),80 μg/mL以上时,差异有显著统计学意义(P<0.01)。

图3 不同浓度GBEP对siha细胞中MMP-2基因表达的影响
3.4 GBEP对Siha细胞上清中MMP-2分泌表达的影响 见图4。结果显示,GBFP可明显降低Siha细胞上清中MMP-2的分泌表达,80 μg/mL以上GBFP处理组与对照组相比,差异有显著统计学意义(P<0.01)。
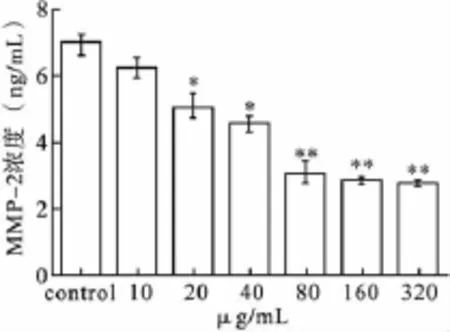
图4 不同浓度GBEP对siha细胞MMP-2分泌表达的影响
4 讨论
多糖作为一种重要的生物活性成分,不是一种单一的化学物质,而是聚合程度不同的多种糖物质的混合物[4]。多糖具有提高免疫、抑制肿瘤等多方面功能,在植物、动物、微生物中广泛存在,近年来多糖成为天然药物的一个研究热点。银杏外种皮多糖(Ginkgo biloba exocarp polysaccharides,GBEP)是从银杏的外种皮中提得的活性多糖物质[5]。由于银杏外种皮是银杏加工过程产生的废弃物,不仅污染环境,也造成资源浪费,而从其中提取多糖,原料成本低,变废为宝,具有广阔的应用前景。
在恶性肿瘤的发生发展过程中,增殖和迁移是其主要特性,是恶性肿瘤预后不良及导致死亡的主要原因之一,因此,通过药物抑制肿瘤细胞的迁移和增殖,是癌症治疗的手段之一[6-7]。
宫颈癌在女性恶性肿瘤中位居首位,本文用MTT法观察GBEP对宫颈癌细胞株Siha增殖的抑制作用。结果表明,GBEP对Siha细胞的增殖具有抑制作用,在10~320 μg/mL剂量下,体外作用24~72 h,GBEP对 Siha细胞体外增殖的抑制率随剂量增加和时间延长而增加,具有剂量依赖性和时间依赖性,这与GBEP对其他癌细胞的研究结果相符,在GBEP对胃癌细胞及肝癌细胞的研究中有相似性。
在对细胞迁移作用的研究中,银杏外种皮多糖对宫颈癌细胞的迁移,同样起到了抑制作用,当GBEP剂量为40 μg/mL,与对照细胞相比,差异有统计学意义(P <0.05),80 μg/mL以上时,差异有显著统计学意义(P<0.01),表明GBFP对Siha细胞的迁移具有抑制作用。同时,应用Real Time PCR方法检测了与细胞迁移相关的MMP-2基因,基质金属蛋白酶(Matrix Metallo proteinases,MMPs)是锌肽酶,是一种能降解细胞外基质的蛋白水解酶,MMPs的表达和活化与肿瘤的生长、侵袭和转移密切相关,在恶性肿瘤中MMPs经常过度表达[8],其对肿瘤的侵蚀、转移有非常重要的作用。因此,MMPs被认为是癌症患者的预后因子和治疗靶点。Real Time PCR检测结果表明,随着GBEP浓度的增加,Siha细胞MMP-2表达量降低,这个结果也与 ELISA检测结果相同,共同证明GBEP对宫颈癌细胞Siha细胞迁移的抑制作用。
综上所述,银杏外种皮多糖对宫颈癌细胞Siha细胞的生长增殖和迁移侵袭具有抑制作用,在分子水平初步证明其具有抑制Siha细胞迁移相关基因的表达,为GBEP应用于宫颈癌治疗的可能性提供依据。
[1] 许爱华,陈华圣.银杏外种皮多糖对人癌细胞系的抑制作用及与阿霉素的协同效应[J].中国新药杂志,2000,9(11):753-755.
[2] 陈群,杨桂文.银杏露果多糖的免疫调节活性与抗肿瘤作用[J].中国实用医药杂志,2004,54(10):29.
[3] 朱月清,周振英,陈华圣,等.银杏外种皮多糖抑制小鼠肝癌及诱导肝癌细胞凋亡的研究[J].中国新药与临床药理,2001,12(5):98-102.
[4] Itokawa H,Totsuka N,Nakahara K,et al.Antitumor principles from Ginkgo bilobaL[J].Chem Pharm Bull,1987,35(7):3016.
[5] Ji Su KL,You Sun C,Eun JungP,et al.Phospholipase C1 inhibitory principles from the sarcotestas of Ginkgo biloba[J].J Nat Prod,1998,61:867.
[6] 郑小冬,吕杰强,朱雪琼,等.抗氧化剂吡咯烷二硫代氨基甲酸盐对宫颈癌Siha细胞增殖和凋亡的影响[J].实用医学杂志,2009,25(22):3743-3746.
[7] 钱德英,欧阳云雁,赵杨,等.RNAi干扰HPV16E6基因对宫颈癌 Siha细胞的影响[J].实用医学杂志,2010,26(9):1505-1507.
[8] 陈晓锋,顾振纶,梁忠琴,等.基质金属蛋白酶与肿瘤的侵袭和转移研究进展[J].中国药理学通报,2001,17(3):253-257.
