一株H5亚型禽流感病毒NP蛋白两个鸡MHC分子限制性T细胞表位的鉴定
2011-05-21侯艳霞郭莹莹吴春艳姜永萍王靖飞
侯艳霞,郭莹莹,沈 楠,吴春艳,姜永萍,王靖飞*
(1.中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室/疫病诊断中心,黑龙江 哈尔滨 150001;2.中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室/农业部动物流感重点开放实验室,黑龙江 哈尔滨 150001)
禽流感病毒(Avian influenza virus,AIV)属于A型流感病毒,含有8个节段的负链RNA,其中节段5编码的核蛋白(Nucleoprotein,NP)在不同亚型的流感病毒中非常保守[1],含有大量的细胞毒性淋巴细胞识别的抗原表位,其诱导的细胞免疫可抵御不同亚型流感病毒的感染[2-3]。目前许多关于流感病毒的T细胞表位在人和小鼠中已获得鉴定[4-5]。然而,禽主要组织相容性复合体(MHC)的结构和功能方面研究很少,限制了禽类抗流感病毒细胞免疫研究的开展。Haghighi于2009年首次鉴定了一株AIV血凝素(Hemagglutinin,HA)中被鸡的T细胞识别的T细胞表位[6],但是关于鸡MHC限制性的AIV NP的T细胞表位还未见有报道。
T细胞表位与MHC I类分子结合后被CD8 T细胞识别,引起T淋巴细胞增殖,并伴随IFN-γ分泌量的增加[7]。为验证本实验室预测的AIV NP的3个潜在的T细胞表位,本研究用表达NP基因的重组质粒免疫SPF鸡,采集免疫鸡的脾淋巴细胞并用合成的候选肽刺激,检测相关的免疫应答指标,体外验证了候选肽的免疫原性。
1 材料和方法
1.1 实验材料 真核表达载体pCAGGS、H5亚型的多克隆阳性血清和293T细胞及原核表达的NP蛋白由本实验保存;AIV NP蛋白多肽NP89-97(PKKTGGPIY)、 NP198-206(KRGINDRNF)、 NP64-71(ERMVLSAF)和不相关肽,即鸡传染性支气管炎病毒(IBV)N蛋白T细胞表位肽N71-78(WRRQARYK)均由金思特科技有限公司合成;3周龄SPF鸡由哈尔滨兽医研究所实验动物中心提供。FITC标记的兔抗鸡抗体(FITC-IgG)、HRP标记的兔抗鸡抗体(IgG-HRP)购自 Sigma公司;LipofectamineTM2000、鸡γ干扰素ELISA试剂盒购自Invitrogen公司;羧甲基荧光素乙酰乙酸(CFSE)购自Sigma公司;PE标记的抗鸡CD8+抗体(anti-CD8-PE)购自BD公司。
1.2 H5亚型AIV DNA重组质粒pCAGGS-NP的构建 根据密码子的偏嗜性,优化AIV A/Goose/Guangdong/1/1996(H5N1)的NP基因序列为鸡体偏嗜密码子,命名为opiNP。基因由金思特科技有限公司合成,opiNP经EcoRⅠ和XhoⅠ酶切处理后插入载体pCAGGS中,构建重组质粒pCAGGS-NP,用于免疫鸡。
1.3 pCAGGS-NP在293T细胞中的表达检测
1.3.1 IFA检测 将pCAGGS-NP和pCAGGS按转染试剂盒说明书分别转染293T细胞,转染48 h后,以H5亚型的多克隆阳性血清作为一抗,FITC-IgG为二抗,同时设未转染质粒的293T细胞为阴性对照,于荧光显微镜下观察。
1.3.2 Western blot检测 pCAGGS-NP和pCAGGS转染48 h后的293T细胞经SDS-PAGE电泳,电转印至NC膜上。其中,以H5亚型的多克隆阳性血清作为一抗,IgG-HRP为二抗,DAB显色。
1.4 重组质粒免疫后的抗体检测
1.4.1 间接ELISA方法的建立 原核表达的NP蛋白以不同的浓度包被ELISA板,H5亚型的多克隆阳性血清及阴性血清也以不同的稀释倍数进行ELISA试验。判定标准为:OD450nm值<0.2为阴性血清,OD450nm值1.0左右,且P/N≥2.1为阳性血清。通过ELISA方阵确定蛋白抗原的最佳包被浓度为5 μg/mL,血清的最佳稀释倍数为1∶100。
1.4.2 重组质粒免疫及免疫后血清中抗体的检测以100 μg/只pCAGGS-NP腿部肌肉注射免疫3周龄SPF鸡,首次免疫后3周以同样的剂量和方式加强免疫。每周采集其翅静脉血,分离血清,并用建立的间接ELISA检测血清中的抗体。
1.5 候选肽的鉴定
1.5.1 CD8+T淋巴细胞的增殖试验 取加强免疫3周后的鸡脾细胞,用鸡淋巴细胞分离液制备成淋巴单细胞悬液,调整细胞浓度为1×107个/mL,以CFSE贮存液稀释其终浓度为7.5 μmol/L,37℃染色10 min。洗涤3次后,细胞重悬于含10%FBS的1640培养液中,调整细胞浓度为1×106个/mL。将细胞接种24孔培养板,每孔1 mL,加入合成多肽刺激物和不相关多肽,终浓度为 100 μg/mL。37℃,5%CO2培养5 d。用anti-CD8-PE标记,经流式细胞术检测。
1.5.2 IFN-γ的ELISA检测 将淋巴单细胞悬液加入合成多肽刺激物和不相关多肽,终浓度为100 μg/mL。37℃,5%CO2培养48 h。采用ELISA试剂盒检测鸡IFN-γ的分泌情况。
2 结果
2.1 重组质粒pCAGGS-NP的构建及鉴定 重组质粒经EcoRⅠ和XhoⅠ酶切后得到约为1500 bp和4700 bp的两个片段,与预期结果相符,表明已构建重组质粒pCAGGS-NP。
2.2 NP蛋白在293T细胞中表达的检测
2.2.1 IFA检测结果 IFA检测重组质粒pCAGGS-NP转染293T细胞后呈现绿色荧光,而空载体及未转染质粒的293T细胞均无可见特异性荧光,表明重组质粒pCAGGS-NP在真核细胞中得到表达并具有良好的反应原性(图1)。

图1 NP蛋白表达的IFA检测结果Fig.1 IFA assay of the expressed NP protein
2.2.2 Western blot检测结果 转染pCAGGS-NP的293T细胞样品在60 ku处出现一条明显的条带,与预期大小相符,而空载体及未转染质粒的293T细胞样品无此反应条带,进一步表明重组质粒pCAGGS-NP在真核细胞中得到表达并具有良好的反应原性(图2)。

图2 表达的NP蛋白的western blot鉴定Fig.2 Western blot analysis of the expressed NP protein
2.3 重组质粒免疫后血清中NP抗体的检测ELISA方法检测免疫后鸡血清中的NP抗体,检测结果显示,重组质粒首次免疫后机体内NP抗体水平缓慢上升,加强免疫后,抗体迅速上升并保持在一个相对稳定的水平。表明NP蛋白在鸡体内获得正确表达,表达产物具备良好的免疫原性,能有效诱导机体产生相应的抗体(图3)。
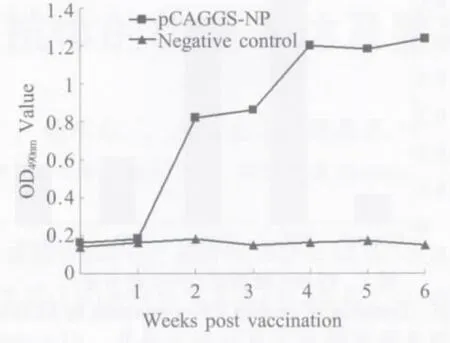
图3 鸡免疫后血清中的NP抗体变化Fig.3 Dynamics of NP antibody in immunized chickens
2.4 候选合成多肽的鉴定
2.4.1 CD8+T淋巴细胞的增殖 用anti-CD8-PE对淋巴细胞标记,经流式细胞仪分群计数后发现经多肽NP89-97和NP198-206刺激后CD8+T细胞分别有13.7%和11.9%的增殖,而多肽NP64-71和不相关肽N71-78刺激的CD8+T细胞略有增殖(图4),表明肽NP89-97和NP198-206能有效地刺激活化的CD8+T淋巴细胞增殖。
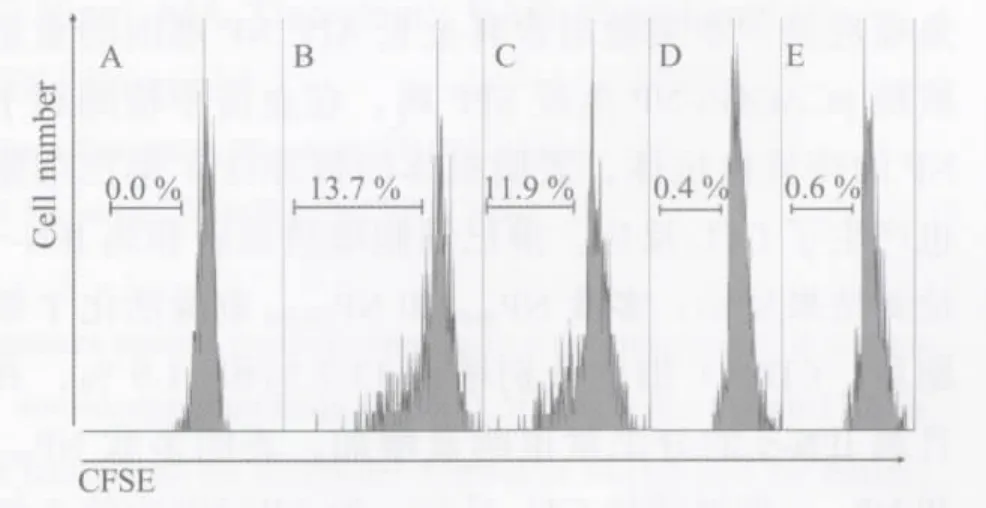
图4 不同肽刺激后CD8+T细胞增殖流式检测结果Fig.4 CD8+T cell proliferation after stimulation with different peptides
2.4.2 鸡IFN-γ分泌的ELISA检测结果 ELISA检测表明多肽NP89-97和NP198-206刺激后的细胞上清中IFN-γ的分泌量明显增加,而多肽NP64-71、N71-78及不加任何刺激物的细胞上清中IFN-γ分泌水平均较低(图5),进一步证明多肽NP89-97和NP198-206能够刺激鸡脾淋巴细胞发生细胞毒性T淋巴细胞(CTL)反应,分泌 IFN-γ。
3 讨论
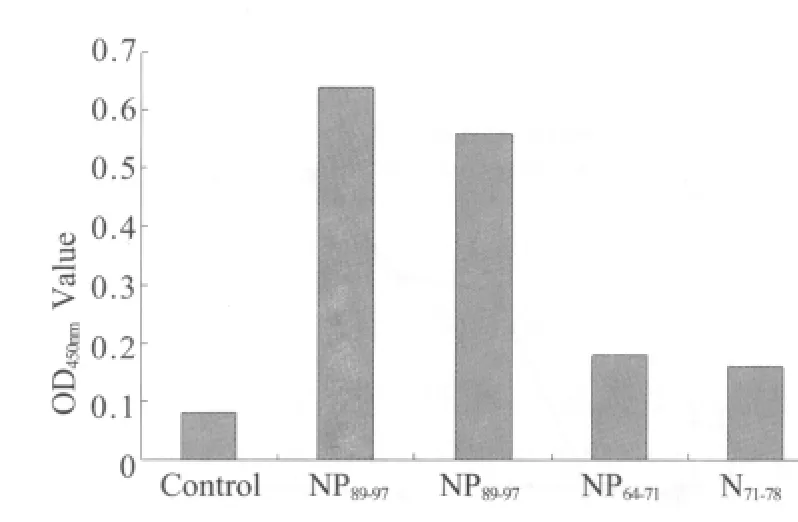
图5 ELISA检测鸡IFN-γ的分泌Fig.5 Detection of chicken IFN-γ secretion by ELISA
AIV是危害养禽业的主要病原之一,禽类在抵抗该病毒感染的过程中细胞免疫起着重要的作用[8]。NP作为病毒的内部结构蛋白,可以诱导CTL免疫反应的发生,从而协助机体清除体内病毒,在不同亚型的AIV之间具有一定的交叉保护力[9]。细胞免疫的重要组成部分为T细胞表位,而T细胞表位具有MHC限制性[10]。本实验所选取的抗原肽为本实验室根据B19单倍型鸡MHC I类分子的结构预测的AIV NP上的潜在表位。
DNA免疫可有效的诱导机体的体液免疫和细胞免疫应答。本实验用含有全长AIV NP基因的重组质粒pCAGGS-NP免疫SPF鸡,在血清中检测到了NP的特异性抗体,表明机体的特异性T淋巴细胞也产生了CTL反应。淋巴细胞增殖试验和鸡IFN-γ检测结果显示:多肽NP89-97和NP198-206刺激活化T细胞后,CD8+T细胞分别增殖13.7%和11.9%,并且鸡IFN-γ的分泌量也明显增加,表明多肽NP89-97和NP198-206能够诱导CTL反应,为AIV NP中的T细胞表位。但由于技术和资源的欠缺,目前还不能确定实验用鸡为B19纯系鸡,没有直接的证据表明这两条多肽为B19限制性表位,在条件允许时还需做进一步鉴定。
目前文献报道的流感病毒NP蛋白的表位均为人和鼠MHC限制性T细胞表位。本研究首次鉴定了AIV NP蛋白中鸡MHC限制性T细胞表位,其中NP89-97在各种亚型的流感病毒中均保守,而且H3N2的NP91-99(KTGGPIYKR)被鉴定为HLA-A68限制性表位[4],表明该表位可为多种亚型的流感病毒的感染提供免疫保护。该研究结果对研究禽类抗流感病毒的免疫机制及抗流感疫苗具有重要的意义。
[1]Shu L L,Bean W J,Webster R G.Analysis of the evolution and variation of the human influenza A virus nucleoprotein gene from 1933 to 1990[J].J Virol,1993,67(5):2723-2729.
[2]Rimmelzwaan G F,Boon A C,Voeten J T,et al.Sequence variation in the influenza A virus nucleoprotein associated with escape from cytotoxic T lymphocytes[J].Virus Res,2004,103(1-2):97-100.
[3]Ng A K,Zhang Hong-min,Tan K,et al.Structure of the influenza virus A H5N1 nucleoprotein:implications for RNA binding,oligomerization,and vaccine design[J].Faseb J,2008,22(10):3638-3647.
[4]Bui H H,Peters B,Assarsson E,et al.Ab and T cell epitopes of influenza A virus,knowledge and opportunities[J].PNAS,2007,104(1):246-251.
[5]McMurry J A,Johansson B E,De Groot A S.A call to cellular& humoral arms:enlisting cognate T cell help to develop broad-spectrum vaccines against influenza A[J].Human Vacci,2008,4(2):148-157.
[6]Haghighi H R,Read L R,Haeryfar S M,et al.Identification of a dual-specific T cell epitope of the hemagglutinin antigen of an H5 avian influenza virus in chickens[J].PloS One,2009,4(11):e7772.
[7]Adams S C,Xing Zheng,Li Jin-ling,et al.Immune-related gene expression in response to H11N9 low pathogenic avian influenza virus infection in chicken and Pekin duck peripheral blood mononuclear cells[J].Molecul Immunol,2009,46(8-9):1744-1749.
[8]Seo S H,Webster R G.Cross-reactive,cell-mediated immunity and protection of chickens from lethal H5N1 influenza virus infection in Hong Kong poultry markets[J].J Virol,2001,75(6):2516-2525.
[9]Boon A C,de Mutsert G,Graus Y M,et al.The magnitude and specificity of influenza A virus-specific cytotoxic T-lymphocyte responses in humans is related to HLA-A and -B phenotype[J].J Virol,2002,76(2):582-590.
[10]Corr M,Slanetz A E,Boyd L F,et al.T cell receptor-MHC class I peptide interactions:affinity,kinetics,and specificity[J].Sciences,1994,265(5174):946-949.
