重组截短型ELR1蛋白在昆虫表达系统中的分泌表达与结晶
2011-05-21孙佩龙郝飞飞吕淑霞刘新奇周建华林跃智
孙佩龙,郝飞飞,吕淑霞,刘新奇,周建华,林跃智
(1.沈阳农业大学生物科学技术学院,辽宁 沈阳 110161;2.中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室/大动物病研究室,黑龙江 哈尔滨 150001;3.南开大学生命科学学院,天津 300071)
组织细胞受体的表达及其数量是决定病毒侵入途径、扩散方式及引起宿主发病的主要因素,对病毒受体的研究有助于阐明病毒的侵入机制,是病毒性疾病的药物研发及疫苗研制的重要方面[1]。马传染性贫血病毒(Equine infectious anemia virus,EIAV)属于反转录病毒科慢病毒属。由于多数EIAV感染马可处于无症状期,并且其携带马可以抵抗其它EIAV株的重复感染,因此EIAV感染马成为慢病毒感染的天然耐受模型,可以为人类免疫缺陷病毒(HIV)及其他慢病毒致病机制及疫苗的研究提供依据[2-4]。
马传染性贫血病毒单一受体(Equine lentivirus receptor-1,ELR1)是目前发现的EIAV的唯一受体。根据序列特征,归属于肿瘤坏死因子受体(TNFR)蛋白超家族[5]。研究表明,单独转染表达ELR1的细胞就可以介导EIAV病毒的侵入和复制。由此推测巨噬细胞嗜性的EIAV可能仅依赖ELR1侵染靶细胞[5-6]。这与其他慢病毒包括HIV-1不同[7-8]。本实验通过昆虫细胞表达可分泌的ELR1胞外区片段,并获得蛋白结晶体,为应用X-射线衍射技术解析蛋白结构提供了物质基础,同时也为马传染性贫血致病机制的研究奠定基础。
1 材料和方法
1.1 主要实验材料 E.coliTOP10、DH10Bac感受态细胞、真核表达载体pFastBac HG、昆虫细胞株sf9和High Five均由南开大学刘新奇教授惠赠;脂质体Cellfectin购自Invitrogen公司;限制性内切酶NheⅠ、EcoRⅠ和HindⅢ购自宝生物工程(大连)有限公司;Pfu DNA聚合酶、质粒提取试剂盒和DNA琼脂糖凝胶回收试剂盒均购自TIANGEN公司;异丙基硫代-β-D-半乳糖苷(IPTG)、X-gal和dNTP均购自上海生工生物工程技术服务有限公司;Crystal Screen1和Crystal Screen2结晶试剂盒购自Hampton Research公司;Ni-NTA Arg购自QIAGEN公司;鼠抗His抗体购自Santa Cruz公司;辣根过氧化物酶(HRP)标记的山羊抗小鼠IgG购自Sigma公司;重组质粒pMD-ELR1由中国农业科学院哈尔滨兽医研究所提供。
1.2 引物设计及PCR扩增 根据GenBank登录的ELR1序列(LOC100034069),利用Oligo 6.0软件在ELR1胞外区设计引物,上游引物P1:3'-GGCGA ATTCCCCCAGTGCAAAGAGGAG-5',下游引物P2:3'-GGCAAGCTTTCACACTTCCATCTCAAAGAG-5'。以含有ELR1的重组质粒pMD-ELR1为模板进行PCR扩增,反应条件为:95℃10 min;94℃ 40 s、55℃ 40 s、72℃ 60 s,25个循环;72℃ 10 min;扩增片段长度为462 bp。PCR扩增产物经琼脂糖凝胶电泳鉴定并回收。
1.3 重组质粒构建和鉴定 以EcoRⅠ和HindⅢ分别对PCR产物和pFastBac进行酶切后连接,构建重组质粒pFastBac-ELR1,并转化至E.coliDH10Bac感受态细胞中,在含有X-gal和IPTG的LB平板上进行蓝白菌落筛选。将鉴定正确的阳性重组质粒命名为Bacmid-ELR1。
1.4 细胞转染与蛋白表达 采用脂质体Cellfectin,将重组质粒Bacmid-ELR1转染至昆虫细胞sf9中,收集发生明显细胞病变时的细胞培养上清,感染High Five细胞,3 d后离心收取细胞培养上清液,并经Amicon Stirred Cell超滤杯进行浓缩(含500 mM NaCl的50 mM Tris-HCl,pH8.0替换昆虫培养基)。10倍稀释后,将获得的浓缩上清经Ni-NTA柱纯化,得到初步纯化的ELR1胞外区蛋白。
1.5 重组ELR1胞外区蛋白的纯化及western blot分析 收集浓度和纯度均较高的重组蛋白Ni-NTA柱洗脱液,经Superdex 7510/300 GL分子筛层析柱,用 24 mL洗脱液(50mmol/L Tris-HCl,500 mmol/L NaCl,pH8.0)以0.5 mL/min的流速洗脱。分段收集洗脱组分后,进行SDS-PAGE和western blot鉴定。其中,一抗为小鼠抗His单克隆抗体(MAb)(1∶1000),二抗为HRP-山羊抗小鼠IgG(1∶8000)。
1.6 结晶条件筛选 将纯化的ELR1胞外区蛋白浓缩液脱盐后,4℃条件下12000 r/min离心10 min,上清进行结晶点样。应用 Crystal Screen1、Crystal Screen2以及Index等共4个试剂盒194种条件,进行坐滴气相扩散法蛋白结晶条件的筛选。将蛋白样品与结晶试剂在结晶板样品孔中按照1∶1比例混合点样,用结晶透明胶带封闭于20℃恒温室中,7 d后显微镜观察坐滴孔,分辨和确认蛋白晶体。
2 结果
2.1 目的基因的扩增 从重组质粒pMD-ELR1中扩增ELR1胞外区片段,产物经琼脂糖凝胶电泳后,在约500 bp处呈现单一条带(图1),与预期结果(462 bp)相符。
2.2 重组质粒的鉴定 将重组杆状病毒转移载体pFastBac-ELR1经EcoRⅠ和HindⅢ酶切后得到4800bp和462 bp的2个片段,符合预期结果。以转染后的重组质粒Bacmid-ELR1和阴性对照质粒pFastBac为模板,进行PCR扩增,分别得到2900 bp和2400 bp的片段,与预期相符。表明已获得表达ELR1胞外区的杆状病毒重组质粒。
2.3 表达产物的SDS-PAGE检测 分别将亲和层析和凝胶过滤纯化的蛋白进行SDS-PAGE分析,结果显示表达产物经两种方法处理后获得纯度较高的重组ELR1胞外区蛋白,在约30 ku处呈现清晰的单一条带,大小与预期(26 ku)相符,表明ELR1胞外区蛋白在杆状病毒中获得正确表达(图2)。
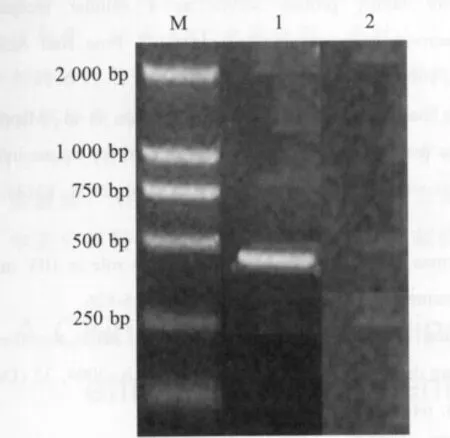
图1 ELR1 PCR扩增结果Fig.1 PCR amplification of ELR1 gene
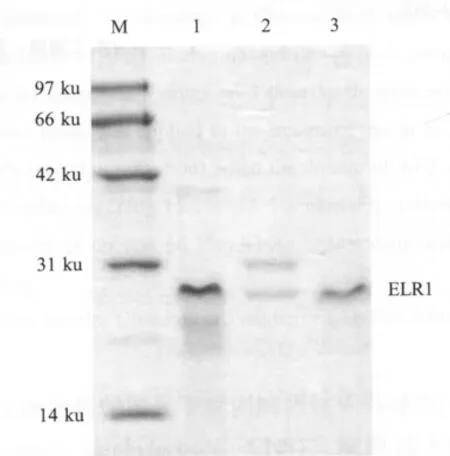
图2 纯化后ELR1蛋白的SDS-PAGE检测Fig.2 SDS-PAGE analysis of purified ELR1 protein
2.4 表达产物的western blot鉴定 以鼠抗His MAb作为一抗对纯化蛋白进行western blot分析,结果显示,纯化的重组ELR1胞外区蛋白与小鼠抗His MAb发生特异性反应,在相对分子质量约26 ku处可见一条清晰反应带,表明ELR1胞外区蛋白在杆状病毒中获得正确表达,并带有His标签(图3)。
2.5 ELR1胞外区蛋白的结晶 采用坐滴气相扩散法对纯化的ELR1胞外区蛋白进行结晶试验。通过对4种筛选试剂盒的194种结晶条件的初步筛选,在 Crystal Screen2的 31#、39#和 44#,Index的 52#条件下出现微晶,通过对结晶条件的分析进一步确定Crystal Screen2的31#和44#的晶体为蛋白晶体(图 4)。

图3 重组ELR1的western blot检测Fig.3 Western blot analysis of the recombinant ELR1

图4 ELR1的蛋白晶体Fig.4 Protein crystals of ELR1
3 讨论
前期研究显示ELR1胞外区蛋白在E.coli中以包涵体形式表达,不具备生物活性[9]。杆状病毒/昆虫细胞表达系统是一种高效的真核表达系统,与E.coli表达系统相比,其具有表达量大、具有较完善的翻译后修饰与加工体系、有利于保持外源蛋白的生物活性等优点[10]。本研究构建了ELR1基因主要功能片段的昆虫细胞表达重组质粒,并进行ELR1胞外区蛋白的可溶性表达。重组蛋白表达时分泌到昆虫细胞培养基中,简化了后期的纯化工作,有利于大规模获得具有天然活性的ELR1胞外区蛋白。
对病毒受体晶体结构的解析是研究受体蛋白的结构与功能以及研究抗病毒药物的重要手段,而选择正确的蛋白表达系统对于蛋白质的结晶及其重要。本研究采用昆虫表达系统表达ELR1的主要功能区域,通过优化结晶条件,获得重组ELR1胞外区蛋白结晶。根据该晶体的形状可以判断,其适合后续X-射线衍射,但晶体体积偏小,未达到衍射标准,不能够进行衍射试验。后续工作将通过提高蛋白的浓度、纯度和改变结晶温度,筛选出适合衍射的蛋白晶体,采用X-射线衍射技术解析蛋白结构,为研究EIAV的感染机理提供试验依据。
[1]Schneider-Schaulies J.Cellular receptors for viruses:links to tropism and pathogenesis[J].J Gen Virol,2000,81(6):1413-1429.
[2]Leroux C,Cadore J L,Montelaro R C.Equine infectious anemia virus(EIAV):what has HIV's country cousin got to tell us?[J]Vet Res,2004,35(4):485-512.
[3]Fagerness A J,Flaherty M T,Perry S T,et al.The S2 accessory gene of equine infectious anemia virus is essential for expression of disease in ponies[J].Virology,2006,349(1):22-30.
[4]McMichael A J,Hanke T.HIV vaccines 1983-2003[J].Nat Med,2003,9(7):874-880.
[5]Zhang Bao-shan,Jin Sha,Ji J,et al.A tumor necrosis factor receptorfamily protein servesas a cellularreceptorfor themacro-phage-troicequine lentivirus[J].Proc Natl Acad Sci,2005,102:9918-9923.
[6]Zhang Bao-shan,Sun Cheng-qun,Jin Sha,et al.Mapping of equine lentivirus receptor 1 residues critical for equine infectious anemia virus envelope binding[J].J Virol,2008,82(3):1204-1213.
[7]Lederman M M.Biology of CCR5 and its role in HIV infection and treatment[J].Jama,2006,296(7):815-826.
[8]Thanaraj T A,Stamm S,Clark F,et al.ASD:the alternative splicing database[J].Nucleic acids research,2004,32(Database issue):64-49.
[9]张淑琴,罗军荣,刘霄卉,等.马传染性贫血病毒受体基因的原核表达[J].黑龙江畜牧兽医,2008,6:14-16.
[10]Geisse S,Gram H,Kleuser B,et al.Eukaryotic expression systems:a comparison[J].Protein Expression Purif,1996,8(3):271-282.
