鸡胚胎性病原菌多重PCR检测方法的建立
2011-05-21谭燕玲朱瑞良王新建孙振红盛鹏程
谭燕玲,朱瑞良,王 慧,王新建,魏 凯,孙振红,盛鹏程
(山东农业大学动物科技学院山东省动物生物技术与疫病防治重点实验室,山东 泰安 271018)
山东某3个大型种鸡场2009年经常发生鸡胚死亡现象,采用细菌培养、形态学观察、生化和血清学方法对其进行病原菌的分离与鉴定,结果表明其病原菌主要为禽波氏杆菌(Bordetella avium)、沙门氏菌(Salmonella)、大肠杆菌( Escherichia coli)、绿脓杆菌(Pseudomonasaeruginosa)和葡萄球菌(Staphylococcus)[1]。
传统的细菌学检测方法每次仅能鉴定一种病原菌[2]。因此,临床上迫切需要一种能够同时鉴定多种病原菌混合感染的检测方法。多重PCR(Multiplex PCR)是在常规PCR基础上改进并发展起来的一种DNA扩增技术,一次可以检测多个基因,实现了对多种病原菌的同步检测[3]。有研究以Salmonella的 invA[4-7]、ompC[8]、IpaB[9]和 hilA[10]基因,E.coli的HlyA[5]、rfbE[2,6]和 phoA[7]基因,P.aeruginosa 的 OprL[9]和oprI基因[11]为靶基因,建立单一或双重PCR方法检测不同的病原菌,但国内外均未见有关鉴别这几种病原菌混合感染的临床诊断方法的报道。本研究建立了一种能够同时检测B.avium、Salmonella、E.coli、P.aeruginosa的多重PCR方法,为快速确定导致鸡胚死亡的因素,及时采取有效的防制措施提供方法。
1 材料和方法
1.1 菌 株 B.avium、Salmonella、E.coli、P.aeruginosa和葡萄球菌均为本实验室由死亡鸡胚中分离并保存;变形杆菌、副鸡嗜血杆菌和多杀性巴氏杆菌均为本实验室保存。
1.2 工具酶及主要试剂 pMD18-T Vector、EcoRⅠ和PstⅠ均购自宝生物工程(大连)公司;PCR反应试剂购自北京全式金公司;胶回收试剂盒和质粒提取试剂盒均购自TIANGEN公司。
1.3 引物设计与合成 根据GenBank登录的B.avium ompA基因、Salmonella invA基因、E.coli phoA基因和P.aeruginosa toxR基因,按照多重PCR引物设计原则,采用Primer Premier 5.0软件设计4对引物(表1),引物由南京金斯瑞科技有限公司合成。
1.4 单一PCR扩增反应 采用十六烷基三乙基溴化氨(CTAB)法提取细菌基因组DNA,并进行PCR扩增。反应条件为:95℃5 min;94℃30 s、54℃30 s、72℃ 55 s,30个循环;72℃ 10 min。PCR产物于琼脂糖凝胶电泳检测。
1.5 单一PCR反应的特异性检测 分别以提取的B.avium、Salmonella、E.coli、P.aeruginosa、变形杆菌、葡萄球菌、副鸡嗜血杆菌和多杀性巴氏杆菌的基因组DNA为模板,以相应特异性引物进行单一PCR扩增,验证引物的特异性。
1.6 单一PCR反应灵敏度检测 将过夜培养的4种病原菌分别计数,以生理盐水将其浓度分别调整为108cfu/mL,并进行10倍梯度稀释,PCR扩增检测其灵敏度。

表1 多重PCR引物序列与靶基因扩增长度Table 1 Multiple PCR primer sequences and the length of the target genes
1.7 多重PCR反应条件的优化 以4种菌的基因组DNA为模板进行PCR扩增,优化多重PCR反应条件。优化的条件包括Taq酶、Mg2+、dNTP、引物浓度、退火温度和反应时间等。
1.8 多重PCR反应特异性试验 分别提取B.avium、Salmonella、E.coli、P.aeruginosa、变形杆菌、葡萄球菌、副鸡嗜血杆菌和多杀性巴氏杆菌基因组DNA,采用多重PCR引物在优化后的条件下进行扩增,以验证引物的特异性。
1.9 多重PCR灵敏度测定 以4种病原菌每一个稀释度的DNA为模板,分别加入4对优化混合引物进行多重PCR扩增,比较灵敏度。其中,每种致病菌的单重PCR反应和多重PCR反应均在同一台扩增仪相同条件下进行。
1.10 临床检测 随机选取保存的B.avium、E.coli、Salmonella和P.aeruginosa阳性以及混合感染鸡胚20枚,分别将组织液在肉汤培养基中进行增菌培养,提取细菌基因组DNA进行多重PCR扩增。
2 结果
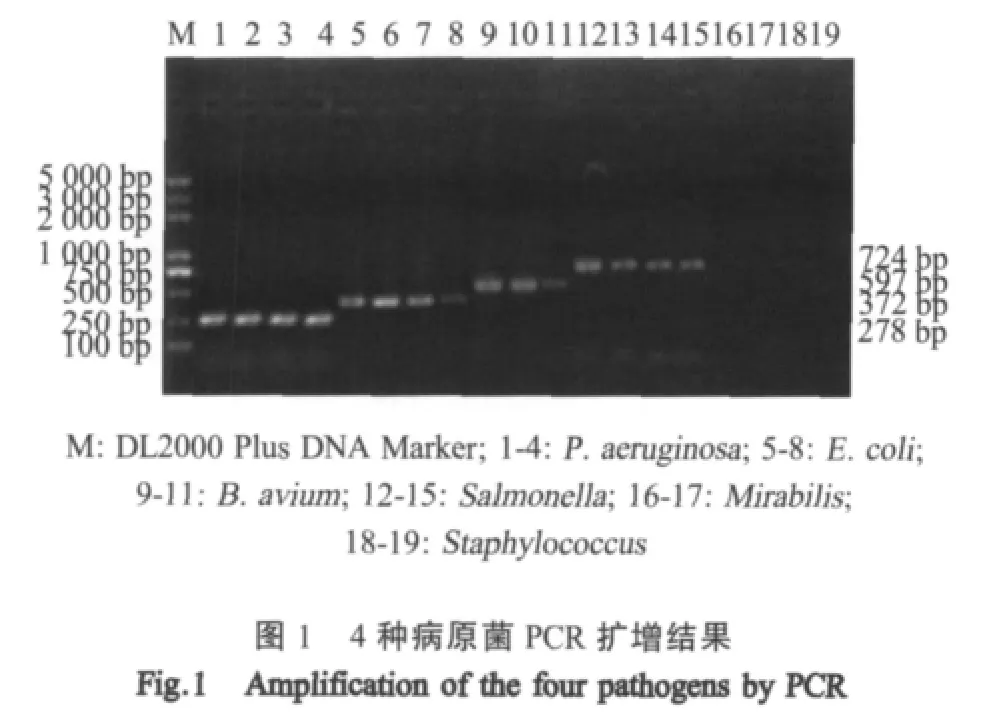
2.1 单一PCR方法的建立 对4种目的菌基因组进行单一PCR扩增,结果显示引物仅对其对应的目的菌的基因组发生特异性反应,在相应位置出现特异性条带(图1)。相应的PCR产物测序结果正确。
2.2 多重PCR反应条件的优化 多重PCR扩增最佳反应体系 (25 μL)为:10×PCR buffer 2.5 μL、25 mmol/L Mg2+3.0 μL、2.5 mmol/L dNTP 3.0 μL、Taq聚合酶2.5 U、模板为4种菌DNA各1 μL、引物分别为 B.avium0.6 μL、Salmonella0.2 μL、E.coli0.2 μL、P.aeruginosa1.5 μL(引物浓度为25 pmol/μL)。反应条件为:95 ℃ 5 min;94 ℃ 30 s、54℃30 s、72℃ 90 s,30个循环;72℃10 min。
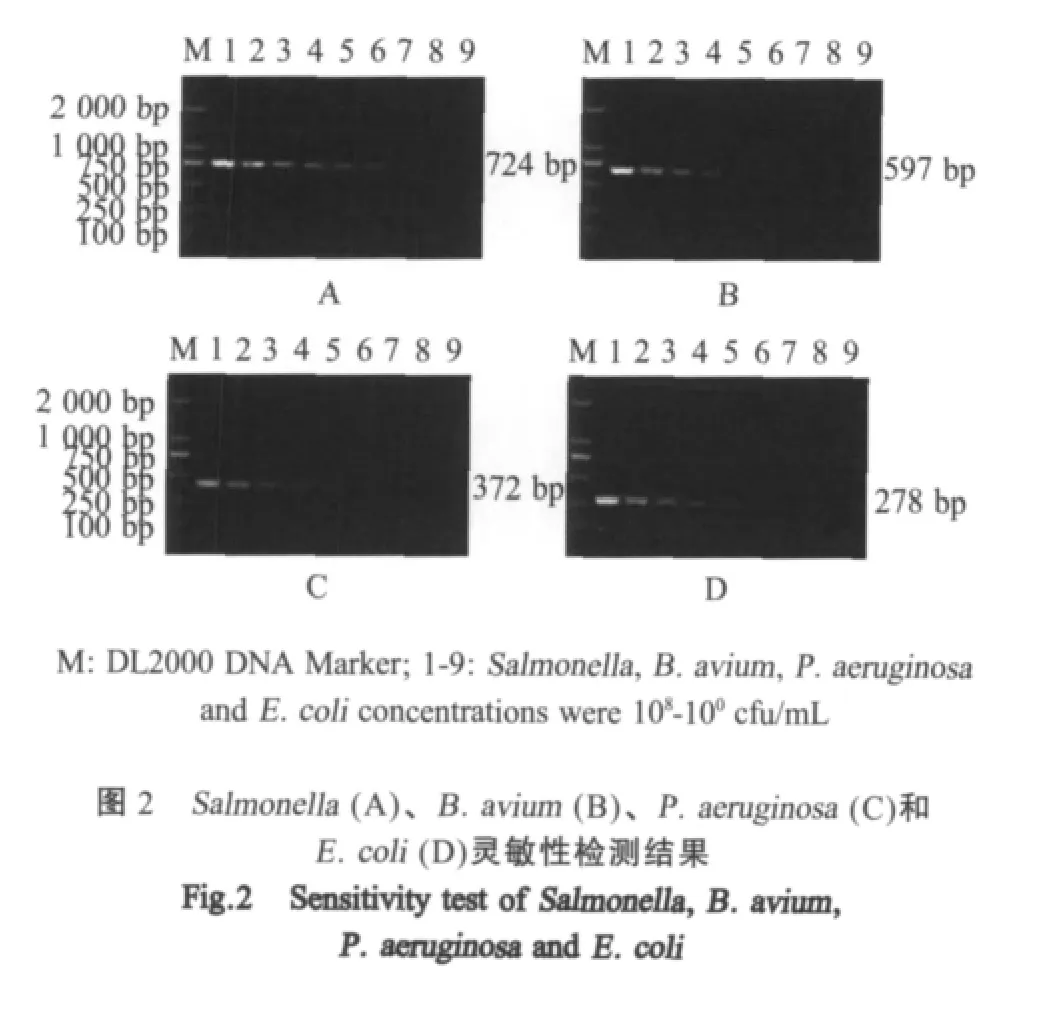
2.3 单一PCR灵敏度检测 分别以各病原菌不同稀释度的DNA为模板进行PCR反应结果显示,E.coli、P.aeruginosa和B.avium的最低检出率均为103cfu/mL,Salmonella最低检出率为102cfu/mL(图2)。
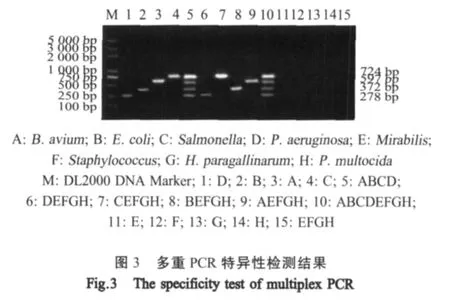
2.4 多重PCR体系的特异性 以多种细菌DNA为模板,采用优化的多重PCR反应体系进行扩增。结果显示B.avium、Salmonella、E.coli和P.aeruginosa均出现目的条带,而其他非目的菌均未扩增出任何片段(图3),表明该方法具有良好的特异性。
2.5 多重PCR的灵敏度检测 将各病原菌相同稀释度的基因组DNA混合,以优化的PCR反应条件进行扩增结果显示:B.avium的最低检出限为5.00×104cfu/mL,Salmonella为 3.40×103cfu/mL,E.coli为 2.00×104cfu/mL,P.aeruginosa为 1.80×104cfu/mL(图 4)。
2.6 临床检测结果 经增菌培养,每枚鸡胚分离的各病原菌含量均在106cfu/mL以上。分别进行多重PCR扩增结果显示,13个样品扩增出约600 bp条带,10个样品扩增出约380 bp条带,8个样品扩增出约700 bp条带,8个样品扩增出约280 bp条带,与预期相符(图5),并且每枚鸡胚病原菌的种类与常规细菌分离鉴定确诊的病原菌种类一致。
3 讨 论
应用PCR方法检测病原菌的关键是选择特异的保守基因作为靶基因,设计合适的引物。经综合分析,本研究选取B.avium ompA基因、Salmonella invA基因、E.coli phoA基因和P.aeruginosa toxR基因作为检测的靶基因。B.avium ompA基因是其特有的编码外膜蛋白的基因,Salmonella invA基因是编码侵染上皮细胞表面蛋白的基因,与该菌致病性密切相关,是沙门氏菌属特有的[3,12-13]。E.coli phoA基因是其持家基因,存在于所有E.coli中。而P.aeruginosa toxR基因是其特有的毒素基因。因此,本实验选取以上基因作为检测靶基因能够保证检测的准确性和特异性。
多重PCR影响因素较多而且复杂,本研究选取对扩增效率影响较大的退火温度、Mg2+浓度、dNTP浓度、Taq聚合酶浓度和引物浓度5个参数进行优化,获得较好的敏感性结果,可同时扩增4条目的片段,最低检出限可达104cfu/mL。该方法临床验证结果与常规检测结果一致,具有较好的实际应用价值,对快速检测B.avium、Salmonella、E.coli和P.aeruginosa具有重要价值,对预防由这4种病原菌引起的鸡胚死亡、孵化率降低具有重要意义。
[1]周东顺,朱瑞良.我国部分地区禽波氏杆菌病的血清学调查[J].中国兽医科技,2004,34(4):29-31.
[2]Enrica O,Giulia A,Giorgio B,et al.A new platform for Real-Time PCR detection of Salmonellaspp.,Listeria monocytogenes and Escherichia coliO157 in milk[J].Food Microbiol,2009,26:615-622.
[3]黄溢泓,韦正吉,李志源,等.多重PCR技术在动物病原检测中的应用[J].广西农业科学,2009,40(4):423-426.
[4]陈金顶,索青利,廖明,等.沙门氏菌的invA基因序列分析与分子检测[J].中国人兽共患病杂志,2004,20(10):868-871.
[5]遇晓杰,薛成玉,吕琦,等.食品中5种致病菌多重PCR快速检测技术的建立与应用[J].中国食品卫生杂志,2009,21(5):398-401.
[6]杨小鹃,吴清平,张菊梅,等.畜禽肉沙门氏菌和大肠杆菌O157多重PCR检测研究[J].微生物学通报,2008,35(3):470-474.
[7]许一平,成炜,邵彦春,等.沙门菌、大肠杆菌和金黄色葡萄球菌的多重PCR检测[J].微生物学通报,2006,33(6):89-94.
[8]De Freitas C G,Angela S,Da Silva H C,et al.PCR multiplex for detection of Salmonella Enteritidis,Typhiand Typhimurium and occurrence in poultry meat[J].Inter J Food Microbiol,2010,139:15-22.
[9]范宏英,吴清平,吴若菁,等.饮用水中5种致病菌多重PCR技术检测研究[J].微生物学通报,2005,32(3):102-107.
[10]肖勇,吴家林,凌霞,等.沙门菌、志贺菌、副溶血性弧菌多重PCR检测方法的研究[J].微生物学杂志,2009,29(2):101-105.
[11]Prathiba K,Gamini K,Chit L P.Direct identification of Pseudomonas aeruginosa from blood culture bottles by PCR-enzyme linked immunosorbent assay using oprⅠgene specific primers[J].Molecular Cellular Probes,2005,19:417-421.
[12]Kawasaki S,Horikoshi N,Okada Y,et al.Multiplex PCR for simultaneous detection of Salmonellaspp.,Listeria monocytogenes,and Escherichia coliO157:H7 inmeat samples[J].Food Prot,2005,68(3):551-556.
[13]Zhao S,Qaiyumi S,Friedman S,et al.Characterization of Salmonella enterica serotype newport isolated from humans and food animals[J].J Clinical Microbiol,2003,32(7):5366-5371.
