稳定表达T7 RNA聚合酶PK-15细胞系的建立
2011-05-21黄俊华常天明李宏宇仇华吉
黄俊华,贺 番,孙 元,张 鑫,常天明,李宏宇,仇华吉
(中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室/猪传染病研究室,黑龙江 哈尔滨 150001)
T7 RNA聚合酶(RNAP)是T7噬菌体编码的一种依赖于DNA的RNAP,对T7启动子序列具有高度特异性,是分子克隆和反向遗传操作常用的RNAP。T7 RNAP基因能够稳定地整合到哺乳动物细胞的基因组中,并且可以在多种靶细胞内高水平表达[1]。由于T7 RNAP在真核细胞中具有转录活性,广泛应用于病毒拯救[2]。PK-15细胞系是猪瘟病毒(CSFV)等猪源病毒的敏感细胞系,常用于CSFV的分离培养和体外增殖。本研究构建稳定表达T7 RNAP的PK-15细胞系,为CSFV等猪源RNA病毒的反向遗传操作提供有效的方法。
1 材料和方法
1.1 菌株、质粒和细胞 E.coliBL21(DE3)和DH5α均购自Solarbio公司;质粒pLXSN、pET-32a(+)、pDsRed1-N1、PT67细胞和PK-15细胞均由本实验室保存。
1.2 主要试剂 细菌基因组提取试剂盒购自天根公司;pMD18-T、逆转录病毒载体pLXSN、pDsRed1-N1、Platinum®Taq高保真DNA聚合酶和LipfectamineTM2000转染试剂购自Invitrogen公司;质粒提取试剂盒、PCR产物纯化试剂盒、胶回收试剂盒和组织DNA提取试剂盒均购自Omega公司;NdeⅠ、BsrGⅠ、ScaⅠ、XhoⅠ、KpnⅠ、BamHⅠ、SmaⅠ和T4 DNA连接酶均购自NEB公司;抗T7 RNAP单克隆抗体(MAb)购自Novagen公司;新霉素(G418)和FITC标记的羊抗鼠IgG均购自Sigma公司。
1.3 T7 RNAP基因的扩增与克隆 按照试剂盒说明书方法提取BL21(DE3)细菌基因组DNA,根据GenBank登录的T7 RNAP基因(M38308)序列,设计一对引物,PT7RNAP-F:5'-GAGCTCGAGCCACCAT GAACACGATTAACATCG-3';PT7RNAP-R:5'-GAT GGATCCCGTTACGCGAACGCGAAGTCC-3', (下 划线分别为XhoⅠ、BamHⅠ酶切位点,GCCACC ATGG是为提高在真核细胞中表达的Kozak序列[3])。PCR反应程序为:95℃ 5 min;94℃ 30 s、61℃30 s、68℃ 2.5 min,30个循环;72℃ 10 min。扩增片段经胶回收与pMD18-T载体连接,重组质粒pTS-T7RNAP经NdeⅠ和BsrGⅠ酶切鉴定正确后由Invitrogen公司测序。
1.4 表达T7 RNAP的重组逆转录病毒的构建 以ScaⅠ、XhoⅠ和BamHⅠ依次单酶切pTS-T7RNAP,胶回收约2700 bp的片段,与经XhoⅠ和BamHⅠ酶切并回收的pLXSN载体在T4 DNA连接酶的作用下连接构建pLXSN-T7,SmaⅠ和KpnⅠ酶切鉴定。按LipfectamineTM2000说明书方法分别将pLXSN-T7和pLXSN转染PT67细胞,6 h后以含10%胎牛血清的DMEM培养。37℃CO2培养72 h,经消化加入最佳筛选浓度的G418(200 μg/mL),14 d后扩大培养,收集上清,70℃保存,将转染pLXSN-T7和pLXSN所获重组病毒分别命名为rMLV-T7和wtMLV。
1.5 重组逆转录病毒感染PK-15细胞的筛选及鉴定 将rMLV-T7和wtMLV分别接种于PK-15细胞内,吸附4 h,加入含10%血清的DMEM培养液培养24 h,加入最佳筛选浓度的G418(600 μg/mL),培养14 d,将接种rMLV-T7的PK-15细胞用有限稀释法进行单细胞克隆纯化3代,获得的细胞系命名为PK/T7。
以细胞基因组DNA为模板,引物PT7RNAP-F和FT7RNAP-R进行PCR扩增,检测细胞基因组中是否整合了T7 RNAP基因;另取部分细胞铺于96孔板,12 h后吸出孔中的培养液,加入3%多聚甲醛常温固定30 min,加入抗T7 RNAP MAb,37℃1 h,加入 FITC标记羊抗鼠 IgG,37℃ 45 min,PBS洗涤后置于荧光显微镜下观察。
1.6 PK/T7细胞系外源基因转录和表达的检测 将pDsRed1-N1以SacⅠ和NotⅠ双酶切,胶回收红色荧光基因片段与pET-32a(+)载体连接,获得重组质粒pET-RED,经PstⅠ和NcoⅠ酶切鉴定并纯化,经脂质体转染至细胞系PK/T7中,同时转染pDsRed1-N1作为阳性对照,转染pET-32a(+)作为阴性对照,24h后荧光显微镜下观察红色荧光蛋白是否表达。将PK/T7细胞系每隔48 h传代一次,分别取第5代、第10代、第15代和第20代细胞冻存,复苏连续传3代后,用间接免疫荧光试验(IFA)和瞬时表达pET-RED检测该细胞系能否稳定表达有活性的T7 RNAP。
2 结 果
2.1 表达T7 RNAP的重组逆转录病毒的构建 以E.coliBL21(DE3)细菌基因组为模板PCR扩增编码T7 RNAP的基因,结果表明获得大小约为2700 kb的片段,与预期结果(2660 bp)相符;测序结果与GenBank登录的序列一致;T7 RNAP基因与pLXSN载体连接,获得重组质粒pLXSN-T7酶切鉴定正确;pLXSN-T7和pLXSN分别转染PT67细胞内,经G418筛选获得表达T7 RNAP的重组逆转录病毒rMLV-T7和野生型逆转录病毒wtMLV。
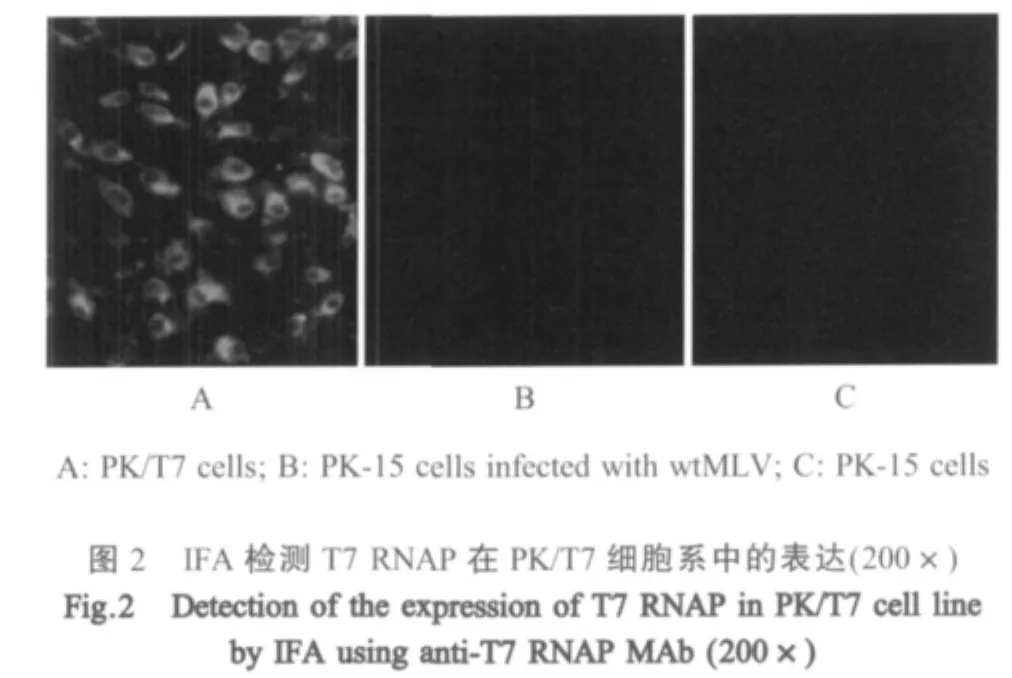
2.2 细胞系的筛选及鉴定 将rMLV-T7和wtMLV分别接种PK-15细胞,经筛选及有限稀释法,对感染rMLV-T7并经过G418筛选的PK-15细胞进行细胞克隆纯化,获得纯化细胞系PK/T7;PCR检测结果表明,PK/T7细胞样品扩增出T7 RNAP特异性条带,感染另外两种逆转录病毒的PK-15细胞均呈PCR阴性反应(图1);生长于96孔板中的PK/T7细胞先后与一抗、二抗作用,荧光显微镜下观察均能观察到特异性绿色荧光,感染wtMLV的PK-15细胞和正常PK-15细胞均未产生绿色荧光(图2)。



2.3 细胞系转录活性的验证及稳定性检测 将pET-RED转染至PCR和IFA检测阳性的PK/T7细胞中,24 h后镜下观察,结果显示,阴阳性对照成立,并且转染pET-RED的孔中有特异性红色荧光,表明筛选所得的细胞系PK/T7中的RNAP具有转录活性。
为验证筛选的PK/T7细胞系的稳定性,采用IFA检测第5代、第10代、第15代和第20代细胞,结果表明各代次的PK/T7细胞均能表达T7 RNAP,而感染wtMLV的PK-15细胞和正常PK-15细胞则为阴性(图3);转染pET-RED后48 h观察,结果显示这4个不同代次的PK/T7表达的T7 RNAP均具有转录活性,阴阳性对照均成立(图4)。
3 讨 论
目前,通常采用体外转录制备病毒基因组RNA的方式拯救猪源RNA病毒,但这种RNA转录子的感染性较弱而且会降低拯救病毒的效率[4-5]。而稳定表达T7 RNAP的细胞系能够实现细胞内转录,避免体外操作时RNA的降解,保证RNA转录本的正确性,使病毒拯救系统更加稳定、高效。研究表明,Buchholz等建立的表达T7 RNAP的BHK衍生细胞系(BSR T7/5),已成功拯救出多种重组病毒[6-7]。Van等建立的稳定表达T7 RNAP的SK6细胞系(SK6.T7)具有能够有效克服病毒体外拯救效率低的缺点,提高CSFV在细胞水平拯救的效率[8]。
利用逆转录病毒载体插入外源蛋白编码序列,转染包装细胞系获得具有感染性的重组逆转录病毒,借此将目的基因整合进宿主细胞染色体内,经筛选可获得表达目的蛋白的细胞系。本研究构建了表达T7 RNAP重组逆转录病毒载体,转染PT67包装细胞系,经G418筛选获得较高滴度的重组逆转录病毒。接种PK-15细胞,经G418持续筛选及单细胞克隆纯化,应用PCR、IFA检测和转染瞬时表达T7启动子控制的红色荧光蛋白的重组质粒,建立了稳定表达具有转录活性的T7 RNAP的PK-15细胞系。该细胞系能够简化CSFV等病毒的拯救策略,实现病毒细胞内拯救,提高重组病毒的拯救效率。
[1]Elroy-Stein O,Moss B.Cytoplasmic expression system based on constitutive synthesis of bacteriophage T7 RNA polymerase in mammalian cells[J].Proc Natl Acad Sci USA,1990,87(17):6743-6767.
[2]Kwon B,Ansari I H,Osorio F A,et al.Infectious clone derived viruses from virulent and vaccine strains of porcine reproductive and respiratory syndrome virus mimic biological properties of their parental viruses in a pregnant sow model[J].Vaccine,2006,24(49-50):7071-7080.
[3]Kozak M.At least six nucleotides preceding the AUG initiator codon enhance translation in mammalian cells[J].J Mol Biol,1987,196(4):947-950.
[4]Moormann R J M,Van Gennip H G P,Miedema G K W,et al.Infectious RNA from an engineered full-length cDNA template of the genome of a pestivirus[J].J Virol,1996,70(2):763-770.
[5]Boyer J C,Haenni A L.Infectious transcripts and cDNA clones of RNA viruses[J].Virology,1994,198(2):415-426.
[6]Buchholz U J,Finke S,Conzelmann K K.Generation of bovine respiratory syncytial virus(BRSV)from cDNA:BRSV NS2 is not essential for virus replication in tissue culture,and the human RSV leader region act s as a functional BRSV genome promoter[J].J Virol,1999,73(1):251-259.
[7]Enterlein S,Volchkov V,Weik M,et al.Rescue of recombinant Marburg virus from cDNA is dependent on nucleocapsid protein VP30[J].J Virol,2006,80(2):1038-1043.
[8]Van Gennip H G P,Van Rijn P A,Widjojoatmodjo M N,et al.Recovery of infectious classical swine fever virus(CSFV)from full length genomic cDNA clones by a swine kidney cell line expressing bacteriophage T7 RNA polymerase[J].J Virol Methods,1999,78(1-2):117-128.
